Стафилококк у новорожденных как лечить: Стафилококк у детей, лечение стафилококка у детей в Москве
симптомы и методы лечения. Чем опасен золотистый стафилококк для ребенка
Что за «зверь» — стафилококк?
Стафилококк — это бактерия, особый микроб. Она соседствует с человеком так же тесно, как и сотни других микроорганизмов. Разновидностей стафилококка великое множество — сегодня медикам известно уже около 27 видов этого микроба. Из них порядка 14 постоянно обитают на коже и в организме человека, и из этих 14 только 3 считаются потенциально опасными для здоровья человека.. Причем нет такого органа в теле человека (и в частности — ребенка), где бы стафилококк не мог жить и размножаться.
Стафилококк у детей может вызвать внушительное количество всевозможных болезней — от банального прыща на коже до воспаления почек, от кишечной инфекции до гнойного менингита и так далее. Существуют также «болячки», которые вызываются только стафилококком (и чаще всего именно золотистым стафилококком) и никаким другим микробом — например, ячмень в глазу, фурункул на коже и прочие.
Но пугаться раньше времени никаких оснований нет. Поскольку (повторимся!) лишь три вида стафилококка реально опасны для здоровья взрослых и детей. Причем, даже их обнаружение в человеческом организме еще не означает развитие инфекции — для старта болезни требуются особые условия. Главное из которых — ослабленный иммунитет.
Поскольку (повторимся!) лишь три вида стафилококка реально опасны для здоровья взрослых и детей. Причем, даже их обнаружение в человеческом организме еще не означает развитие инфекции — для старта болезни требуются особые условия. Главное из которых — ослабленный иммунитет.
Согласно данным, которые сообщает Всемирная организация здравоохранения (ВОЗ), как минимум у 65 % городского населения (включая и детей с новорожденного возраста) стафилококк постоянно присутствует на коже. Еще примерно у 20 % этот микроб появляется эпизодически.
Более того, по данным все той же ВОЗ один из видов опасного стафилококка — а именно золотистый стафилококк — наиболее часто вызывает инфекционное заболевание у людей, которые находятся в стационаре (около 35% всех случаев заболевания золотистым стафилококком у детей регистрируются именно в больницах).
Проще говоря, больше всего шансов подцепить золотистый стафилококк возникает не где-нибудь, а именно в больничной палате. Ведь одно из условий для потенциального развития инфекции — это ослабленный организм с низким иммунитетом. А где «собираются» люди (и в том числе дети!) с ослабленным иммунитетом? Конечно же, в медицинских стационарах…
Ведь одно из условий для потенциального развития инфекции — это ослабленный организм с низким иммунитетом. А где «собираются» люди (и в том числе дети!) с ослабленным иммунитетом? Конечно же, в медицинских стационарах…
Симптомы и лечение золотистого стафилококка у взрослых и детей
Золотистый стафилококк – признаки и лечение. Симптомы золотистого стафилококка в кишечнике у взрослых
Золотистый стафилококк – аэробная бактерия, отличающаяся шарообразной формой и неподвижностью. Может провоцировать развитие разных заболеваний у детей. У взрослых встречается крайне редко. Анализ на золотистый стафилококк поможет выявить его присутствие в окружающей среде – на игрушках и посуде, постельном белье и коже человека, как абсолютно здорового, так и больного.
Классификация инфекции
В медицине выделяют две формы стафилококковой инфекции – генерализованную и очаговую. В первом случае речь идет о сепсисе, когда все системы и органы заражены стафилококком.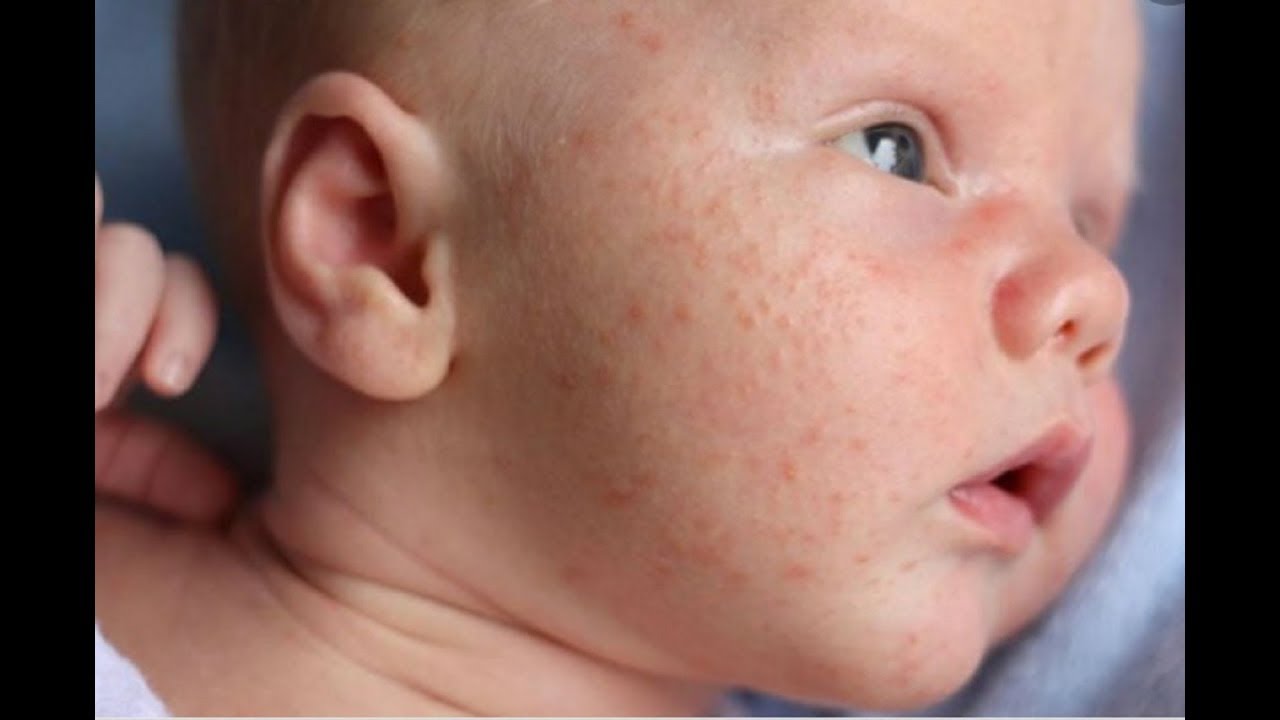 Сепсис – опасное состояние, которое часто заканчивается летальным исходом даже на фоне оказания квалифицированной медицинской помощи.
Сепсис – опасное состояние, которое часто заканчивается летальным исходом даже на фоне оказания квалифицированной медицинской помощи.
Чаще диагностируется очаговая форма стафилококковой инфекции, когда выявляются заболевания кожных покровов, костной ткани, суставов. Отдельно врачи выделяют пищевое отравление токсинами – с характерными симптомами золотистого стафилококка в кишечнике у взрослых.
Стафилококковая инфекция может протекать в легкой, средней и тяжелой степени, острой или хронической форме.
Симптомы стафилококковой инфекции
Аэробную бактерию можно найти на поверхности кожи даже у здорового человека, поэтому удивляться ее наличию не стоит. Инфекция разовьется только в том случае, если «сработают» провоцирующие факторы – сниженный иммунитет, вирусное заболевание, хирургическое вмешательство, травмы, половая инфекция и так далее. Принято считать, что после лабораторного исследования посевов биоматериала, взятого из разных мест организма, можно выявить истинную угрозу наличия стафилококка. Врачи различают несколько степеней присутствия колоний аэробной бактерии. Если колоний обнаружено в пределах 10, а степень равна 6, то это высшая граница нормы. Более высокие показатели будут свидетельствовать о выраженной патологии. Получив результат анализа «золотистый стафилококк на коже 10 в степени 5», беспокоиться не нужно – лечение будет непродолжительным и обязательно с положительным результатом.
Врачи различают несколько степеней присутствия колоний аэробной бактерии. Если колоний обнаружено в пределах 10, а степень равна 6, то это высшая граница нормы. Более высокие показатели будут свидетельствовать о выраженной патологии. Получив результат анализа «золотистый стафилококк на коже 10 в степени 5», беспокоиться не нужно – лечение будет непродолжительным и обязательно с положительным результатом.
Заболевания, вызванные рассматриваемой аэробной бактерией, не имеют каких-либо отличительных признаков. Если золотистый стафилококк поражает горло, то у человека может развиться ангина, фарингиты и ларингиты, отличающиеся тяжелым течением с высокой температурой тела и сильной слабостью. Заболевания дыхательной группы с частыми рецидивами считаются основным признаком присутствия бактерии в зеве.
Кроме этого, золотистый стафилококк может быть выявлен:
- в костной ткани – инфекция проникает при переломах или тяжелых ранениях;
- в фурункулах, карбункулах и абсцессах – как правило, инфицируется волосяная луковица, и процесс воспаления запускается снова и снова даже на фоне проводимого лечения;
- на коже – у ребенка появляются высыпания, дерматиты.

Нередко выявляется золотистый стафилококк у грудничка в кале. Диагностироваться это может еще в роддоме – инфицирование происходит во время тяжелых родов на фоне сниженного иммунитета у недоношенных детей или младенцев с врожденными патологиями.
Самое тяжелое состояние при инфицировании аэробной бактерией – токсический шок. Он отличается характерными симптомами – резким повышением температуры до критических показателей, тошнотой, острой болью в голове, сыпью на теле, появлением гнойного отделяемого из имеющихся ран. В таком случае никакие исследования не проводятся – только золотистый стафилококк может вызвать данное состояние. Назначается срочная терапия.
Лечение золотистого стафилококка
Антибиотики против золотистого стафилококка не всегда эффективны, поэтому их назначают лишь на начальной стадии развития заболевания. Эффективными будут только антибиотики последнего поколения – цефалоспорины и другие непенициллинового ряда.
Чаще всего врачи применяют комбинированную терапию. Если требуется лечение золотистого стафилококка в горле у ребенка, то будут назначены:
Если требуется лечение золотистого стафилококка в горле у ребенка, то будут назначены:
- обработка слизистой антисептическими растворами – хлорфиллиптом;
- иммуностимулирующие препараты;
- антистафилококковый бактериофаг.
Многих интересует, как вылечить золотистый стафилококк в зеве, который вызывает частые ангины, ларингиты, тонзиллиты. Без назначений врача не обойтись – привычные лекарственные препараты не помогают либо дают кратковременный эффект выздоровления. Специалист даст рекомендации по обработке слизистой глотки антисептическими растворами, проведет исследование на восприимчивость бактерии к антибиотикам и сделает медикаментозные назначения.
Чаще всего колонии рассматриваемых бактерий обнаруживаются в носу – они могут годами там находиться и не вызывать никаких заболеваний. Если же ребенок часто простужается, имеет отставание в росте и развитии, то хронических патологий не избежать. Как лечить золотистый стафилококк в носу у детей:
- госпитализировать ребенка в лечебное учреждение;
- проводить ежедневную санацию слизистой носа и глотки, так как имеется большой риск распространения инфекции;
- выполнять назначения врача для снятия тяжелых симптомов.

Независимо от того, какой именно орган поражен стафилококком, обязательно будут назначаться витамины, иммуномодуляторы и пробиотики для восстановления кишечной микрофлоры.
Длительность лечения стафилококковой инфекции – от 7 до 30 дней, что зависит от своевременности диагностирования заболевания и выявления больших колоний бактерии. Если терапия проводится в точном соблюдении назначений лечащего врача, то прогноз по заболеванию благоприятный.
Более подробно о том, как передается золотистый стафилококк и какие симптомы укажут на наличие аэробных бактерий, можно узнать на нашем сайте Добробут.ком.
Наука: Наука и техника: Lenta.ru
Многие ученые и врачи считают, что человечество вступает в новую эру, когда антибиотики, спасающие множество жизней, перестают быть эффективными против новых штаммов микробов. Ситуация обостряется с каждым годом во многом из-за того, что люди злоупотребляют препаратами и буквально сами взращивают неуязвимые бактерии. Золотистый стафилококк, устойчивый к метициллину, — как раз один из таких смертельно опасных монстров. «Лента.ру» пишет, чем опасны новые штаммы стафилококков, откуда они появились и можно ли их победить.
Золотистый стафилококк, устойчивый к метициллину, — как раз один из таких смертельно опасных монстров. «Лента.ру» пишет, чем опасны новые штаммы стафилококков, откуда они появились и можно ли их победить.
Тяжелый случай
В 2008 году в педиатрическое отделение при Университете Аристотеля (Греция) поступила десятилетняя девочка с царапиной на локте правой руки. У ребенка в последние три дня держалась высокая температура 40 градусов, и она с трудом могла двигать правой ногой. Врачи диагностировали воспаление правого тазобедренного сустава. Заподозрив бактериальную инфекцию, врачи назначили антибиотик клоксациллин. Тогда они еще не знали, что столкнулись со смертельно опасным противником.
Состояние девочки ухудшалось с каждым часом. Проявились симптомы поражения мозга и серьезные нарушения дыхания из-за проникновения инфекции в легкие. Стало ясно, что клоксациллин не помогает, поэтому было назначено сразу несколько новых антибиотиков. На пятый день рентген показал обширное поражение правой бедренной кости и прилегающей мышечной ткани.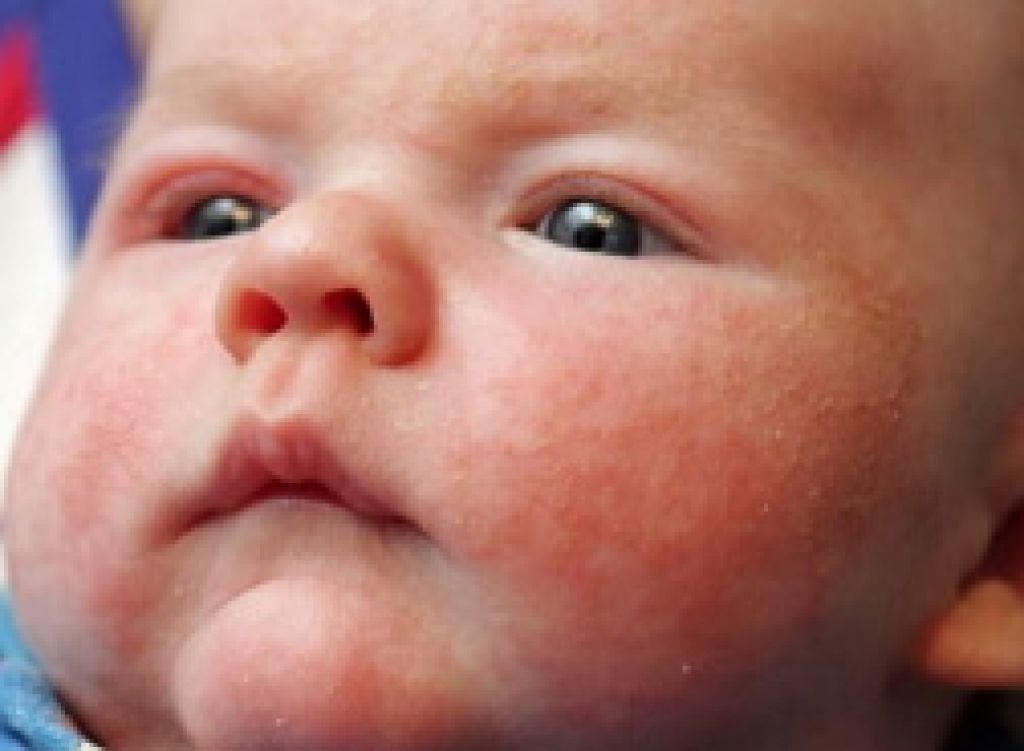 Доктора провели дренирование мягких тканей на ноге и выпустили гной, в котором кишели метициллинрезистентные золотистые стафилококки (МРЗС).
Доктора провели дренирование мягких тканей на ноге и выпустили гной, в котором кишели метициллинрезистентные золотистые стафилококки (МРЗС).
Микробные культуры золотистого стафилококка
Фото: Andrei Papkou
Девочка находилась в критическом состоянии целую неделю, после чего ее самочувствие стало улучшаться благодаря интенсивной терапии. Однако инфекция терроризировала организм ребенка в течение нескольких месяцев, бактерии практически «объели» кость. На полное восстановление организма после тяжелой инфекции потребовалось три года. Девочке сильно повезло, потому что благополучный исход составляет лишь небольшой процент подобных случаев.
МРЗС обычно связан с внутрибольничными инфекциями. Иными словами, пациенты в больницах, имеющие раны и ослабленный иммунитет, являются основной группой риска. Золотистый стафилококк способен выживать в почти стерильных условиях и распространяется несмотря на дезинфекцию. Но, к сожалению, МРЗС встречается и за пределами больниц, в этом случае он называется бытовым. Именно его подхватила десятилетняя пациентка через обыкновенную царапину. Стафилококк может и не вызвать инфекции, но если организм по какой-то причине ослаблен, последствия могут быть катастрофическими.
Именно его подхватила десятилетняя пациентка через обыкновенную царапину. Стафилококк может и не вызвать инфекции, но если организм по какой-то причине ослаблен, последствия могут быть катастрофическими.
Поедающие заживо
МРЗС является одной из тех самых «пожирающих плоть бактерий», о которых СМИ рассказывают леденящие душу истории. Этот микроб отвечает за треть всех случаев некротизирующего фасциита — тяжелой инфекции, буквально разъедающей мягкие ткани организма. Входными воротами для смертельно опасного микроба может быть порез или ожог, хотя известны случаи, когда фасциит развивался после употребления сырых морепродуктов. Зубные болезни тоже повышают риск инфекции.
Впрочем, некротизирующий фасциит можно предотвратить, если правильно ухаживать за ранами, мыть руки и следить за гигиеной полости рта. При лечении врачи ампутируют пораженные ткани и вводят ударную смесь антибиотиков. Однако даже при правильном и своевременном лечении треть пациентов умирает.
Легкие, пораженные стафилококком
Фото: Wikipedia
В 2015 году врачи сообщили о крайне необычном случае некротизирующего фасциита, вызванного бытовым стафилококком. Инфекция развивалась молниеносно у пациента с нормальной иммунной системой. Мужчина в возрасте 52 лет поступил в больницу с невыносимой болью в левом бедре и отеком, который держался уже неделю. На коже ноги виднелись гематомы, пузыри, а пораженные участки потеряли чувствительность. Несмотря на агрессивную терапию, хирургическую обработку раны и прием антибиотиков широкого спектра действия больной скончался от сепсиса менее чем через 24 часа после обращения. У мужчины не было никаких травм или предполагаемых контактов с МРЗС, однако он лечился от остеоартроза левого колена периодическими инъекциями стероидов. Последняя инъекция была сделана за три недели до начала симптомов.
Инфекция развивалась молниеносно у пациента с нормальной иммунной системой. Мужчина в возрасте 52 лет поступил в больницу с невыносимой болью в левом бедре и отеком, который держался уже неделю. На коже ноги виднелись гематомы, пузыри, а пораженные участки потеряли чувствительность. Несмотря на агрессивную терапию, хирургическую обработку раны и прием антибиотиков широкого спектра действия больной скончался от сепсиса менее чем через 24 часа после обращения. У мужчины не было никаких травм или предполагаемых контактов с МРЗС, однако он лечился от остеоартроза левого колена периодическими инъекциями стероидов. Последняя инъекция была сделана за три недели до начала симптомов.
МРЗС вызывает не только инфекции мягких тканей. Стафилококк наряду с некротизирующим фасциитом способен провоцировать смертельную некротизирующую пневмонию или внутреннюю гангрену, быстро разрушающую легочные ткани. В большинстве случаев заболевание приводит к летальному исходу, даже несмотря на ударную дозу сильнодействующих антибиотиков, нацеленных против стафилококков. Такая пневмония чаще развивается у детей и молодых взрослых, особенно после вирусной респираторной инфекции, однако поражает и людей старшего возраста.
Такая пневмония чаще развивается у детей и молодых взрослых, особенно после вирусной респираторной инфекции, однако поражает и людей старшего возраста.
Опасный вид
Ежегодно в США регистрируется почти 300 тысяч госпитализаций, связанных с золотистым стафилококком, при этом почти половина приходится на МРЗС. Бытовой стафилококк отличается от внутрибольничного генетически. В Северной Америке наиболее распространен «суперзаразный» штамм USA300.
Материалы по теме:
Устойчивость к метициллину придает ген mecA, располагающийся в так называемой стафилококковой кассетной хромосоме (SCC, staphylococcal cassette chromosome), которые у разных штаммов имеют разное строение. Бытовые штаммы имеют меньшую и менее сложную версию SCC, специалисты ее обозначают как SCC mecA типа IVa. Она содержит меньше генов, способствующих устойчивости, чем внутрибольничные виды МРЗС, однако включает уникальные гены вирулентности, то есть способности вызывать заболевания или гибель организма. Таким образом бытовые штаммы легче поддаются лечению, но они убивают быстрее, чем те, что атакуют пациентов больниц и клиник. Гены вирулентности производят токсины, представляющие опасность даже для здоровых людей с нормальным иммунитетом. Один из таких токсинов — лейкоцидин Пантона-Валентайна (PVL) — помогает бактерии бороться с клетками иммунитета. Попадание МРЗС, вырабатывающих PVL, в организм человека часто приводит к инфекции мягких тканей, в том числе некротизирующему фасцииту.
Гены вирулентности производят токсины, представляющие опасность даже для здоровых людей с нормальным иммунитетом. Один из таких токсинов — лейкоцидин Пантона-Валентайна (PVL) — помогает бактерии бороться с клетками иммунитета. Попадание МРЗС, вырабатывающих PVL, в организм человека часто приводит к инфекции мягких тканей, в том числе некротизирующему фасцииту.
Распространение золотистого стафилококка в Европе
Изображение: Wikipedia
Штамм USA300 прибыл в Северную Америку в первой половине XX века из Европы, где он появился в середине XIX века. Тогда он был менее заразным и не имел многих мутаций, сейчас делающих его смертельно опасным. Роковую роль в создании супермикроба-монстра сыграл заразивший стафилококк вирус — бактериофаг ϕSa2USA, который нес в себе ген, кодирующий PVL. В начале третьего тысячелетия штамм получил широкое распространение в США, а также переселился в Южную Америку, Европу, Африку и Азиатско-Тихоокеанский регион. Считается, что к 2001 году МРЗС колонизировал примерно восемь процентов населения США.
Бой с монстром
Журналистка Соня Шах в своей книге «Пандемия: Всемирная история смертельных вирусов» так вспоминает свою встречу с бытовым МРЗС, которым заразился ее сын: «Педиатр, обычно шутливая и жизнерадостная, взглянув на колено моего сына, резко посуровела. Назначение она выписала, не дожидаясь результатов анализов: сильный антибиотик клиндамицин, старый добрый и надежный бактрим и в придачу жесткий режим избавления от гноя с помощью горячих компрессов и выдавливания… Каждую каплю требовалось аккуратно подбирать и удалять, чтобы она не просочилась в микротрещины на коже или, что еще хуже, не поселилась на полотенцах, постелях, обивке или свободных поверхностях, где она может ждать своего часа целый год».
Золотистый стафилококк
Фото: Wikipedia
Ребенок выздоровел, однако, несмотря на все усилия и гигиенические процедуры, семье не удалось полностью избавиться от МРЗС. Рецидив сначала случился у сына, так как стафилококк поселился у него в организме, иногда проявляясь в виде болезненных нарывов, наполненных гноем. Через некоторое время инфекция перешла и на журналистку. Шах пишет, что хроническая инфекция затихла сама собой, несмотря на всю борьбу с коварными микробами. Тем не менее в запущенных случаях иногда единственным способом остановить заражение остается ампутация конечностей.
Через некоторое время инфекция перешла и на журналистку. Шах пишет, что хроническая инфекция затихла сама собой, несмотря на всю борьбу с коварными микробами. Тем не менее в запущенных случаях иногда единственным способом остановить заражение остается ампутация конечностей.
Пока МРЗС остается восприимчив к ряду антибиотиков, не принадлежащих бета-лактамам. Однако обнаруживаются новые штаммы, которые проявляют устойчивость и к другим лекарствам. Ситуацию осложняет то, что антибиотики применяют повсеместно и часто неправильно, что только провоцирует размножение бактерий, вызывающих трудноизлечимые или вообще неизлечимые инфекции. При этом антибиотики новых классов изобретаются достаточно редко, а эффективных заменителей, к сожалению, пока не существует.
Посев отделяемого носа на золотистый стафилококк и определение чувствительности к антибиотикам
Микробиологическое исследование, позволяющее выявить инфицированность золотистым стафилококком и определить количество возбудителя.
Золотистые стафилококки (Staphylococcus aureus) – грамположительные условно-патогенные бактерии рода Staphylococcus, являющиеся наиболее частой причиной стафилококковых, в частности внутрибольничных, инфекций. Золотистые стафилококки в норме могут располагаться на коже, слизистой оболочке носа и реже в гортани, влагалище, кишечнике. Они встречаются у 30 % здоровых людей.
Если у человека слабая иммунная система или нарушен нормальный состав микрофлоры, то при повреждении кожи (слизистых оболочек) золотистый стафилококк может приводить к разнообразным местным и системным инфекционно-воспалительным поражениям:
- кожи (карбункулам, импетиго, фолликулиту),
- молочных желез (маститу),
- дыхательных путей и ЛОР-органов (тонзиллиту, гаймориту, отиту, фарингиту, лариноготрахеиту, пневмонии),
- мочевыводящих путей (уретриту, циститу, пиелонефриту),
- пищеварительной системы (энтеритоколиту, аппендициту, перитониту, парапроктиту, холециститу),
-
костно-суставной системы (остеомиелиту, артриту).

В отдельных случаях возможна генерализация инфекции с развитием септикопиемии. Производимый золотистым стафилококком энтеротоксин вызывает пищевые отравления и синдром токсического шока. Основные источники инфекции: здоровые (носители) и больные люди, домашние и сельскохозяйственные животные, а также пища, содержащая возбудителя инфекции (чаще всего это сахаросодержащие молочные продукты). Инфицирование может происходить контактным и воздушно-пылевым путем. Возможно аутоинфицирование.
Определение количества бактерий может потребоваться, например, чтобы понять, нужно ли проводить лечение: в некоторых случаях, если количество небольшое, лечение не проводится. Решение о его необходимости зависит от клинических проявлений, а также от количества стафилококка.

Многое зависит от возраста пациента. Например, золотистый стафилококк в количестве 104 является вполне нормальным показателем для детей старше 1 года, но у грудных детей в таком количестве уже потребует лечения.

В любом случае наличие стафилококка при отсутствии симптомов болезни – еще не повод к назначению лекарств.
Количество стафилококка может определяться до и после лечения. Если выясняется, что рост возбудителя обильный, значит, инфекция набирает обороты, предыдущая терапия была неудачной и срочно требуется новый курс лечения; умеренный и скудный рост микроорганизмов по результатам последних анализов говорит об успешности терапии. Кроме того, в дальнейшем необходимо контролировать количество стафилококков в течение 1 или 2 месяцев после пройденного лечения.
Отмечено также, что после пребывания больных в хирургической клинике стафилококк обнаруживался у них вдвое чаще, чем при поступлении. У больных, поступающих в стационары, наблюдается замена антибиотикочувствительных стафилококков на антибиотикоустойчивые.
 Поэтому так важно установить, какие антибиотики будут эффективны при лечении стафилококка.
Поэтому так важно установить, какие антибиотики будут эффективны при лечении стафилококка.Используется исследование:
- Для определения целесообразности лечения.
- Для дифференциации бактерионосительства и опасного инфицирования.
- Для контроля за состоянием пациента после проведенного лечения.
- Для того чтобы подтвердить, что стафилококк является причиной возникшего заболевания (об этом свидетельствуют высокие показатели посева).
Что означают результаты?
Референсные значения: нет роста.
Золотистый стафилококк в мазке в небольших количествах является частью нор¬мальной микрофлоры человека. Значительное повышение стафилококка в мазке может быть симптомом воспалительного процесса, кожных инфекций (угри и пр.) и смертельно опасных заболеваний (пневмония, остеомиелит, эндокардит и др.). Результат посева интерпретирует врач исходя из того, в каком количестве выделены микроорганизмы. Также прилагается заключение о чувствительности стафилококка к различным антибиотикам, в зависимости от которого назначается лечение теми или иными препаратами.
Также прилагается заключение о чувствительности стафилококка к различным антибиотикам, в зависимости от которого назначается лечение теми или иными препаратами.
Исследование проводить до начала или через 2 недели после окончания антибактериальной, антимикотической терапии. Не требует подготовки. Забирается специалистом.
Мясников рассказал о борьбе с инфекцией
Рубрику «Простые истины» своей еженедельной программы Александр Мясников посвятил вопросам гигиены, которые очень важны для профилактики и борьбы с опасной стафилококковой инфекцией. 30 процентов населения Земли являются носителями стафилококка, и огромное количество болезней – пневмония, эндокардит, артрит, сепсис – вызываются стафилококками. Целые больницы, роддома закрываются из-за внутрибольничной стафилококковой инфекции.
Истина №1. Гигиенические тампоны могут быть опасны. В конце 70-х годов был описан так называемый токсический стафилококковый шок у молодых женщин, которые пользовались тампонами. Было обнаружено, что после менструации через какое-то время у женщин, которые пользовались тампонами, резко поднималась температура, появлялись высыпания, затруднялось дыхание, падало давление, поражались печень и почки. По словам доктора Мясникова, в патологии самого токсического стафилококкового шока очень много схожего с COVID-19. «Коронавирус, попадая в легкие, вызывает не пневмонию, а именно выброс цитокинов, коагуляцию, внутрисосудистое свертывание. Ровно то же самое вызывает стафилококк!» – объяснил Александр Леонидович и добавил, что не только гигиенические тампоны провоцируют синдром токсического стафилококкового шока, но и хирургия, и любые тампоны!
В конце 70-х годов был описан так называемый токсический стафилококковый шок у молодых женщин, которые пользовались тампонами. Было обнаружено, что после менструации через какое-то время у женщин, которые пользовались тампонами, резко поднималась температура, появлялись высыпания, затруднялось дыхание, падало давление, поражались печень и почки. По словам доктора Мясникова, в патологии самого токсического стафилококкового шока очень много схожего с COVID-19. «Коронавирус, попадая в легкие, вызывает не пневмонию, а именно выброс цитокинов, коагуляцию, внутрисосудистое свертывание. Ровно то же самое вызывает стафилококк!» – объяснил Александр Леонидович и добавил, что не только гигиенические тампоны провоцируют синдром токсического стафилококкового шока, но и хирургия, и любые тампоны!
Истина №2. Не давите прыщи! 30 процентов людей являются носителями золотистого стафилококка. Соответственно, в больнице – каждый второй. Стафилококк до поры «спит». Мы носители! Иногда у некоторых бывает упорный фурункулез. Прыщи мы начинаем давить, гной попадает под кожу. И маленький прыщик перерастает во флегмону.
Прыщи мы начинаем давить, гной попадает под кожу. И маленький прыщик перерастает во флегмону.
Истина №3. Не пользуйтесь чужой косметикой и чужими личными вещами. Помните: каждый третий – носитель золотистого стафилококка. «И если для него это «родной» стафилококк… Почему? Потому что на коже находятся другие бактерии, которые являются частью микробиома и являются частью нашего защитного иммунитета», – отметил Мясников. Стрептококки – те бактерии, которые в норме содержатся на коже, «защищают». Приходят стафилококки – и начинают их «прогонять», начинают их «пожирать», не пускать. Это приводит к фурункулезу.
«Все вопросы о личной безопасности и гигиене как бы надоели, но, тем не менее, инфекции всегда будут вокруг нас. Сойдет на нет коронавирус – стафилококк никуда не уйдет, – подвел итог знаменитый врач. – Поэтому помните об элементарных гигиенических привычках».
Страница не найдена |
Страница не найдена | 404. Страница не найдена
Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
14151617181920
21222324252627
28
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Мар
Апр
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
как выглядит и проявляется, последствия
Стафилококк относится к группе микробов широко распространенных в окружающей среде. Для большинства людей стафилококки не опасны, являясь частью условно-патогенной флоры. Но, если стафилококк выявляется у маленьких детей – это может быть опасным. За счет сниженного иммунитета новорожденные могут заражаться стафилококком с развитием тяжелых инфекций.
Для большинства людей стафилококки не опасны, являясь частью условно-патогенной флоры. Но, если стафилококк выявляется у маленьких детей – это может быть опасным. За счет сниженного иммунитета новорожденные могут заражаться стафилококком с развитием тяжелых инфекций.
Новорожденные обладают сниженным иммунитетом, особенно, если они рождены ранее срока, беременность была тяжелой или протекала с осложнениями, был гестоз. Также особенно подвержены стафилококку новорожденные малыши с низкой массой тела к рождению, наличием врожденных отклонений в развитии, при нарушении гигиены ребенка и плохом за ним уходе. Ребенок из стерильных условий матки попадает в среду, полную микробов, они активно заселяют его кожу и пищеварительный тракт, слизистые. Если организм незрелый и иммунная защита слаба, микробы могут активизироваться и дать заболевание.
Вызывать патологии могут разные виды стафилококка. К ним относятся:
К ним относятся:
- кишечный стафилококк у новорожденных, который может давать заболевания пищеварительного тракта или мочеполовой системы
- гемолитический стафилококк у новорожденных, который может приводить к ангинам или поражениям дыхательных путей
- золотистый стафилококк, который может давать поражения всех внутренних органов вплоть до сепсиса (заражение крови, всего организма).
- эпидермальный стафилококк у новорожденных, который поражает слизистые и кожу у сильно ослабленных детей, нарушает заживление ран.
Чем опасен стафилококк у новорожденных
Стафилококковая инфекция у совсем малышей может давать разные проявления болезни, от поражений кожи до поражения практически всех внутренних органов. Некоторые формы стафилококка, особенно внутрибольничные, могут быть очень агрессивными. Они дают тяжелые пневмонии, пиелонефриты, поражения организма в виде сепсиса – заражение крови с крайне тяжелым течением. Инфекция может развиваться быстро и буквально за пару дней приобрести тяжелое агрессивное течение потому, что иммунитет новорожденного не в силах побороть инфекцию. Стафилококки широко распространены, они могут попасть к ребенку о матери, от персонала или других детей, носителей стафилококка или больных инфекцией.
Стафилококки широко распространены, они могут попасть к ребенку о матери, от персонала или других детей, носителей стафилококка или больных инфекцией.
Эпидермальный стафилококк у новорожденных
Данный вид стафилококковой инфекции приводит к поражениям слизистых носа, горла, кожных покровов и глаз. На коже здоровых носителей с крепким иммунитетом он не приносит никакого вреда. А вот у ослабленных новорожденных он может давать развитие достаточно тяжелого стафилококкового поражения, которое потребует лечения в стационаре и длительного восстановления. Обычно такой стафилококк дает кожные формы с гнойничками, поражения носоглотки и дыхательной системы и инфицируют послеоперационные раны.
Как выглядит стафилококк у новорожденных
Сложно однозначно ответить, как выглядит стафилококк у новорожденных, потому что форм стафилококковой инфекции очень много. Если инфекция поражает кожные покровы, возникают особые поражения кожи – пиодермии. Проявления сыпи при стафилококке у новорожденных можно посмотреть на фото, обычно это обильная гнойничковая сыпь на коже с краснотой и мокнутием, могут быть нагноения вплоть до абсцессов, фурункулов и карбункулов, которые нужно немедленно лечить.
Во многих медицинских руководствах есть фото проявлений стафилококка у новорожденных. Это поражения глаз, слизистых рта, кожных покровов или общее поражение организма вплоть до сепсиса.
Как проявляется стафилококк у новорожденных
Проявления стафилококка у малышей будут зависеть от того, какой вид стафилококка подцепил малыш и насколько слабы его системы защиты. При поражении кожи возникают гнойничковые высыпания с краснотой и воспалением, вплоть до формирования обширных гнойных поражений — абсцессов.
При поражении носоглотки развиваются насморк, боли в горле вплоть до ангины, кашель и признаки простуды. Но протекает такая простуда тяжело, с высокой температурой и интоксикацией. Поражения глаз выражаются в гнойном конъюнктивите и блефарите, могут серьезно поражаться роговица и другие ткани глаза. Кишечные проявления стафилококка будут проявляться сильными поносами, рвотами и признаками кишечной инфекции. Дети плачут и капризничают из-за болей в животе. Инфекция может протекать тяжело с сильным обезвоживанием, температурой и токсикозом. Могут поражаться почки с изменениями в моче – лейкоцитами, кровью, гноем. Но особенно опасно состояние сепсиса – это проникновение стафилококка в кровь и распространение его по всем органам и системам, внутри которых формируются гнойные очаги. Это смертельно опасное осложнение стафилококковой инфекции, которого никак нельзя допускать!
Инфекция может протекать тяжело с сильным обезвоживанием, температурой и токсикозом. Могут поражаться почки с изменениями в моче – лейкоцитами, кровью, гноем. Но особенно опасно состояние сепсиса – это проникновение стафилококка в кровь и распространение его по всем органам и системам, внутри которых формируются гнойные очаги. Это смертельно опасное осложнение стафилококковой инфекции, которого никак нельзя допускать!
Последствия стафилококка у новорожденных
Обычно стафилококки хорошо лечатся, они чувствительны к антибиотикам и инфекцию у ребенка достаточно быстро устраняют. Но иногда стафилококковая инфекция переходит в бессимптомное носительство, ребенок может заражать других детей и носить в себе «бомбу часовым механизмом». При ослаблении иммунитета стафилококк может активироваться и дать тяжелые проявления инфекции. Важно полностью избавляться от патогенных форм стафилококка, чтоб не рисковать здоровьем малыша.
Теги по теме: здоровьемалыш 0-1Оцените материал:
спасибо, ваш голос принят
Длительность лечения антибиотиками и профилактика осложнений при неонатальной бактериемии, вызванной Staphylococcus aureus
Задний план: У взрослых с бактериемией Staphylococcus aureus короткая продолжительность эффективного лечения антибиотиками связана с повышенным риском осложнений и рецидивов. Оптимальная продолжительность лечения новорожденных неизвестна, и практика широко варьируется.
Оптимальная продолжительность лечения новорожденных неизвестна, и практика широко варьируется.
Цель: Связать длительность лечения неонатального С.aureus для профилактики осложнений и рецидивов.
Методы: Ретроспективное когортное исследование подтвержденной бактериемии, вызванной S. aureus, возникшей в течение 10 лет в двух крупных третичных неонатальных отделениях. Неонатальные пациенты, у которых развилась подтвержденная бактериемия, вызванная S. aureus, между рождением и выпиской из неонатального отделения, были идентифицированы по записям отделения микробиологии.Клинические данные, полученные из историй болезни, включали демографические данные, продолжительность антибиотикотерапии и клинические исходы. Рецидив определяли по лабораторным и клиническим записям. Неблагоприятные исходы были связаны с длительностью антибактериальной терапии.
Неблагоприятные исходы были связаны с длительностью антибактериальной терапии.
Результаты: В общей сложности 90 младенцев имели бактериемию, вызванную S. aureus, из которых шесть были устойчивыми к метициллину S. aureus (7%). Медиана беременности составила 27 недель (диапазон: 23-41), масса тела при рождении 846 г (434-3840) и постнатальный возраст 16 дней (0-116).Неблагоприятные исходы были обнаружены в 44%, с летальным исходом в 8%. Средняя продолжительность соответствующих антибиотиков составила 19 дней (диапазон: 0-54). Случаев рецидива бактериемии после окончания антибиотикотерапии не было. Связи между длительностью антибиотикотерапии и осложнениями не выявлено.
Вывод: Неонатальная бактериемия, вызванная S. aureus, в основном поражала недоношенных новорожденных и характеризовалась значительной заболеваемостью и смертностью. Рецидив бактериемии наблюдался редко, независимо от продолжительности лечения. Для пациентов неонатальных отделений с бактериемией, вызванной S. aureus, антибиотикотерапия в течение 14 дней в неосложненных случаях может быть достаточной для предотвращения рецидива, при этом более длительное лечение оправдано, если отсутствует неадекватный контроль источника.
Рецидив бактериемии наблюдался редко, независимо от продолжительности лечения. Для пациентов неонатальных отделений с бактериемией, вызванной S. aureus, антибиотикотерапия в течение 14 дней в неосложненных случаях может быть достаточной для предотвращения рецидива, при этом более длительное лечение оправдано, если отсутствует неадекватный контроль источника.
Ключевые слова: антибиотики; осложнения; младенец новорожденный; септицемия; Золотистый стафилококк.
Оценка и лечение внебольничных инфекций, вызванных золотистым стафилококком, у доношенных и поздненедоношенных ранее здоровых новорожденных | Педиатрия
ЦЕЛЬ.Мы описываем оценку и лечение неонатального внебольничного Staphylococcus aureus в эпоху внебольничного метициллин-резистентного S. aureus .
МЕТОДЫ. Мы ретроспективно рассмотрели оценку и лечение 126 внебольничных инфекций S aureus у доношенных и поздних недоношенных ранее здоровых новорожденных в возрасте ≤30 дней в период с августа 2001 г. по июль 2006 г. в Детской больнице Техаса.
по июль 2006 г. в Детской больнице Техаса.
РЕЗУЛЬТАТЫ. инфекций, вызванных S. aureus , включали 43 случая пустулеза, 68 случаев флегмоны/абсцесса и 15 инвазивных инфекций.Мы обнаружили 84 метициллин-устойчивых и 42 метициллин-чувствительных изолята S. aureus . Двадцать один пациент получал антибиотики амбулаторно до госпитализации. Оценка системной инфекции включала посев мочи, крови и спинномозговой жидкости у 79, 102 и 84 новорожденных соответственно. Посев выявил инфекций мочевыводящих путей, вызванных S. aureus , у 1, бактериемий, вызванных S. aureus , у 6 и асептический плеоцитоз спинномозговой жидкости неясной этиологии у 11 новорожденных. Врачи госпитализировали 106, перевели 5 в другие больницы и выписали 15 пациентов без лихорадки, назначив им местные или пероральные антибиотики.Клиндамицин был преобладающим антистафилококковым внутривенным и пероральным антибиотиком при инфекциях пустулеза и флегмоны/абсцесса. Один пациент с системной инфекцией S aureus и вирусом простого герпеса умер. При выписке после стационарного лечения врачи не назначали антибиотики 43 пациентам, пероральные или местные антибиотики — 62 пациентам. Амбулаторное лечение было безуспешным у 1 больного, выписанного после внутривенной терапии и повторно госпитализированного. Восемьдесят процентов (16 из 20) пациентов с одним лишь маститом завершили лечение пероральными антибиотиками амбулаторно.
При выписке после стационарного лечения врачи не назначали антибиотики 43 пациентам, пероральные или местные антибиотики — 62 пациентам. Амбулаторное лечение было безуспешным у 1 больного, выписанного после внутривенной терапии и повторно госпитализированного. Восемьдесят процентов (16 из 20) пациентов с одним лишь маститом завершили лечение пероральными антибиотиками амбулаторно.
ВЫВОДЫ. Стратегии оценки и лечения неонатальной внебольничной болезни S. aureus в нашей больнице разнообразны. Необходимы проспективные исследования для определения оптимальных стратегий лечения.
Исследование «Лечение родителей для снижения передачи золотистого стафилококка в отделении интенсивной терапии» (ЛЕЧЕНИЕ РОДИТЕЛЕЙ): протокол многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования
Сильные стороны и ограничения этого исследования измерить эффективность лечения родителей в качестве стратегии снижения распространения
Staphylococcus aureus в отделении интенсивной терапии новорожденных.
Методологические сильные стороны включают: два исследовательских центра, скрытое вмешательство с плацебо-контролем, скрытую оценку результатов и намерение лечить план анализа.
Исследовательские подразделения имеют интенсивные программы инфекционного контроля S. aureus и низкую заболеваемость S. aureus , поэтому первичным результатом является приобретение S. aureus , а не S. aureus инфекции.
Введение
Ежегодно в США в отделениях интенсивной терапии новорожденных (ОИТН) возникает более 33 000 внутрибольничных инфекций (ИСМП).1 По оценкам, ИСМП ежегодно приводят к расходам на здравоохранение в размере 28–45 миллиардов долларов США.2 В дополнение к краткосрочным затратам, связанным с ИСМП, неонатальные инфекции способствуют неврологическим нарушениям и плохим результатам роста.3,4 Staphylococcus aureus ( S. aureus ) является вторым наиболее распространенным патогеном, вызывающим ИСМП у новорожденных. 5 Исследование младенцев с очень низкой массой тела при рождении в 20 отделениях интенсивной терапии новорожденных США показало, что у 3,7% развиваются инфекции кровотока или центральной нервной системы с смертностью, приближающейся к 20%.6 Несмотря на агрессивные меры по предотвращению инфекции S. aureus у новорожденных, бремя заболевания S. aureus в этой популяции остается высоким.7,8
5 Исследование младенцев с очень низкой массой тела при рождении в 20 отделениях интенсивной терапии новорожденных США показало, что у 3,7% развиваются инфекции кровотока или центральной нервной системы с смертностью, приближающейся к 20%.6 Несмотря на агрессивные меры по предотвращению инфекции S. aureus у новорожденных, бремя заболевания S. aureus в этой популяции остается высоким.7,8
2 месяцев жизни.9,10 Вертикальная передача S. aureus встречается редко, но постнатальная передача от матери здоровым младенцам в первые несколько месяцев жизни обычна.9,11 Хотя медицинские работники были вовлечены в качестве источника распространения с.aureus в отделениях интенсивной терапии, они часто не являются источником передачи S. aureus в отделениях интенсивной терапии. Родители, а не медицинские работники, могут быть ключевым резервуаром, из которого новорожденные получают колонизацию S. aureus в отделении интенсивной терапии новорожденных. поощряется и может способствовать передаче S. aureus , в то время как общие меры по профилактике внутрибольничных инфекций снизили передачу S.золотистый . Этот протокол описывает судебное разбирательство о лечении ( лечение ING PA ) до RE DUCE N Eonatal T проживание T S . Aureus ), Рандомизированные, маскированные, плацебо-контролируемые испытание который будет измерять влияние лечения родителей коротким курсом интраназального введения мупироцина и местного антисептика хлоргексидином на колонизацию S. aureus и инфекцию у новорожденных (ClinicalTrials.gov NCT02223520). В отличие от подхода, ориентированного на пациента (скрининг и лечение новорожденных, колонизированных S. aureus ), который имеет ограничения в неонатальной популяции,20,21 в исследовании TREAT PARENT тестируется подход, ориентированный на родителей, который может устранить или отсрочить воздействие на новорожденного S.
поощряется и может способствовать передаче S. aureus , в то время как общие меры по профилактике внутрибольничных инфекций снизили передачу S.золотистый . Этот протокол описывает судебное разбирательство о лечении ( лечение ING PA ) до RE DUCE N Eonatal T проживание T S . Aureus ), Рандомизированные, маскированные, плацебо-контролируемые испытание который будет измерять влияние лечения родителей коротким курсом интраназального введения мупироцина и местного антисептика хлоргексидином на колонизацию S. aureus и инфекцию у новорожденных (ClinicalTrials.gov NCT02223520). В отличие от подхода, ориентированного на пациента (скрининг и лечение новорожденных, колонизированных S. aureus ), который имеет ограничения в неонатальной популяции,20,21 в исследовании TREAT PARENT тестируется подход, ориентированный на родителей, который может устранить или отсрочить воздействие на новорожденного S. aureus . Подобно лечению беременных женщин стрептококком группы B во время родов с целью предотвращения заболевания у новорожденных, это исследование привлечет родителей к профилактике S.aureus у новорожденных. Результаты предлагаемого исследования могут предоставить новый инструмент для профилактики ИСМП в отделении интенсивной терапии новорожденных.
aureus . Подобно лечению беременных женщин стрептококком группы B во время родов с целью предотвращения заболевания у новорожденных, это исследование привлечет родителей к профилактике S.aureus у новорожденных. Результаты предлагаемого исследования могут предоставить новый инструмент для профилактики ИСМП в отделении интенсивной терапии новорожденных.
Основная цель
Сравнить влияние лечения родителей коротким курсом интраназального введения мупироцина и местного купания с хлоргексидином или плацебо на колонизацию S. aureus у новорожденных.
Второстепенные цели
Чтобы сравнить родство S.aureus , колонизирующих родителей, и штаммов S. aureus , приобретенных их новорожденными в отделении интенсивной терапии новорожденных.
Сравнить влияние лечения родителей коротким курсом интраназального введения мупироцина и местным купанием с хлоргексидином или плацебо на инфекции S.
 aureus у новорожденных.
aureus у новорожденных.Для определения эффективности краткого курса интраназального введения мупироцина и местного купания с хлоргексидином для ликвидации колонизации S. aureus у родителей.
Методы и анализ
Дизайн исследования
Исследование TREAT PARENTS представляет собой плацебо-контролируемое рандомизированное двойное слепое клиническое исследование.
Исследуемая популяция и условия
Новорожденные, поступившие в отделение интенсивной терапии больницы Джона Хопкинса (JHH) и отделение интенсивной терапии медицинского центра Johns Hopkins Bayview, а также их родители или законные опекуны, будут проверены на соответствие требованиям. Определим родителей как биологических мать и отца. В случае, если один из родителей недоступен или не посещает ребенка в отделении интенсивной терапии новорожденных, мы попросим доступного родителя указать основного посетителя ребенка в отделении интенсивной терапии новорожденных в качестве второго участника исследования.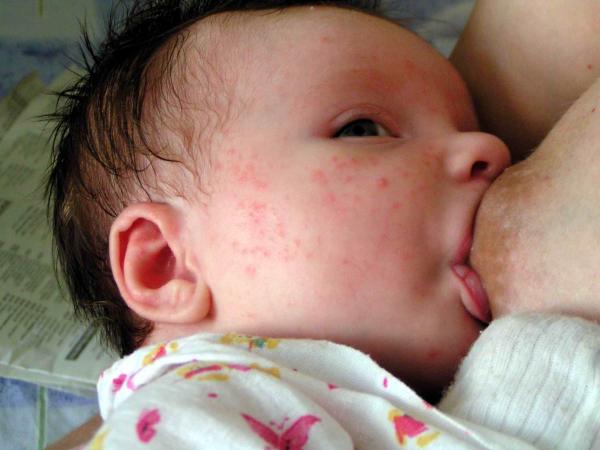 JHH NICU — это отделение интенсивной терапии новорожденных на 45 коек в центре четвертичного ухода, которое принимает около 700 новорожденных в год. Медицинский центр Johns Hopkins Bayview (Bayview) NICU представляет собой отделение интенсивной терапии III уровня на 25 коек, в которое ежегодно поступает около 375 госпитализаций.
JHH NICU — это отделение интенсивной терапии новорожденных на 45 коек в центре четвертичного ухода, которое принимает около 700 новорожденных в год. Медицинский центр Johns Hopkins Bayview (Bayview) NICU представляет собой отделение интенсивной терапии III уровня на 25 коек, в которое ежегодно поступает около 375 госпитализаций.
Критерии включения
Новорожденный никогда ранее не подвергался клиническому или контрольному посевному культивированию S. aureus
Новорожденный был переведен из другой больницы или госпитализирован из дома и у него был проведен скрининговый посев на S.aureus отрицательные колонизации
Родитель(и) может(ют) посещать ребенка у постели больного
Родитель(и) дал положительный результат на S. aureus при скрининге
9 У новорожденного предполагаемое пребывание в ОИТН более 5 днейРодители готовы быть рандомизированными информированное согласие.

Критерии исключения
аллергия на любой агент, используемый в любом режиме лечения
Neonate имеет предыдущую клиниковую или эпиднадзор культуру С. aureus
Neonate, допущенного к Нику из дома и старше 7 дней
Новорожденный поступил в отделение интенсивной терапии новорожденных из другой больницы и старше 7 дней
Новорожденный находится под опекой штата
Не может дать письменное информированное согласие.
Набор пациентов
Мы будем предварительно проверять новорожденных на соответствие требованиям. Член исследовательской группы подойдет ко всем правомочным родителям у постели больного и попросит об участии. После набора и получения информированного согласия родители пройдут предварительный рандомизационный скрининг, чтобы определить, являются ли родители колонизированными S. aureus . Посевы для родительского скрининга будут проводиться обученными членами исследовательской группы с использованием стандартизированной методологии путем получения мазка из носовых ходов, горла, паха и перианальной области. Эти образцы будут проанализированы в лаборатории микробиологии Джона Хопкинса в соответствии с рекомендациями Института клинических и лабораторных стандартов.
Эти образцы будут проанализированы в лаборатории микробиологии Джона Хопкинса в соответствии с рекомендациями Института клинических и лабораторных стандартов.
Рандомизация и сокрытие распределения
Если у одного из родителей будет положительный результат скрининга на S. aureus , то оба родителя как пара будут иметь право на рандомизацию в одну из двух возможных маскированных групп лечения (рис. 1). «Пара» новорожденный-родитель будет единицей рандомизации, и каждый родитель будет распределен в одну и ту же группу, если оба согласны.Поскольку пары могут повторно подвергать друг друга воздействию после лечения (особенно в домашних хозяйствах), лечение будут проходить оба родителя, даже если только один из родителей заражен S. aureus . Стратифицированная рандомизация с перестановкой блоков будет выполняться с использованием статистического программного обеспечения R для достижения сбалансированного распределения участников в пределах исследовательского центра и в пределах страт с массой тела при рождении (≥ или <1500 г). Использование блоков разного размера (4, 6 и 8) уменьшит риск дисбаланса. Новорожденные с многоплодной беременностью и их родители будут рандомизированы как единая семейная единица.Исследователи и участники будут скрыты от назначенного лечения. Фармацевт будет распределять лечение в предварительно запечатанной непрозрачной упаковке, чтобы сохранить сокрытие лечения. Кроме того, лечащие врачи новорожденных будут скрыты от назначения лечения. В случае неотложной медицинской помощи, когда знание слепого лечения участника имеет решающее значение для его лечения, слепое исследование может быть снято исследователем после консультации с Советом по мониторингу безопасности данных (DSMB).
Использование блоков разного размера (4, 6 и 8) уменьшит риск дисбаланса. Новорожденные с многоплодной беременностью и их родители будут рандомизированы как единая семейная единица.Исследователи и участники будут скрыты от назначенного лечения. Фармацевт будет распределять лечение в предварительно запечатанной непрозрачной упаковке, чтобы сохранить сокрытие лечения. Кроме того, лечащие врачи новорожденных будут скрыты от назначения лечения. В случае неотложной медицинской помощи, когда знание слепого лечения участника имеет решающее значение для его лечения, слепое исследование может быть снято исследователем после консультации с Советом по мониторингу безопасности данных (DSMB).
Обзор дизайна исследования (ОИТН, отделение интенсивной терапии новорожденных).
Вмешательство
Участники будут случайным образом распределены в одну из двух групп.
Лечение : Интраназальное введение мупироцина два раза в день в течение 5 дней плюс местная антисептика салфетками, пропитанными хлоргексидин глюконатом, ежедневно в течение 5 дней.

Плацебо : интраназальная мазь плацебо (вазелин) два раза в день в течение 5 дней и плацебо-салфетки (не пропитанные хлоргексидин глюконатом) для антисептики кожи ежедневно в течение 5 дней.
Временная шкала участников
Временные точки оценки родителей
Все участники начнут 5-дневный курс лечения при рандомизации. Члены исследовательской группы свяжутся с участниками исследования в течение периода лечения, чтобы способствовать их соблюдению. После завершения периода лечения остаточное лечение будет извлечено и возвращено в аптеку для измерения соблюдения. Нежелательные явления, о которых сообщали участники, будут зарегистрированы исследовательской группой. Родители будут повторно тестироваться на колонизацию с интервалом в 2 недели после рандомизации в течение первых 8 недель, а затем каждые 4 недели до выписки.Последний визит и тестирование будут проводиться во время выписки новорожденного из отделения интенсивной терапии новорожденных или в момент выявления у ребенка инфекции S. aureus . Данные будут получены в ходе интервью и из электронной медицинской карты и напрямую введены в REDCap (безопасное веб-приложение для создания и управления онлайн-базами данных). Чтобы способствовать удержанию участников, вознаграждение будет предоставляться, когда участники достигают заранее определенных этапов.
aureus . Данные будут получены в ходе интервью и из электронной медицинской карты и напрямую введены в REDCap (безопасное веб-приложение для создания и управления онлайн-базами данных). Чтобы способствовать удержанию участников, вознаграждение будет предоставляться, когда участники достигают заранее определенных этапов.
Моменты оценки состояния новорожденных
После рандомизации родителей новорожденный пройдет базовое тестирование для определения исходного уровня S.статус колонизации aureus . Это тестирование будет проведено в первый день исследования, в тот же день, когда родители начнут лечение. Скрининг культур будет выполняться путем получения мазка из носовых ходов, пупка, паха и перианальной области. Новорожденные с положительным результатом теста на колонизацию S. aureus во время рандомизации не будут включены в анализ первичного исхода. После базового тестирования повторное тестирование будет проводиться каждые 7 дней. Последний визит и тестирование будут проводиться во время выписки новорожденного из отделения интенсивной терапии. Результаты посевов, собранных в рамках рутинного ухода за пациентами (например, посев крови, посевы из дыхательных путей, посевы из ран, контрольные посевы), также будут доступны для выявления инфицирования S. aureus у новорожденных (таблица 1). Таблица 1 культуры наблюдения или культуры, собранные во время обычной клинической помощи.
Результаты посевов, собранных в рамках рутинного ухода за пациентами (например, посев крови, посевы из дыхательных путей, посевы из ран, контрольные посевы), также будут доступны для выявления инфицирования S. aureus у новорожденных (таблица 1). Таблица 1 культуры наблюдения или культуры, собранные во время обычной клинической помощи.
Приобретение будет определяться как соответствующее двум критериям:
Новорожденный, у которого исходный контрольный посев был отрицательным на S. aureus ;
Новорожденный, у которого последующая контрольная культура или культура, собранная во время обычной клинической помощи, содержит S. aureus .
Конкордантные штаммы должны соответствовать следующим критериям:
Штаммы, родственные с помощью анализа гель-электрофореза в импульсном поле.Изоляты будут считаться родственными, если их образцы имеют ≤3 различия в полосах. Изоляты с различиями >3 полос будут считаться эпидемиологически разными типами штаммов.
 Альтернативные методы типирования могут быть использованы для дальнейшего различения широко распространенных штаммов.
Альтернативные методы типирования могут быть использованы для дальнейшего различения широко распространенных штаммов.У новорожденного выявлен тот же штамм, что и при первоначальном скрининге родителей.
Вторичные конечные точки
Неонатальное приобретение S. aureus , как определено с помощью периодических контрольных посевов или посевов, собранных во время обычного клинического ухода, в которых растет S. .AUREUS
NEONATAL S. AUREUS Инфекция, определенная культурами, собранными во время рутинной клинической помощи
Искоренение S. aureus Colonization у родителей после лечения
Естественная история S. aureus колонизация у родителей, получающих плацебо
Побочные реакции на лечение
Осуществимость вмешательства в этой популяции в применении
Отношение и поведение у всех родителей, давших согласие.

План статистического анализа
Размер выборки и расчеты мощности
Предполагаемый уровень конкордантной колонизации группы плацебо составляет 10%, а расчеты мощности консервативно основаны на нескорректированной модели пропорциональных рисков Кокса, где первичная ковариата является показателем группы лечения. Учитывая, что мы ожидаем, что 10% пар родитель-новорожденный будут неодноплодными, мы оценили консервативную силу исследования, предполагая, что исходы от неодноплодных новорожденных полностью зависят.Исходя из вышеизложенных предположений, общий размер выборки из 400 новорожденных обеспечит 80% или 90% мощности для обнаружения снижения риска конкордантной колонизации примерно на 60% или 65% соответственно. Общий размер выборки из 400 новорожденных обеспечит мощность не менее 85% для выявления абсолютной разницы в скорости конкордантной колонизации при сравнении группы лечения (2%) и группы плацебо (10%). Некоторые новорожденные могут иметь положительный исходный тест на колонизацию S. aureus после рандомизации и не будут соответствовать требованиям для первичного анализа результатов, поэтому фактическое число новорожденных, скорее всего, превысит 400.
aureus после рандомизации и не будут соответствовать требованиям для первичного анализа результатов, поэтому фактическое число новорожденных, скорее всего, превысит 400.
Промежуточный анализ
Будет выполнено несколько промежуточных анализов. Мы проведем промежуточный анализ как эффективности, так и вреда после того, как 200 и 300 новорожденных, подходящих для анализа, получат согласие, будут зачислены, рандомизированы и будут наблюдаться в течение 8 недель. После набора 200 и 300 новорожденных, подходящих для анализа, мы остановим исследование на предмет эффективности, если статистика теста для первичного анализа (см. ниже) попадет в область отторжения O’Brien Fleming, определяемую |Z r |=2.96 или 2,36. Если в исследование по-прежнему включаются полные 400 новорожденных, подходящих для анализа, эффект лечения будет считаться статистически значимым, если статистика теста для первичного анализа попадает в область отторжения O’Brien Fleming, определяемую |Z r |=2,01. Правило остановки О’Брайена Флеминга для вреда будет применяться, если мы обнаружим больше конкордантных колоний в группе, получавшей лечение, по сравнению с плацебо, и испытание будет остановлено в соответствии со следующими областями отторжения после набора 200, 300 или 400 новорожденных, подходящих для анализа; Z r =2.45, 2,00 или 1,73 соответственно.
Правило остановки О’Брайена Флеминга для вреда будет применяться, если мы обнаружим больше конкордантных колоний в группе, получавшей лечение, по сравнению с плацебо, и испытание будет остановлено в соответствии со следующими областями отторжения после набора 200, 300 или 400 новорожденных, подходящих для анализа; Z r =2.45, 2,00 или 1,73 соответственно.
Кроме того, промежуточный анализ на бесполезность будет проведен после того, как 200 новорожденных, подходящих для анализа, получат согласие, будут зачислены, рандомизированы и будут наблюдаться в течение 8 недель. Предполагая, что колонизация новорожденных происходит равномерно в течение всего исследования, мы ожидаем, что при промежуточном анализе будет наблюдаться 10 конкордантных колонизаций в группе плацебо (коэффициент 10%). Мы остановим исследование, если верхняя граница достоверности 95% для согласованной скорости колонизации в группе плацебо при промежуточном анализе будет <10%.Следовательно, мы остановим испытание за бесполезностью, если наблюдаемое количество конкордантных колоний в группе плацебо будет ≤4.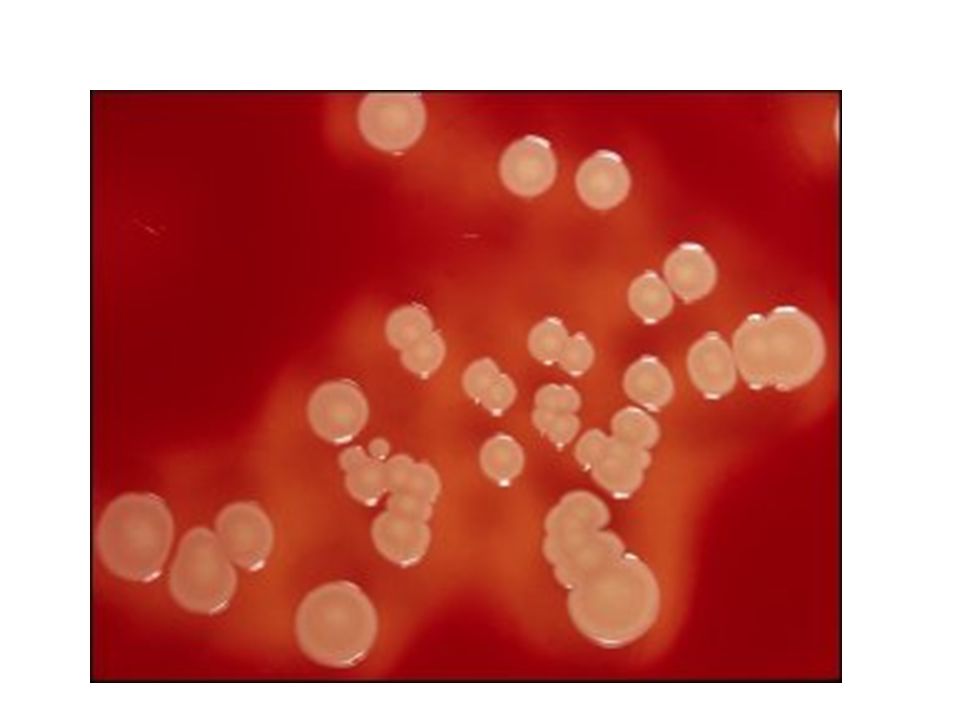
Статистический анализ
Исследовательский анализ будет сравнивать исходные характеристики групп лечения с использованием t-критерия Стьюдента для непрерывных переменных и критерия Пирсона χ 2 или точного критерия Фишера для категориальных переменных. Анализы всех целей будут следовать принципу намерения лечить. Для первичного анализа пара родитель-новорожденный будет единицей анализа, и методы анализа выживаемости будут использоваться для сравнения риска конкордантной колонизации при сравнении групп лечения и плацебо.22 Время будет подвергаться административной цензуре через 90 дней после рандомизации или когда новорожденный умирает или выписывается из отделения интенсивной терапии новорожденных (за исключением случаев, когда ребенка переводят из одного исследовательского отделения в другое). Чтобы повысить точность предполагаемого эффекта лечения, анализ будет корректировать несколько исходных переменных, собранных во время поступления в отделение интенсивной терапии интенсивной терапии, которые, как считается, коррелируют с исходом. Базовые ковариаты включают массу тела при рождении, показатель новорожденного, получающего грудное молоко, показатель того, родился ли новорожденный в участвующем отделении интенсивной терапии новорожденных (врожденный) или поступил в отделение интенсивной терапии новорожденных из дома или вне больницы (внебольничный).Мы будем использовать метод, разработанный Лу и Циатисом, реализованный в R-пакете speff2trial, для использования исходной ковариационной информации при оценке эффекта лечения.23 Все выбранные исходные ковариаты будут включены в анализ как основные эффекты. . Чтобы учесть кластерную рандомизацию среди пар родитель-новорожденный с многоплодной беременностью, SE для эффекта лечения будет оцениваться с помощью начальной загрузки, где диады передискретизируются для сохранения корреляционной структуры.Если будут отсутствовать данные, предполагается, что данные отсутствуют случайно, и главный исследователь сообщит, наряду с исследовательским анализом, соответствующие ковариаты, которые коррелируют с отсутствующими данными.
Базовые ковариаты включают массу тела при рождении, показатель новорожденного, получающего грудное молоко, показатель того, родился ли новорожденный в участвующем отделении интенсивной терапии новорожденных (врожденный) или поступил в отделение интенсивной терапии новорожденных из дома или вне больницы (внебольничный).Мы будем использовать метод, разработанный Лу и Циатисом, реализованный в R-пакете speff2trial, для использования исходной ковариационной информации при оценке эффекта лечения.23 Все выбранные исходные ковариаты будут включены в анализ как основные эффекты. . Чтобы учесть кластерную рандомизацию среди пар родитель-новорожденный с многоплодной беременностью, SE для эффекта лечения будет оцениваться с помощью начальной загрузки, где диады передискретизируются для сохранения корреляционной структуры.Если будут отсутствовать данные, предполагается, что данные отсутствуют случайно, и главный исследователь сообщит, наряду с исследовательским анализом, соответствующие ковариаты, которые коррелируют с отсутствующими данными.
Запланированные вторичные анализы будут включать следующее:
Повторите первичный анализ, где время до согласованной колонизации не будет подвергаться цензуре через 90 дней после рандомизации; время будет определяться как время от рандомизации до выписки из отделения интенсивной терапии или смерти.
Определить эффект лечения как разницу в доле новорождённых, приобретших конкордантный S.aureus к 4 и 8 неделям пребывания в отделении интенсивной терапии, сравнивая экспериментальную и контрольную группы. Анализ будет скорректирован с учетом тех же исходных ковариатов, что и для первичного анализа, и будет основан на новых методах, предложенных Rotnitzky et al. и более подробно описанных Colantuoni и Rosenblum, которые повышают точность расчетных эффектов лечения, включая прогностические исходные ковариаты. 24 ,25
Определить результат как приобретение S.aureus (независимо от согласованного статуса), используя как время до сбора данных, так и двоичный индикатор для любого сбора данных.

Повторение первичного анализа в группах новорожденных с метициллин-резистентным Staphylococcus aureus (MRSA) и с метициллин-чувствительным Staphylococcus aureus (MSSA).
Повторение первичного анализа в пределах слоев новорожденных, определяемых по тому, был ли родитель повторно заселен S.aureus во время исследования.
Повторить первичный анализ, стратифицированный по местам родительской колонизации.
Провести анализ чувствительности первичного анализа с учетом гестационного возраста, а также стратифицировать по большому или малому размеру по гестационному возрасту.
Мониторинг
Для наблюдения за исследованием будет создан независимый междисциплинарный DSMB. DSMB рассмотрит промежуточные анализы после набора 200 и 300 новорожденных, подходящих для анализа.Будут проведены промежуточные анализы эффективности и бесполезности. DSMB также будет периодически анализировать данные о безопасности и давать рекомендации о продолжении, чередовании или прекращении исследования. Институт клинических и трансляционных исследований Университета Джона Хопкинса будет периодически проверять проведение испытаний.
Институт клинических и трансляционных исследований Университета Джона Хопкинса будет периодически проверять проведение испытаний.
Этика и распространение
Исследовательская группа получит письменное информированное согласие всех участников. Согласившимся участникам будет присвоен номер проверки и идентификационный номер исследования, которые будут основным способом идентификации на протяжении всего исследования.Весь исследовательский персонал будет проинструктирован относительно безопасности данных и соблюдения самых высоких этических стандартов в соблюдении протокола и сборе данных. В ходе исследования собранная информация не будет разглашаться никому, кроме персонала исследования. По завершении испытания только исследовательский персонал будет иметь полный доступ к окончательному набору данных испытания. Часть информированного согласия будет включать понимание того, что родители будут проинформированы об их статусе колонизации S. aureus .Если один или оба родителя колонизированы, родители будут проинформированы о том, что один или оба родителя колонизированы, но им не будет сообщено, какой из родителей колонизирован, для защиты конфиденциальности. Кроме того, участники получат согласие на хранение биообразцов для будущих исследований. Протокол исследования и формы согласия были одобрены IRB в июне 2014 года. Авторы обязуются сообщать данные в соответствии с рекомендациями CONSORT, а результаты будут опубликованы в рецензируемых журналах в течение 12 месяцев после завершения исследования и распространены на научных и профессиональных конференциях.Доступ к результатам испытаний будет предоставлен участникам путем размещения результатов на веб-сайте исследования. Окончательный отчет об испытании будет содержать полный протокол, поправки к протоколу, форму согласия, окончательный план статистического анализа и лабораторные методы.
Кроме того, участники получат согласие на хранение биообразцов для будущих исследований. Протокол исследования и формы согласия были одобрены IRB в июне 2014 года. Авторы обязуются сообщать данные в соответствии с рекомендациями CONSORT, а результаты будут опубликованы в рецензируемых журналах в течение 12 месяцев после завершения исследования и распространены на научных и профессиональных конференциях.Доступ к результатам испытаний будет предоставлен участникам путем размещения результатов на веб-сайте исследования. Окончательный отчет об испытании будет содержать полный протокол, поправки к протоколу, форму согласия, окончательный план статистического анализа и лабораторные методы.
Изменения протокола
Все изменения протокола будут представлены на утверждение в IRB и DSMB.
Обсуждение
В исследовании TREAT PARENTS будет проверено, снизит ли обнаружение и лечение родителей, колонизированных S. aureus , с помощью интраназального мупироцина и местного купания с хлоргексидином, риск заражения их младенцев S.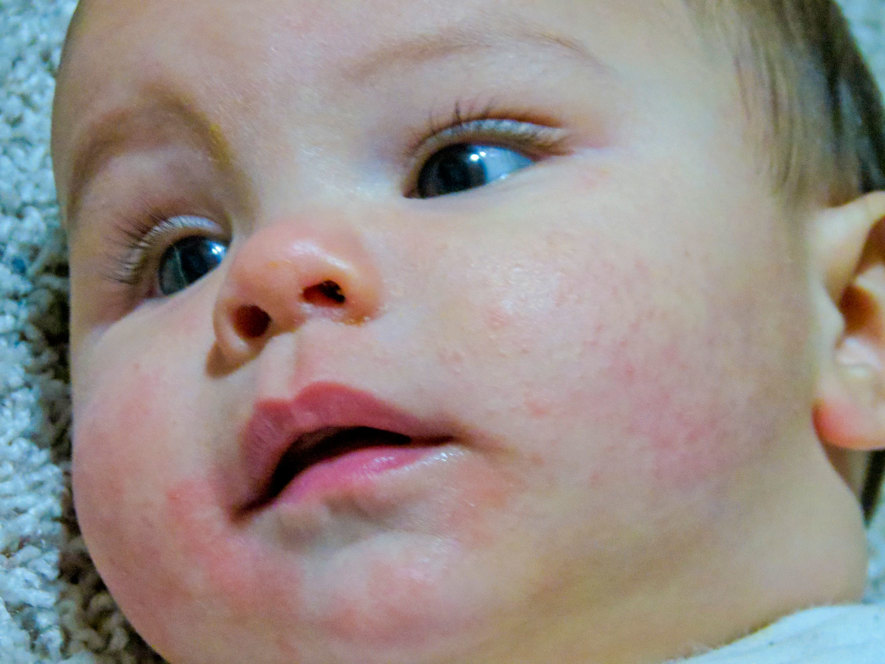 aureus в отделении интенсивной терапии и, следовательно, снижения инфекций. В этом исследовании рассматривается переход от подхода, ориентированного на пациента, к подходу, ориентированному на родителей, с целью устранения или отсрочки воздействия на новорожденного S. aureus . Необходимы новые стратегии для предотвращения ИСМП и сокращения расходов на здравоохранение, которые обходятся в миллиарды долларов, а также снижения долгосрочной неврологической инвалидности у детей, переживших неонатальные инфекции. Результаты этого исследования могут изменить профилактику ИСМП в отделениях интенсивной терапии с акцентом на медработников и окружающую среду на политику, которая признает и выделяет родителей и посетителей как важные источники воздействия патогенов, способствующих возникновению ИСМП.
aureus в отделении интенсивной терапии и, следовательно, снижения инфекций. В этом исследовании рассматривается переход от подхода, ориентированного на пациента, к подходу, ориентированному на родителей, с целью устранения или отсрочки воздействия на новорожденного S. aureus . Необходимы новые стратегии для предотвращения ИСМП и сокращения расходов на здравоохранение, которые обходятся в миллиарды долларов, а также снижения долгосрочной неврологической инвалидности у детей, переживших неонатальные инфекции. Результаты этого исследования могут изменить профилактику ИСМП в отделениях интенсивной терапии с акцентом на медработников и окружающую среду на политику, которая признает и выделяет родителей и посетителей как важные источники воздействия патогенов, способствующих возникновению ИСМП.
Защита новорожденных от стафилококковых инфекций
Недоношенные дети особенно восприимчивы к позднему сепсису, который часто возникает из-за грамположительных бактериальных инфекций, что приводит к значительной заболеваемости и смертности. Здесь мы опишем врожденный иммунитет новорожденных к Staphylococcus spp. сравнение различий между недоношенными и доношенными новорожденными со взрослыми. Врожденный иммунитет новорожденных отчетливо демонстрирует снижение целостности кожи, нарушение поляризационных реакций Th2, низкий уровень комплемента и снижение экспрессии антимикробных белков и пептидов плазмы, особенно у недоношенных новорожденных.Характеристика различных аспектов неонатального иммунного ответа определяет новые подходы к усилению защиты хозяина для предотвращения и/или лечения стафилококковой инфекции в этой уязвимой популяции.
Здесь мы опишем врожденный иммунитет новорожденных к Staphylococcus spp. сравнение различий между недоношенными и доношенными новорожденными со взрослыми. Врожденный иммунитет новорожденных отчетливо демонстрирует снижение целостности кожи, нарушение поляризационных реакций Th2, низкий уровень комплемента и снижение экспрессии антимикробных белков и пептидов плазмы, особенно у недоношенных новорожденных.Характеристика различных аспектов неонатального иммунного ответа определяет новые подходы к усилению защиты хозяина для предотвращения и/или лечения стафилококковой инфекции в этой уязвимой популяции.
1. Введение
Более 30% смертей детей в возрасте до 5 лет происходит в течение первых 4 недель жизни [1]. В этом контексте понимание иммунологических механизмов, лежащих в основе неонатальной восприимчивости, имеет важное значение для разработки новых подходов к профилактике и/или лечению бактериальной инфекции.Новорожденные в отделениях интенсивной терапии новорожденных (ОИТН) подвержены риску заражения. Улучшение практики мытья рук, питания, ухода за кожей и респираторными заболеваниями снижает Staphylococcus spp. инфекции [2, 3]. Такие улучшения качества в отделениях интенсивной терапии также значительно снижают затраты на одного пациента [4]. Антибиотики являются основным средством лечения стафилококковых инфекций, но использование этих средств также связано с резистентностью и изменением микробной флоры хозяина. Здесь мы рассматриваем врожденную защиту хозяина от Staphylococcus spp.с акцентом на S. epidermidis (SE) и S. aureus (SA). Соответственно, мы провели поиск в PubMed, компьютерной поисковой системе литературы, используя следующие термины: «новорожденный» ИЛИ «новорожденный» ИЛИ «неонатальный» И «стафилококк» И/ИЛИ «сепсис» ИЛИ «врожденный» ИЛИ «цитокин» ИЛИ « Toll-подобный рецептор» ИЛИ «рецептор распознавания образов» ИЛИ «антимикробный пептид» ИЛИ «нейтрофил» ИЛИ «моноцит». Затем мы организовали полученные ссылки, сгруппировав их по детекторной функции, эффекторной функции и трансляционным усилиям.
Улучшение практики мытья рук, питания, ухода за кожей и респираторными заболеваниями снижает Staphylococcus spp. инфекции [2, 3]. Такие улучшения качества в отделениях интенсивной терапии также значительно снижают затраты на одного пациента [4]. Антибиотики являются основным средством лечения стафилококковых инфекций, но использование этих средств также связано с резистентностью и изменением микробной флоры хозяина. Здесь мы рассматриваем врожденную защиту хозяина от Staphylococcus spp.с акцентом на S. epidermidis (SE) и S. aureus (SA). Соответственно, мы провели поиск в PubMed, компьютерной поисковой системе литературы, используя следующие термины: «новорожденный» ИЛИ «новорожденный» ИЛИ «неонатальный» И «стафилококк» И/ИЛИ «сепсис» ИЛИ «врожденный» ИЛИ «цитокин» ИЛИ « Toll-подобный рецептор» ИЛИ «рецептор распознавания образов» ИЛИ «антимикробный пептид» ИЛИ «нейтрофил» ИЛИ «моноцит». Затем мы организовали полученные ссылки, сгруппировав их по детекторной функции, эффекторной функции и трансляционным усилиям.
2. Неонатальные стафилококковые инфекции
SE колонизирует новорожденных [5] и остается частью нормальной флоры человека [6, 7]. СЭ-индуцированный сепсис у недоношенных новорожденных был связан с повышенным риском неблагоприятных общих исходов, длительным пребыванием в больнице и увеличением затрат [8-17]. SE является наиболее часто выделяемым штаммом коагулазонегативных стафилококков (CoNS) и диагностически идентифицируется от SA из-за его неспособности продуцировать коагулазу [18, 19]. SE образует биопленку на катетерах и обычно поражает пациентов с ослабленным иммунитетом [6, 20–22].
Инвазивные инфекции, вызванные внеклеточными патогенами, такими как CoNS, в основном встречаются у недоношенных детей. В Университетской больнице Патры в Греции в период с 2006 по 2007 год 8,5% всех госпитализаций в ОИТН имели поздний сепсис КоНС. SE был наиболее распространенным обнаруженным организмом, а образование биопленки было определено как детерминанта персистирующей инфекции [23]. Большинство сепсисов с поздним началом (определяемых как 1 или более положительных результатов посева крови после 72 часов жизни) у новорожденных с очень низкой массой тела при рождении (ОНМТ) были вызваны грамположительными микроорганизмами [19, 24–26].CoNS были ответственны за 48% инфекций в исследовании, в котором изучалось более 6000 новорожденных в отделениях интенсивной терапии в США [24]. Выявленные факторы риска включали низкий гестационный возраст, низкий вес при рождении, увеличенную продолжительность искусственной вентиляции легких, центральный сосудистый катетер и длительное парентеральное питание [24]. Почти у половины новорожденных со сроком гестации менее 25 недель развился сепсис с поздним началом и они дольше находились в стационаре [24]. Хотя инфекции CoNS часто быстро проходят после нескольких дней внутривенного введения антибиотиков, они несут ответственность за значительные расходы на здравоохранение, а также вызывают воспалительные реакции, которые иногда могут привести к долгосрочному вреду для новорожденного, включая потенциальное повреждение головного мозга [8–13, 27].
Большинство сепсисов с поздним началом (определяемых как 1 или более положительных результатов посева крови после 72 часов жизни) у новорожденных с очень низкой массой тела при рождении (ОНМТ) были вызваны грамположительными микроорганизмами [19, 24–26].CoNS были ответственны за 48% инфекций в исследовании, в котором изучалось более 6000 новорожденных в отделениях интенсивной терапии в США [24]. Выявленные факторы риска включали низкий гестационный возраст, низкий вес при рождении, увеличенную продолжительность искусственной вентиляции легких, центральный сосудистый катетер и длительное парентеральное питание [24]. Почти у половины новорожденных со сроком гестации менее 25 недель развился сепсис с поздним началом и они дольше находились в стационаре [24]. Хотя инфекции CoNS часто быстро проходят после нескольких дней внутривенного введения антибиотиков, они несут ответственность за значительные расходы на здравоохранение, а также вызывают воспалительные реакции, которые иногда могут привести к долгосрочному вреду для новорожденного, включая потенциальное повреждение головного мозга [8–13, 27]. .
.
SA является второй ведущей причиной позднего сепсиса у новорожденных [24]. СА приводит к более длительной бактериемии, диссеминации в дополнительные анатомические участки (например, остеомиелит) и значительно большему числу смертей, связанных с сепсисом, чем инфекции CoNS [28, 29]. Ассоциированный с СА неонатальный сепсис связан с повышенной антибиотикорезистентностью [28, 30, 31]. Новорожденные часто заражаются SA от своих матерей путем горизонтального, а не вертикального переноса [32]. Соответственно, исследование, в котором приняли участие более 400 матерей, поступивших в связи с преждевременными родами, и новорожденных, впоследствии поступивших в отделение интенсивной терапии в США, показало, что вертикальная передача метициллин-резистентного SA (MRSA) во время родов маловероятна [33].Эти данные свидетельствуют о горизонтальной передаче MRSA от медицинских работников или от родителей при уходе за детьми [33]. Действительно, штаммы MRSA, распространяющиеся по месту жительства, были идентифицированы при некоторых инфекциях в отделениях интенсивной терапии в США [28].
3. Врожденная иммунная система у новорожденных
Учитывая «врожденный» характер врожденного иммунного ответа, оказалось удивительным, что врожденный иммунный ответ действительно развивается с возрастом [34]. Как было недавно рассмотрено, врожденный иммунный ответ у новорожденных отличается от такового у пожилых людей [35, 36].Множественные клетки опосредуют врожденный иммунный ответ, включая эпителий кожи и слизистых оболочек, нейтрофилы, моноциты/макрофаги и дендритные клетки [35, 36]. Врожденная иммунная система также влияет на адаптивный иммунный ответ, поэтому понимание врожденного иммунитета новорожденных также может помочь в разработке возрастных вакцин.
3.1. Растворимые факторы, модулирующие иммунный ответ новорожденных
Плазма новорожденных содержит множество факторов, модулирующих иммунный ответ [37]. Плазма пуповинной крови новорожденных содержит значительно больше аденозина, эндогенного метаболита пурина, который ингибирует опосредованные Toll-подобным рецептором (TLR) ответы Th2, чем плазма взрослых [38]. Неонатальная аденозиновая система ингибирует TLR2-индуцированную продукцию фактора некроза опухоли (TNF), но не интерлейкина (IL)-6 [38]. Сыворотка новорожденных людей в первую неделю жизни демонстрирует более высокое базальное соотношение ИЛ-6/ФНО, чем у взрослых [39]. Более того, по сравнению с моноцитами взрослых, моноциты пуповинной крови новорожденных продуцируют высокое соотношение IL-6 и TNF в ответ на стимуляцию TLR [39]. ИЛ-6 может нарушать выработку, миграцию и функцию нейтрофилов при сепсисе [39–42], что может способствовать восприимчивости новорожденных к бактериальной инфекции.
Неонатальная аденозиновая система ингибирует TLR2-индуцированную продукцию фактора некроза опухоли (TNF), но не интерлейкина (IL)-6 [38]. Сыворотка новорожденных людей в первую неделю жизни демонстрирует более высокое базальное соотношение ИЛ-6/ФНО, чем у взрослых [39]. Более того, по сравнению с моноцитами взрослых, моноциты пуповинной крови новорожденных продуцируют высокое соотношение IL-6 и TNF в ответ на стимуляцию TLR [39]. ИЛ-6 может нарушать выработку, миграцию и функцию нейтрофилов при сепсисе [39–42], что может способствовать восприимчивости новорожденных к бактериальной инфекции.
3.2. Антимикробные белки и пептиды
Ключевым механизмом, с помощью которого врожденная иммунная система убивает микробы и нейтрализует микробные токсины, является экспрессия и мобилизация антимикробных белков и пептидов (АРР) [43–45]. APP обычно представляют собой катионные молекулы, оказывающие мембраноактивное действие на бактерии. Некоторые АРР выполняют дополнительные функции, такие как лактоферрин, который связывает железо, ключевое питательное вещество для многих бактерий [46], и лизоцим, обладающий ферментативной активностью за счет мурамидазы, повреждающей стенки бактериальных клеток [47]. Дефенсины представляют собой небольшие катионные антимикробные пептиды, продуцируемые лейкоцитами и эпителиальными клетками человека [48, 49]. Следует отметить, что недоношенные новорожденные демонстрируют недостаточную экспрессию АРР в плазме, что может способствовать способности бактерий быстро размножаться в кровотоке недоношенных. Кроме того, нейтрофилы новорожденных демонстрируют нарушение продукции нейтрофильных внеклеточных ловушек (NET) на основе нуклеиновых кислот, которые служат каркасом для APP и важны для защиты хозяина [50]. В целом, сниженные уровни комплемента и АРР в плазме, а также нарушение развертывания АРР в NET могут частично объяснить, почему новорожденные более восприимчивы к инфекции [51, 52].
Дефенсины представляют собой небольшие катионные антимикробные пептиды, продуцируемые лейкоцитами и эпителиальными клетками человека [48, 49]. Следует отметить, что недоношенные новорожденные демонстрируют недостаточную экспрессию АРР в плазме, что может способствовать способности бактерий быстро размножаться в кровотоке недоношенных. Кроме того, нейтрофилы новорожденных демонстрируют нарушение продукции нейтрофильных внеклеточных ловушек (NET) на основе нуклеиновых кислот, которые служат каркасом для APP и важны для защиты хозяина [50]. В целом, сниженные уровни комплемента и АРР в плазме, а также нарушение развертывания АРР в NET могут частично объяснить, почему новорожденные более восприимчивы к инфекции [51, 52].
3.3. Количественные различия фагоцитов
Недоношенные новорожденные, поступившие в отделение интенсивной терапии новорожденных, имеют относительно высокую частоту нейтропении, которая может достигать 8% [53]. У доношенных новорожденных описано нарушение функции фагоцитов при рождении [54]. Новорожденные нейтрофилы демонстрируют нарушение хемотаксиса, фагоцитоза и нарушение респираторного взрыва [54–57], а также нарушение способности образовывать внеклеточные ловушки, важные для захвата и уничтожения внеклеточных бактерий [50].
Новорожденные нейтрофилы демонстрируют нарушение хемотаксиса, фагоцитоза и нарушение респираторного взрыва [54–57], а также нарушение способности образовывать внеклеточные ловушки, важные для захвата и уничтожения внеклеточных бактерий [50].
3.4. Качественные различия в лейкоцитах
Неонатальный иммунный ответ смещен в сторону продукции Th3 и противовоспалительных цитокинов. Это может быть важно для защиты плода внутриутробно и во избежание чрезмерного воспаления при колонизации нормальной флорой в первые дни жизни. Недоношенные новорожденные демонстрируют в основном противовоспалительный ответ, характеризующийся высокой продукцией ИЛ-10, в то время как продукция других цитокинов относительно низкая [58].
Ингибирующие иммунные рецепторы противодействуют активирующим клетки сигналам.Некоторые из этих ингибиторных иммунных рецепторов функционируют через иммунорецепторные ингибиторные мотивы на основе тирозина (ITIM). Иммунные клетки новорожденных экспрессируют иной набор ингибирующих рецепторов по сравнению со взрослыми иммунными клетками. Пуповинная кровь и нейтрофилы новорожденных в возрасте 1 месяца экспрессируют более высокие уровни ингибирующих рецепторов, ассоциированного с лейкоцитами иммуноглобулина (Ig-) подобного рецептора-1 (LAIR-1) и сиглека-9, чем у взрослых [59]. Однако моноциты пуповинной крови демонстрировали сниженную экспрессию иммунного рецептора, экспрессируемого на миелоидных клетках (IREM)-1, а моноциты новорожденных в возрасте 1 месяца экспрессировали более низкие уровни LAIR-1 по сравнению со взрослыми [59].Эти наблюдения предполагают, что неонатальные нейтрофилы и моноциты находятся на другой базовой контрольной точке по сравнению со взрослыми лейкоцитами.
Пуповинная кровь и нейтрофилы новорожденных в возрасте 1 месяца экспрессируют более высокие уровни ингибирующих рецепторов, ассоциированного с лейкоцитами иммуноглобулина (Ig-) подобного рецептора-1 (LAIR-1) и сиглека-9, чем у взрослых [59]. Однако моноциты пуповинной крови демонстрировали сниженную экспрессию иммунного рецептора, экспрессируемого на миелоидных клетках (IREM)-1, а моноциты новорожденных в возрасте 1 месяца экспрессировали более низкие уровни LAIR-1 по сравнению со взрослыми [59].Эти наблюдения предполагают, что неонатальные нейтрофилы и моноциты находятся на другой базовой контрольной точке по сравнению со взрослыми лейкоцитами.
4. Toll-подобные рецепторы (TLR)
TLR представляют собой рецепторы распознавания образов (PRR) врожденной иммунной системы, необходимые для раннего распознавания патогена, а также направляющие адаптивный иммунный ответ. У человека было идентифицировано 10 TLR, которые передают сигналы через адапторные молекулы, такие как миелоидный фактор дифференцировки-88 (MyD88), для активации транскрипции иммунных медиаторов, таких как цитокины, которые направляют ответ на инфекцию [60, 61]. Хотя базальная экспрессия TLR одинакова в моноцитах доношенного новорожденного и взрослого человека [62–64], она может меняться с гестационным возрастом. Новорожденные с экстремально низкой массой тела при рождении (ЭНМТ) на сроке менее 28 недель продемонстрировали более низкую экспрессию рецепторов врожденного иммунитета TLR2, TLR4, CD14 и MD-2 на нейтрофилах [65]. мРНК моноцитов TLR4 и экспрессия белка увеличиваются с гестационным возрастом [66]. Напротив, экспрессия TLR2 конститутивно экспрессируется на моноцитах в течение гестационного возраста и, следовательно, находится на одинаковых уровнях в моноцитах недоношенных, доношенных новорожденных и моноцитах взрослых [64].Интересно, что грамположительная бактериемия, по-видимому, вызывает увеличение экспрессии моноцитов и гранулоцитов TLR2 неонатальной периферической крови у инфицированных новорожденных [67, 68].
Хотя базальная экспрессия TLR одинакова в моноцитах доношенного новорожденного и взрослого человека [62–64], она может меняться с гестационным возрастом. Новорожденные с экстремально низкой массой тела при рождении (ЭНМТ) на сроке менее 28 недель продемонстрировали более низкую экспрессию рецепторов врожденного иммунитета TLR2, TLR4, CD14 и MD-2 на нейтрофилах [65]. мРНК моноцитов TLR4 и экспрессия белка увеличиваются с гестационным возрастом [66]. Напротив, экспрессия TLR2 конститутивно экспрессируется на моноцитах в течение гестационного возраста и, следовательно, находится на одинаковых уровнях в моноцитах недоношенных, доношенных новорожденных и моноцитах взрослых [64].Интересно, что грамположительная бактериемия, по-видимому, вызывает увеличение экспрессии моноцитов и гранулоцитов TLR2 неонатальной периферической крови у инфицированных новорожденных [67, 68].
Экспрессия белка MyD88, цитозольной адапторной молекулы, необходимой для передачи сигналов TLR, была снижена в нейтрофилах пуповинной крови новорожденных [69] и моноцитах [70] по сравнению с таковыми у взрослых. Уровни мРНК MyD88 увеличиваются в мононуклеарных клетках пуповинной крови недоношенных детей в течение гестационного возраста. Недоношенные дети демонстрируют более низкие уровни мРНК MyD88, но доношенные дети сопоставимы со взрослыми [64]; см. рис. 1.Таким образом, может быть врожденный дефект способности новорожденных вырабатывать цитокины в ответ на инфекцию из-за дефицита этой важной сигнальной молекулы.
Уровни мРНК MyD88 увеличиваются в мононуклеарных клетках пуповинной крови недоношенных детей в течение гестационного возраста. Недоношенные дети демонстрируют более низкие уровни мРНК MyD88, но доношенные дети сопоставимы со взрослыми [64]; см. рис. 1.Таким образом, может быть врожденный дефект способности новорожденных вырабатывать цитокины в ответ на инфекцию из-за дефицита этой важной сигнальной молекулы.
Продольное исследование, в котором изучались TLR-ответы людей в возрасте от рождения до 2 лет, показало, что не существует линейной прогрессии от «незрелого» к «зрелому» врожденному иммунному ответу от новорожденных к взрослым [71]. Процентное содержание моноцитов в крови было выше у взрослых и новорожденных, чем у детей 1 и 2 лет [71].2-летние дети продемонстрировали более высокий PAM 3 CSK 4 -(агонист TLR2/1-) индуцированный уровень внутриклеточных цитокинов, чем взрослые [71]. Процент 1- и 2-летних классических (с)ДК, продуцирующих цитокин, выше, чем у взрослых кДК [71]. Цитокины, секретируемые моноцитами, увеличивались от рождения до 2 лет для TNF и IL-1 β ; однако секреция ИЛ-6, ИЛ-23 и ИЛ-10 снижалась [71]. Мононуклеарные клетки пуповинной крови недоношенных детей имеют значительный дефект продукции IL-12/IL-23p40 по сравнению с доношенными детьми после стимуляции агонистом TLR2/1 PAM 3 CSK 4 , агонистом TLR2/6 Фибробластостимулирующий липопептид (FSL) ) и агонист TLR4 LPS [58].
Цитокины, секретируемые моноцитами, увеличивались от рождения до 2 лет для TNF и IL-1 β ; однако секреция ИЛ-6, ИЛ-23 и ИЛ-10 снижалась [71]. Мононуклеарные клетки пуповинной крови недоношенных детей имеют значительный дефект продукции IL-12/IL-23p40 по сравнению с доношенными детьми после стимуляции агонистом TLR2/1 PAM 3 CSK 4 , агонистом TLR2/6 Фибробластостимулирующий липопептид (FSL) ) и агонист TLR4 LPS [58].
Микро-(ми-)РНК, участвующие в ингибировании сигнального пути TLR4, увеличены в моноцитах новорожденных по сравнению со взрослыми и могут способствовать снижению продукции цитокинов [72]. Необходимы дальнейшие исследования роли miRNAs в передаче сигналов TLR2, чтобы лучше понять потенциальную роль miRNA в неонатальном врожденном иммунном ответе. Дальнейшие исследования других рецепторов распознавания образов, таких как NOD-подобные рецепторы, и регуляция этих рецепторов у новорожденных необходимы для дальнейшего понимания неонатального стафилококкового сепсиса.
5. Стафилококковые инфекции и неонатальный иммунный ответ хозяина
TLR2 опосредует врожденный иммунный ответ на SE и необходим для устранения SE у мышей [73]. TLR2 также опосредует врожденный иммунный ответ на инфекцию SA [74, 75]. Предварительная обработка клеток микроглии агонистом TLR2 уменьшала воспалительную реакцию на S. aureus , но усиливала микроглиальный фагоцитоз этой бактерии. Таким образом, TLR-модуляция может быть полезной стратегией лечения для минимизации воспаления в глазу [76].
При интерпретации литературных данных о реакциях in vitro на стафилококки важно отметить, что иммунный ответ варьируется в зависимости от того, убиты ли бактерии нагреванием, этанолом или живые [77]. Живой SE индуцировал значительно более высокие уровни цитокинов по сравнению с убитым SE, включая сильную активацию инфламмасомы для продукции IL-1 β , индукцию продукции интерферона типа I, ядерного фактора (NF) κ B, а также преобразователей и активаторов сигналов. активации транскрипции (STAT)1.Напротив, убитый SE активировал NF κ B, но не активировал другие пути врожденного иммунитета [77].
активации транскрипции (STAT)1.Напротив, убитый SE активировал NF κ B, но не активировал другие пути врожденного иммунитета [77].
В новой модели внутрияремной инфекции у мышей в возрасте до 24 часов жизни у новорожденных мышей наблюдается нарушение набора веса при внутривенном введении SE по сравнению с контрольной группой, которой вводили физиологический раствор [78]. Подобно картине, отмеченной в мононуклеарных клетках периферической крови недоношенных новорожденных людей во время грамположительной бактериемии [67, 68], уровни мРНК TLR2 и MyD88 в печени были значительно повышены при введении SE, который индуцировал зависимый от инокулята сывороточный IL-6. концентрации ФНО [78].
СЭ-индуцированная продукция цитокинов неонатальными мононуклеарными клетками человека (МК) in vitro зависит от гестационного возраста [79–82]. Моноциты недоношенных новорожденных демонстрируют снижение продукции IL-1 β , IL-6, IL-8 и TNF в ответ на SE, несмотря на экспрессию TLR2 на уровне взрослых [83]. Нарушение продукции TNF может способствовать нарушению реакции нейтрофилов на Staphylococcus spp. поскольку TNF активирует нейтрофилы. SE-индуцированное фосфорилирование клеточных сигнальных молекул (например,g., фосфо-р65, фосфо-р38 и фосфо-JNK) была одинаковой у новорожденных и взрослых [83]. Напротив, лечение моноцитов недоношенных новорожденных продемонстрировало снижение индуцированного SA липотейхоевой кислотой (LTA-)/TLR-опосредованного фосфорилирования p38 и ERK в цельной крови [64]. Индуцированная LTA продукция IL-1 β , IL-6 и IL-8 увеличивалась с гестационным возрастом [64].
Нарушение продукции TNF может способствовать нарушению реакции нейтрофилов на Staphylococcus spp. поскольку TNF активирует нейтрофилы. SE-индуцированное фосфорилирование клеточных сигнальных молекул (например,g., фосфо-р65, фосфо-р38 и фосфо-JNK) была одинаковой у новорожденных и взрослых [83]. Напротив, лечение моноцитов недоношенных новорожденных продемонстрировало снижение индуцированного SA липотейхоевой кислотой (LTA-)/TLR-опосредованного фосфорилирования p38 и ERK в цельной крови [64]. Индуцированная LTA продукция IL-1 β , IL-6 и IL-8 увеличивалась с гестационным возрастом [64].
Стафилококки spp. уклоняются от клиренса иммунной системой частично за счет образования аденозина, эндогенного метаболита пурина, который действует через родственные семитрансмембранные рецепторы, индуцируя иммуномодулирующий внутриклеточный циклический аденозинмонофосфат (цАМФ; рис. 1) и, следовательно, модулируя иммунный ответ [84].Одним из эффектов аденозина является повышение продукции IL-6, который может ингибировать миграцию нейтрофилов [41, 42, 85–88], а также ингибирование продукции TNF, важного для активации нейтрофилов [38, 89–91]. Неонатальные мононуклеарные клетки особенно чувствительны к действию аденозина [38]. Соответственно, этот аденозингенерирующий эффект Staphylococci spp. может быть особенно эффективен для обезвреживания врожденной защиты новорожденных.
Неонатальные мононуклеарные клетки особенно чувствительны к действию аденозина [38]. Соответственно, этот аденозингенерирующий эффект Staphylococci spp. может быть особенно эффективен для обезвреживания врожденной защиты новорожденных.
Опсонофагоцитарные механизмы . Моноциты новорожденных и взрослых людей демонстрируют сходную фагоцитарную способность и внутриклеточное уничтожение SE [83].Однако нейтрофилы недоношенных новорожденных демонстрируют ослабленный SE-индуцированный окислительный взрыв нейтрофилов по сравнению с доношенными новорожденными [57]. Плазма недоношенных новорожденных, особенно новорожденных с экстремально низкой массой тела при рождении (ЭНМТ), имела более низкую опсонофагоцитарную способность, чем у доношенных новорожденных и взрослых при СА [65].
Влияние этих различий на врожденные иммунные реакции в зависимости от возраста на СЭ и СА заключается в том, что более низкий гестационный возраст оказывает существенное влияние на восприимчивость индивидуума к инфекции (табл. 1).Поскольку у новорожденных нарушена индуцированная сепсисом продукция цитокинов, восполнение запасов цитокинов или АРР у новорожденных может быть особенно полезным при лечении недоношенных новорожденных. Знание недостатков врожденного иммунного ответа может предоставить конкретные возможности для разработки новых методов лечения.
1).Поскольку у новорожденных нарушена индуцированная сепсисом продукция цитокинов, восполнение запасов цитокинов или АРР у новорожденных может быть особенно полезным при лечении недоношенных новорожденных. Знание недостатков врожденного иммунного ответа может предоставить конкретные возможности для разработки новых методов лечения.
6. Potential Therapeutics Potential TherapeuticsХотя инфекции SE часто выводятся из кровотока новорожденных в течение нескольких дней после внутривенного введения антибиотиков (например, ванкомицина), эти инфекции могут рецидивировать и связаны со значительной заболеваемостью и затратами на здравоохранение [92–94]. Кроме того, может возникать устойчивость к ванкомицину [95]. Соответственно, необходимы дополнительные профилактические и терапевтические стратегии. Инъекция металлоэндопептидазы лизостафина, производной S. simulans , которая расщепляет сшивающие пентаглициновые мостики в клеточных стенках стафилококков, двухдневным мышам, инфицированным MRSA, снижала бактериальную нагрузку, улучшала прибавку в весе новорожденных и повышала выживаемость подобно ванкомицину [96]. ]. Другой подход к борьбе со стафилококковой инфекцией заключается в усилении защиты хозяина за счет повышения качества фагоцитарного ответа в раннем возрасте. В исследовании, посвященном изучению лейкоцитов глубоко недоношенных детей (24–32 недели гестации), лечение их лейкоцитов ex vivo интерфероном (IFN)- γ обратило их врожденный иммунодефицит [65]. Поскольку новорожденные имеют повышенную восприимчивость к сепсису, было изучено лечение новорожденных антителами, специфичными для SE и/или SA.Однако внутривенное введение иммуноглобулина от доноров с высокими титрами антител к СЭ и/или СА не оказало существенного влияния на сепсис у недоношенных новорожденных [99–101]. 7. Будущие направления/перспективы Многие исследования задокументировали сепсис с поздним началом у новорожденных, вызванный стафилококковой инфекцией.Текущие знания об особой иммунной системе недоношенных новорожденных обеспечивают по крайней мере три подхода к профилактике и/или лечению Staphylococcus spp. инфекции. (1) Активация PRR для усиления врожденной антибактериальной защиты. Активация PRR может изменить уставку врожденной иммунной системы, что приведет к усилению защиты хозяина в ответ на последующую провокацию рядом патогенов. Это явление является формой врожденной памяти, то есть проявляется у многих форм жизни, включая растения и насекомых, и получило название «тренированный иммунитет» [102]. В целом необходимы дальнейшие исследования уникальных аспектов взаимодействия неонатального хозяина и стафилококкового патогена для оценки безопасности и эффективности вышеупомянутых подходов и выявления новых. 8. Обсуждение В этом обзоре обобщены недавние исследования врожденного иммунного ответа у недоношенных и доношенных новорожденных по сравнению со взрослыми в ответ на инфекцию SE или SA. Мы подчеркиваем важный прогресс в определении отчетливого врожденного иммунного ответа новорожденных на Staphylococci spp. БлагодарностиЛаборатория OL финансируется Национальным институтом здравоохранения R01-AI100135-01 и Глобальными грантами здравоохранения Фонда Билла и Мелинды Гейтс OPPGH5284 и OPP1035192, а также получает спонсорскую поддержку и реагентную поддержку от VentiRx Pharmaceuticals и 3 M Drug Delivery Systems. . Мелани Р. Пауэр Кумбс в настоящее время финансируется программой стажировок Mitacs-Accelerate. Введение | ОИТН: Руководство по S. aureus | Инфекционный контроль Первый Staphylococcus aureus ( S.aureus ) о вспышке среди младенцев в больничных яслях сообщалось в литературе в конце 1800-х годов. Когда в 2009 г. началась работа над этим руководством, проект рекомендаций был сосредоточен только на MRSA. В то время база литературы по MSSA в отделениях интенсивной терапии интенсивной терапии была скудной и считалась недостаточной для поддержки полного обзора литературы по этой теме. С тех пор были опубликованы исследования, демонстрирующие бремя заболевания MSSA и его профилактика в отделении интенсивной терапии. Хотя MRSA остается эпидемиологически значимым и приоритетным патогеном, инфекции MSSA намного превышают инфекции MRSA в отделениях интенсивной терапии, поэтому стратегии профилактики S.aureus в целом нужны. Новорожденные, получившие колонизацию S. aureus , подвергаются повышенному риску заражения S. aureus .[21] Конечной целью усилий по предотвращению и контролю передачи S. Этот документ основан на текущем понимании динамики передачи S.aureus в условиях отделения интенсивной терапии [41, 42]. В этом документе приводятся конкретные рекомендации по вмешательству, которое необходимо осуществлять при наличии доказательств продолжающейся передачи S.aureus , повышенной заболеваемости S. aureus или в условиях вспышки. Тем не менее, нет дискретных контрольных показателей или пороговых значений для S. aureus или показателей инфицирования MRSA, указывающих, когда требуются дополнительные усилия. Медицинским учреждениям необходимо использовать свои собственные данные, чтобы определить, когда следует добавить вмешательства и на что направить усилия по профилактике при возникновении инфекций. В рамках комплексной стратегии профилактики инфекций и борьбы с ними учреждения могут использовать систему повышения качества, чтобы максимизировать эффективность снижения инфекций.Такие инструменты, как Целевая оценка для профилактики (TAP) Strategy Toolkit [48] Центра по контролю и профилактике заболеваний США, позволяют больницам нацеливаться на места в учреждениях, оценивать пробелы и осуществлять вмешательства для предотвращения и контроля S. Это руководство было разработано для предоставления научно обоснованных рекомендаций по профилактике S. aureus среди этой уязвимой группы населения. По важным темам, по которым фактических данных было недостаточно для формулирования рекомендаций, основанных на фактических данных, доступно дополнительное руководство для информирования о предоставлении медицинской помощи в отделениях интенсивной терапии новорожденных: Серия официальных документов SHEA для отделений интенсивной терапии новорожденных (ОИТН): Практические подходы к профилактике заболеваний Staphylococcus aureus external icon.Кроме того, в других источниках доступны рекомендации по ведению микроорганизмов с множественной лекарственной устойчивостью (МЛУ) в медицинских учреждениях, включая ограничение вспышек MRSA.[49]
Стрептококковая инфекция группы B у детейНе то, что вы ищете?Что такое стрептококк группы В у младенцев? Стрептококк группы B (стрептококк) – это тип бактерий. Что вызывает инфекцию группы В у ребенка?Примерно у 1 из 4 беременных женщин есть СГБ в прямой кишке или влагалище. Во время беременности мать может передать СГБ ребенку. Ребенок может получить его из половых путей матери во время родов. Какие дети подвержены риску заражения стрептококком группы В?Новорожденные чаще заражаются стрептококком группы В, если у матери:
Каковы симптомы стрептококковой инфекции группы В у ребенка? Новорожденные со стрептококком группы В обычно имеют признаки в первые 24 часа после рождения.
У детей, заразившихся стрептококком группы В примерно через неделю после рождения, могут быть такие признаки, как:
Беременные женщины могут иметь стрептококк группы B без симптомов.Когда у них есть симптомы, они могут включать:
Как диагностируется стрептококк группы В у ребенка? Большинство новорожденных со стрептококковой инфекцией группы В имеют признаки в первые несколько часов после рождения. Как лечить стрептококк группы В у ребенка?Новорожденным, больным стрептококковой инфекцией группы В, может потребоваться лечение в отделении интенсивной терапии новорожденных (ОИТН). Обычно им назначают антибиотики внутривенно. Вашему ребенку могут потребоваться другие виды лечения, если инфекция тяжелая или если у него менингит или пневмония. Какие возможны осложнения стрептококка группы В у ребенка? У некоторых беременных женщин инфекция GBS может вызывать хориоамнионит.Это инфицирование амниотической жидкости, мешка и плаценты. Это также может вызвать послеродовую инфекцию (эндометрит). Инфекции мочевыводящих путей, вызванные GBS, могут привести к преждевременным родам. Беременным женщинам с СГБ чаще требуется кесарево сечение. У них также более вероятно сильное кровотечение после родов. Стрептококк группы B является наиболее частой причиной серьезных инфекций у новорожденных. Инфекция GBS может привести к менингиту, пневмонии или сепсису. Менингит чаще встречается у ребенка, у которого инфекция СГБ происходит через неделю или несколько месяцев после рождения. Что я могу сделать, чтобы предотвратить появление стрептококка группы B у моего ребенка? Все беременные женщины должны быть проверены на стрептококк группы B в рамках плановой дородовой помощи. На поздних сроках беременности ваш лечащий врач может проверить наличие СГБ, взяв мазок из влагалища и прямой кишки во время гинекологического осмотра. Он или она также может проверить вашу мочу на GBS. Мазок или моча отправляются в лабораторию для выращивания бактерий. Тесты обычно проводятся между 35 и 37 неделями беременности. Результаты могут занять несколько дней.Женщина, у которой есть GBS, может дать положительный результат в определенное время, а не в другое. Если у вас положительный результат теста на СГБ во время беременности, вам будут вводить антибиотики внутривенно (в/в) во время родов. Это снижает риск заражения вашего ребенка. Пенициллин является наиболее часто назначаемым антибиотиком. Сообщите своему поставщику медицинских услуг, если у вас есть аллергия на лекарства. Если у вас не диагностирован СГБ, вам могут назначить антибиотики до родов и родов, если у вас есть определенные факторы риска.К ним относятся:
Некоторые дети все еще заболевают СГБ даже при тестировании и лечении. Продолжаются исследования по созданию вакцин для предотвращения инфекции GBS. Когда мне следует позвонить лечащему врачу моего ребенка? У большинства новорожденных с СГБ есть признаки до выписки из больницы.
Если у вашего ребенка есть какие-либо из этих симптомов, немедленно позвоните лечащему врачу вашего ребенка. Ключевые моменты о стрептококке группы В у детей
Следующие шагиСоветы, которые помогут вам получить максимальную отдачу от визита к поставщику медицинских услуг вашего ребенка:
Ассоциация между развивающейся назальной микробиотой госпитализированных новорожденных и колонизацией золотистым стафилококком | Открытый форум по инфекционным заболеваниямАннотацияИстория вопроса Госпитализированные новорожденные подвергаются высокому риску инвазивной инфекции Staphylococcus aureus . Назальная колонизация S. aureus часто предшествует инфекции. Назальная микробиота может препятствовать или поддерживать колонизацию. Мы стремились охарактеризовать и сравнить назальную микробиоту госпитализированных новорожденных, которые приобрели колонизацию S. Методы Мы получили остаточные образцы носовых ходов от госпитализированных новорожденных, которые еженедельно проверялись на колонизацию носа S. aureus и лечились интраназальным мупироцином в случае колонизации.Восемь случаев были сопоставлены по хронологическому возрасту и системному воздействию антибиотиков с 7 контрольными. Мы извлекли ДНК, секвенировали область V3-V4 гена 16s рРНК и выполнили таксономическое определение. Богатство видов бактерий, относительное обилие и предсказанное in silico содержание генов сравнивали между случаями и контролем за 7 дней до приобретения S. aureus , во время приобретения и через 7 дней после приобретения и лечения. Результаты Обычные комменсалы, включая недифтерийные коринебактерии, были более многочисленны в носовых ходах контрольной группы, а Rothia mucilaginosa была более многочисленной в случаях через 7 дней после интраназального лечения мупироцином, чем в случаях за 7 дней до S. Выводы Новорожденные без назальной колонизации S. aureus имели более высокую численность бактериальных видов, которые противодействуют S. aureus напрямую или путем выбора полезных соколонизаторов. Эти различия могут сообщить роману S.Стратегии профилактики инфекции, вызванной золотистым стафилококком , у детей из группы высокого риска. Staphylococcus aureus является основной причиной инвазивных бактериальных инфекций у госпитализированных младенцев [1]. Бессимптомная колонизация передних отделов носа, первичной анатомической ниши для S. aureus , является важным предшественником болезни S. aureus [2]. Многие новорожденные становятся колонизированными S. Виды бактерий, населяющие полость носа, могут влиять на восприимчивость младенцев к заражению S.aureus и последующий риск заражения S. aureus [3]. Растущая доступность технологий секвенирования позволила изучить эти микробные сообщества и то, как они взаимодействуют, чтобы повысить восприимчивость или устойчивость к колонизации S. aureus . У взрослых некоторые микроорганизмы чаще встречаются у неносителей S. aureus , и введение этих организмов может устранить S. aureus из микробного сообщества носа или ограничить его рост [4]. Не все новорожденные, подвергшиеся воздействию S. aureus , становятся колонизированными. Сложная связь между назальным микробиомом и колонизацией S. aureus у новорожденных из группы высокого риска ранее не изучалась. Используя секвенирование гена 16S рРНК, мы стремились охарактеризовать развивающуюся назальную микробиоту в удобной выборке госпитализированных младенцев с течением времени, сравнить микробные сообщества, населяющие ноздри тех новорожденных, у которых была и не была колонизирована S. МЕТОДЫДизайн исследования и выборка В нашем исследовании описывается микробиота носа новорожденных и ее связь с колонизацией S. aureus в удобной выборке из 15 новорожденных, поступивших в отделение интенсивной терапии новорожденных (ОИТН) больницы Джона Хопкинса. Это исследование было одобрено Институциональным наблюдательным советом Johns Hopkins Medicine. У всех младенцев, поступающих в отделение интенсивной терапии новорожденных, еженедельно берут мазки из носовых ходов для выявления S.aureus с использованием Eswabs (Copan Diagnostics, Murrieta, CA), как описано ранее [5]. Новорожденных, у которых вырастает S. aureus при еженедельном наблюдении за культурами, лечат интраназальным мупироцином в течение 5 дней. Характеристики исследуемой когорты
Характеристики когорты исследования
Обработка проб и выделение ДНК В рамках текущей программы наблюдения в больнице образцы для наблюдения были высеяны на чашки с агаром CHROM (BD Diagnostics, Sparks, MD) и инкубированы в течение 24 часов, после чего S.aureus был идентифицирован с помощью окрашивания по Граму и теста на коагулазу, как описано ранее [6]. Остатки транспортной среды Эмиса переносили в криопробирки и хранили при –80°С. Для экстракции ДНК микробного сообщества выбранные образцы размораживали, а клетки лизировали с использованием ферментативного коктейля из лизоцима, мутанолизина, протеиназы К и лизостафина с последующим механическим лизисом с использованием метода биения. Анализ последовательности ампликона 16S рРНК необработанных парных чтения были объединены с использованием FLASH и отфильтрованы с максимальной частотой ошибок 0,5% и минимальной длиной 200 п.н. с использованием Trimmomatic и QIIME [8–10].Затем BLASTN использовали для идентификации и удаления ложных попаданий в контрольный геном PhiX. Из полученных последовательностей вырезали праймеры, которые затем оценивали на наличие химер с помощью UCLUST в режиме de novo [11]. Затем последовательности были проверены на наличие примесей человека с использованием Bowtie2, после чего был проведен чувствительный поиск BLASTN в базе данных GreenGenes 16S [12]. Хлоропластные и митохондриальные загрязнения были идентифицированы и отфильтрованы с помощью классификатора RDP с доверительной вероятностью 80% [13]. Полученные высококачественные последовательности затем были представлены для таксономического присвоения с высоким разрешением с помощью Resphera Insight, подхода, способного обеспечить присвоение видового уровня [14]. Статистический анализ Мы сравнили разнообразие видов бактерий, состав и предсказанное in silico содержание генов назальной микробиоты с недельными интервалами для новорожденных, которые получили и не приобрели колонизацию S. aureus . После нормализации уровней охвата до 30 000 последовательностей на образец количество наблюдаемых видов использовали в качестве меры бактериального богатства и сравнивали между случаями и контролем с использованием критерия Манна-Уитни отдельно для образцов, взятых за неделю до S.aureus (время = –7 дней), во время приобретения S. aureus (время = 0) и постколонизация и лечение интраназальным мупироцином (время = 7 дней). РЕЗУЛЬТАТЫИсследуемая популяцияИсследуемая группа состояла из 15 новорожденных, которые еженедельно проходили тестирование на назальный S.aureus , 8 из которых приобрели S. aureus за период исследования (табл. 1). Из этих 15 новорожденных 8 (53%) были женского пола, 12 (80%) родились с помощью кесарева сечения и 12 (80%) подвергались системной антибиотикотерапии до времени = 0. Все младенцы, включенные в наше исследование, родились. недоношенные (<37 недель гестационного возраста) со средним гестационным возрастом 30 недель и имели низкий вес при рождении (<2500 г), при этом средний вес при рождении составлял 1380 г. Мы провели секвенирование гена 16s рРНК микробных сообществ из 89 мазков из носа, в результате чего было получено 6.2 × 10 6 прочтений. Микробиота госпитализированных новорожденных демонстрирует временную изменчивость Количество наблюдаемых видов или видовое богатство сравнивали между случаями и контролем с течением времени (рис. Рисунок 1. Изменчивость неонатальной микробиоты носа у новорожденных, которые приобрели назальную колонизацию Staphylococcus aureus (случаи), и у тех, у кого не было назальной колонизации S. aureus (контроль) во времени (дни) по отношению к дню приобретения для случаев (t = 0).А, видовое богатство. B, относительная численность S. aureus. C, относительная численность видов Corynebacterium . D, относительная численность Rothia mucilaginosa . Рисунок 1. Изменчивость неонатальной назальной микробиоты у новорожденных, инфицированных Staphylococcus aureus назальной колонизации (случаи), и у тех, у кого не было назальной колонизации S. aureus (контроль) с течением времени (дней) по сравнению с день приобретения для случаев (t = 0).А, видовое богатство. Случаи, получавшие интраназальное введение мупироцина (время = +7), были сравнительно богаты по сравнению с контролем при времени = +7 ( P = 0,75). Средняя относительная численность видов Corynebacterium в случаях после лечения при времени = +7 увеличилась до 29,4% по сравнению со средним значением 9,2% при времени = -7 (средняя разница 20.2%; 95% доверительный интервал [ДИ], от 10,64% до 51,02%; P = 0,07 по сумме знаковых рангов Уилкоксона). Средняя относительная численность видов Corynebacterium в случаях после лечения стала такой же, как и в контроле при времени = +7 (29,4% и 24,5% соответственно; средняя разница 4,9%; 95% ДИ от -32,7% до 42,2%). ; P = 1,0 по сумме рангов Уилкоксона). Средняя относительная численность Rothia mucilaginosa в случаях после лечения, в момент времени = +7, увеличилась до 22,5% по сравнению со средним значением <0. Случаи и контрольная группа имеют композиционно и функционально разные назальные микробиоты Индивидуальные различия были доминирующим фактором, влияющим на состав назальной микробиоты ( P < .01; R 2 = 0,30), но сам по себе статус случай-контроль также в значительной степени способствовал вариации в составе, наблюдаемой между новорожденными ( P < 0,01; R 2 = 0,04). Средняя относительная численность каждого наблюдаемого вида сравнивалась между случаями и контролем для образцов, взятых за 1 неделю до колонизации случая (время = -7) (рис. Рисунок 2. Относительное обилие видов в образцах, взятых у новорожденных, которые заразились Staphylococcus aureus назальной колонизацией (случаи), и у тех, кто не заразился S. aureus назальной колонизацией (контроль) за неделю до заражения S .aureus (время = –7 дней). Также показано среднее относительное обилие видов в случаях и контроле в момент времени = –7. Рисунок 2. Относительное обилие видов в образцах, взятых у новорожденных, которые заразились Staphylococcus aureus назальной колонизацией (случаи), и у тех, кто не заразился S. aureus назальной колонизацией (контроль) за неделю до заражения S. aureus (время = –7 дней). Также показано среднее относительное обилие видов в случаях и контроле в момент времени = -7. PICRUSt использовали для определения содержания функциональных генов в случаях и контроле с использованием образцов, взятых в момент времени = –7 (рис. Рисунок 3. Прогнозируемое среднее относительное количество генов, участвующих в выборе функциональных путей у новорожденных, которые приобрели Staphylococcus aureus назальной колонизации (случаев) до S.aureus в момент времени = -7, соответствующие новорожденные, которые не получили носовых колоний S. Рисунок 3. Прогнозируемое среднее относительное количество генов, участвующих в выборе функциональных путей у новорожденных, которые заразились Staphylococcus aureus носовой колонизации (случаи) до приобретения S. aureus в момент времени = –7, соответствует новорожденным, которые не заразились Назальная колонизация S. aureus (контроль) в момент времени = –7 и случаи после лечения в момент времени = +7. ОБСУЖДЕНИЕ Мы изучили назальную микробиоту госпитализированных новорожденных и выявили существенные различия между составом и предполагаемым метагеномом новорожденных, которые приобрели и не приобрели S. aureus . Новорожденные подвергаются воздействию уникальной среды и таких вмешательств, как антибиотики и респираторная поддержка в отделении интенсивной терапии. Младенцы, не подвергшиеся колонизации S. aureus , имели более высокую численность микроорганизмов, обычно присутствующих у неносителей S. aureus , таких как D. pigrum , по сравнению со случаями [19]. Несмотря на то, что у всех 15 пациентов, включенных в это исследование, до времени = 0 была низкая численность S. aureus , только у 8 новорожденных наблюдалась численность, соответствующая обнаружению с помощью обычного посева, что является известным фактором риска для S. aureus инфекционное заболевание. Обнаружение S. aureus в образцах с отрицательными посевами может свидетельствовать о таксономической неправильной классификации или низкой абсолютной численности S.aureus , который не определяется культурой. Новорожденные, у которых были культуры, растущие S. aureus , имели более низкое видовое богатство во время колонизации, чем контрольные, и это также соответствовало моменту, когда S. aureus был наиболее обильным организмом в ноздрях у этих пациентов. Это может указывать на то, что более низкое богатство предрасполагало ноздри некоторых новорожденных к доминированию S. aureus или что доминирование S. После лечения интраназальным мупироцином новорожденных с культурами, растущими S. aureus , они в целом стали более богатыми видами, с более высокой численностью видов Corynebacterium и видов Rothia .Предсказанная численность генов, способствующих синтезу определенных противомикробных соединений, более распространенных в контроле, также увеличивалась в случаях после лечения, отражая эти изменения в составе. Хотя роль этих антимикробных соединений в колонизации носа S. aureus остается неясной, недавно была описана роль антимикробных пептидов в прямом бактериальном вмешательстве против S. Это исследование имеет несколько ограничений. Во-первых, была изучена небольшая удобная выборка новорожденных, у каждого из которых было разное количество образцов, собранных в разное время на протяжении всего поступления. Во-вторых, при сопоставлении случай-контроль не учитывались такие характеристики, как способ родов, респираторная поддержка и диета.Эти характеристики могут влиять на восприимчивость младенцев к заражению S. aureus напрямую или путем изменения назального микробиома. Несмотря на эти ограничения, мы обнаружили значительные различия между микробиотой новорожденных в случаях и контрольной группе до колонизации S. Дополнительные данные Дополнительные материалы доступны по адресу Open Forum Infectious Diseases онлайн.Состоящие из данных, предоставленных авторами в интересах читателя, размещенные материалы не редактируются и являются исключительной ответственностью авторов, поэтому вопросы или комментарии должны быть адресованы соответствующему автору. ПодтверждениеМы хотели бы поблагодарить докторов Мэри-Клэр Рогманн и Синтию Л. Сирс за их конструктивные предложения. Финансовая поддержка. Эта работа была поддержана Агентством исследований и качества в области здравоохранения (R01 HS022872) и Национальными институтами здравоохранения (R21 AI135179). Возможные конфликты интересов. Аарон Милстоун сообщает о консультации для Бектон Дикенсон. Джеймс Уайт является основателем Resphera Biosciences и имеет долю в компании. Остальные авторы сообщают об отсутствии конфликта интересов. Все авторы представили форму ICMJE для раскрытия потенциальных конфликтов интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи. Предварительная презентация. Предварительные результаты этого исследования были представлены на IDWeek; октябрь 2017 г. Каталожные номера1.Озеро JG ,Weiner LM ,Milstone AM , и др.Распределение патогенов и устойчивость к противомикробным препаратам среди педиатрических инфекций, связанных с оказанием медицинской помощи, по данным Национальной сети безопасности здравоохранения, 2011–2014 гг. .Infect Control Hosp Epidemiol 2018 ;39 :1 –11 .2.Воскерчян А ,Акинбойо ИЦ ,Колантуони Е , и др.Ассоциация активного надзора и программы деколонизации заболеваемости ростом клинических культур Staphylococcus aureus в отделении интенсивной терапии новорожденных .Infect Control Hosp Epidemiol 2018 ;39 :882 –4 .3.Хамаш ДФ ,Воскертчян А ,Милстон АМ . Манипуляции с микробиомом: эволюция стратегии профилактики заболевания S. aureus у детей .Дж Перинатол 2018 ;38 (2 ):105 –9 .4.Ramsey MM ,Freire MO ,Габрильска RA , и др.Staphylococcus aureus смещается в сторону комменсализма в ответ на Corynebacterium видов .Front Microbiol 2016 ;7 :1230 .5.Popoola VO ,Colantuoni E ,Suwantarat N , et al.Активное культуральное наблюдение и деколонизация для снижения Staphylococcus aureus инфекции в отделении интенсивной терапии новорожденных .Infect Control Hosp Epidemiol 2016 ;37 :381 –7 .6.Popoola VO ,Colantuoni E ,Suwantarat N и др.Активное культуральное наблюдение и деколонизация для снижения Staphylococcus aureus инфекции в отделении интенсивной терапии новорожденных . Infect Control Hosp Epidemiol 2016 ;37 :381 –7 .7.Roghmann MC ,Lydecker AD ,Hittle L , и др.Сравнение микробиоты пожилых людей, проживающих в домах престарелых, и населения .mSphere 2017 ;2 .8.Caporaso JG ,Bittinger K ,Bushman FD , и др.PyNAST: гибкий инструмент для выравнивания последовательностей по шаблону выравнивания .Биоинформатика 2010 ;26 :266 –7 .9.Kuczynski J ,Stombaugh J ,Walters WA , et al.Использование QIIME для анализа последовательностей генов 16S рРНК из микробных сообществ .Curr Protoc Биоинформатика 2011 ;Глава 10 :Блок 10 17 .10.Магоч Т ,Зальцберг SL .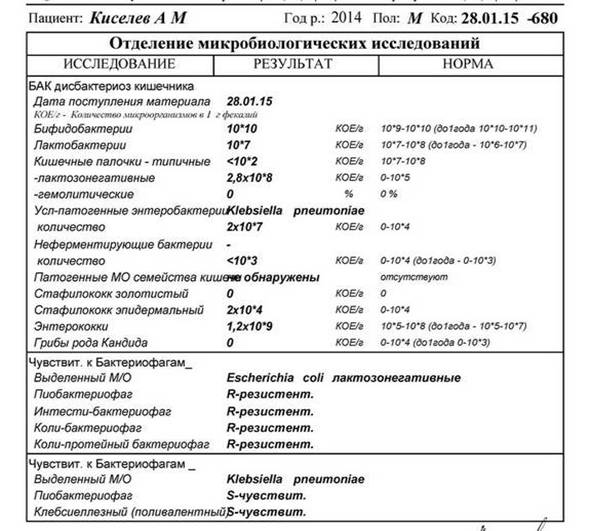 FLASH: быстрая корректировка длины коротких ридов для улучшения сборки генома .Биоинформатика 2011 ;27 :2957 –63 .11.Edgar RC ,Haas BJ ,Clemente JC и др.UCHIME повышает чувствительность и скорость обнаружения химер .Биоинформатика 2011 ;27 :2194 –200 .12.Лангмид Б ,Зальцберг SL .Быстрое выравнивание с промежутками чтения с помощью Bowtie 2 .Nat Methods 2012 ;9 :357 –9 .13.Ван Q ,Гаррити GM ,Тиедже JM ,Коул JR .Наивный байесовский классификатор для быстрого отнесения последовательностей рРНК к новой таксономии бактерий .Appl Environ Microbiol 2007 ;73 :5261 –7 . 14. 14.Drewes JL ,Белый JR ,Dejea CM и др.Метаанализ профиля гена бактериальной 16S рРНК с высоким разрешением и статус биопленки выявил распространенные консорциумы колоректального рака .NPJ Biofilms Microbiomes 2017 ;3 :34 . электронная коллекция. doi: 10.1038/s41522-017-0040-315.Langille MG ,Zaneveld J ,Caporaso JG , и др.Прогностическое функциональное профилирование микробных сообществ с использованием последовательностей маркерного гена 16S рРНК .Нат Биотехнолог 2013 ;31 :814 –21 .16.Диксон P .VEGAN, пакет функций R для экологии сообщества .J Veg Sci 2003 ;14 :927 –30 .17.Домингес-Бельо MG ,Костелло EK ,Контрерас М , и др. Способ родоразрешения определяет приобретение и структуру исходной микробиоты в различных средах обитания новорожденных .Proc Natl Acad Sci USA 2010 ;107 :11971 –5 .18.Прабхудас М ,Адкинс Б ,Ганс Х , и др.Проблемы с иммунитетом младенцев: последствия для реакции на инфекцию и вакцины .Нат Иммунол 2011 ;12 :189 –94 .19.Liu CM ,Цена LB ,Hungate BA , и др.Staphylococcus aureus и экология микробиома носа .Sci Adv 2015 ;1 :e1400216 .20.Уэхара Y ,Накама H ,Агемацу K , и др.Бактериальная интерференция среди обитателей носа: эрадикация Staphylococcus aureus из носовой полости путем искусственной имплантации Corynebacterium sp . J Hosp Infect 2000 ;44 :127 –33 .21.Уэхара Y ,Кикучи K ,Накамура T , и др.H(2)O(2), продуцируемый стрептококками группы viridans, может способствовать ингибированию метициллин-резистентного Staphylococcus aureus колонизации полости рта у новорожденных .Clin Infect Dis 2001 ;32 :1408 –13 .22.Пахарик АЕ ,Парлет СР ,Чунг Н , и др.Коагулазоотрицательный стафилококковый штамм предотвращает колонизацию Staphylococcus aureus и кожную инфекцию, блокируя определение кворума .Микроб-хозяин клетки 2017 ;22 :746 –756.e5 .23.Piewngam P ,Zheng Y ,Nguyen TH , и др.Элиминация патогенов пробиотиком Bacillus посредством интерференции сигналов . Природа 2018 ;562 (7728 ):532 –7 .© Автор(ы), 2019 г. Опубликовано Oxford University Press от имени Американского общества инфекционистов. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by/4.0/), что разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. . Previous...NextКак определит... | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||







 aureus у новорожденных.
aureus у новорожденных.

 Альтернативные методы типирования могут быть использованы для дальнейшего различения широко распространенных штаммов.
Альтернативные методы типирования могут быть использованы для дальнейшего различения широко распространенных штаммов.

 Плазма цельной крови новорожденных с ELBW, получавших IFN- γ , значительно повышала фагоцитоз SA и SE клетками HL-60 [65].Это говорит о том, что необходимы дальнейшие исследования для изучения любых потенциальных терапевтических преимуществ для новорожденных. Введение гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) новорожденным увеличивало продукцию нейтрофилов, но не влияло на сепсис [97]. Лечение септических новорожденных с очень низкой массой тела при рождении с помощью гранулоцитов (G)-CSF повышало фагоцитарную активность нейтрофилов и окислительный взрыв, но не сообщалось о влиянии на сепсис из-за небольшого числа пациентов с сепсисом в исследовании [98].
Плазма цельной крови новорожденных с ELBW, получавших IFN- γ , значительно повышала фагоцитоз SA и SE клетками HL-60 [65].Это говорит о том, что необходимы дальнейшие исследования для изучения любых потенциальных терапевтических преимуществ для новорожденных. Введение гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) новорожденным увеличивало продукцию нейтрофилов, но не влияло на сепсис [97]. Лечение септических новорожденных с очень низкой массой тела при рождении с помощью гранулоцитов (G)-CSF повышало фагоцитарную активность нейтрофилов и окислительный взрыв, но не сообщалось о влиянии на сепсис из-за небольшого числа пациентов с сепсисом в исследовании [98]. Тем не менее, авторы сообщают о тенденции к снижению заболеваемости СА-инфекцией у пациентов, получавших антистафилококковые антитела, что позволяет предположить, что для более точного изучения эффективности потребуется более мощное исследование [101].
Тем не менее, авторы сообщают о тенденции к снижению заболеваемости СА-инфекцией у пациентов, получавших антистафилококковые антитела, что позволяет предположить, что для более точного изучения эффективности потребуется более мощное исследование [101].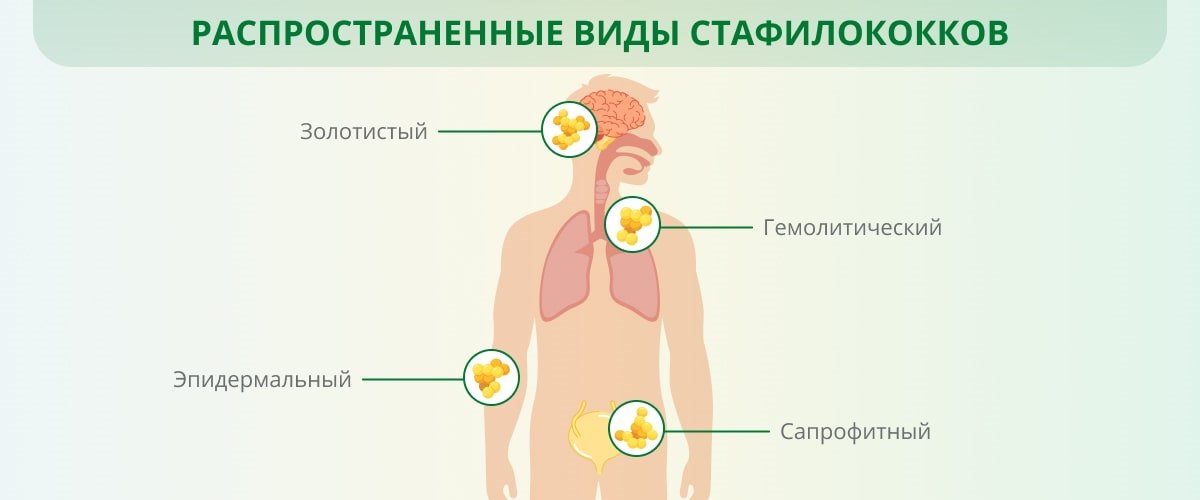 Например, внутрибрюшинное введение агониста TLR за 24 часа до заражения полимикробным перитонитом заметно повышает неонатальную защиту и выживаемость после последующего полимикробного сепсиса за счет усиления индуцируемой бактериями продукции цитокинов и фагоцитарной функции [103]. (2) Использование антагонистов TLR в качестве дополнительной противоинфекционной терапии . В отличие от предварительного воздействия агонистов TLR для усиления врожденной защиты до инфекции, другая стратегия может быть полезной во время установленной инфекции.Убитые антибиотиками бактерии больше не жизнеспособны, но продолжают активировать PRR, тем самым вызывая воспаление, которое может быть вредным для многих систем органов, включая мозг [27]. Соответственно, дополнительное лечение антагонистом TLR вместе с обычными антибиотиками может помочь устранить воспаление, связанное с инфекцией, и снизить последующую заболеваемость инфекцией, как было продемонстрировано in vivo в других моделях и клинических условиях [104, 105].
Например, внутрибрюшинное введение агониста TLR за 24 часа до заражения полимикробным перитонитом заметно повышает неонатальную защиту и выживаемость после последующего полимикробного сепсиса за счет усиления индуцируемой бактериями продукции цитокинов и фагоцитарной функции [103]. (2) Использование антагонистов TLR в качестве дополнительной противоинфекционной терапии . В отличие от предварительного воздействия агонистов TLR для усиления врожденной защиты до инфекции, другая стратегия может быть полезной во время установленной инфекции.Убитые антибиотиками бактерии больше не жизнеспособны, но продолжают активировать PRR, тем самым вызывая воспаление, которое может быть вредным для многих систем органов, включая мозг [27]. Соответственно, дополнительное лечение антагонистом TLR вместе с обычными антибиотиками может помочь устранить воспаление, связанное с инфекцией, и снизить последующую заболеваемость инфекцией, как было продемонстрировано in vivo в других моделях и клинических условиях [104, 105]. Поскольку в настоящее время существуют ограниченные стратегии борьбы с заболеваниями, вызываемыми этими патогенами, есть надежда, что недавний прогресс в определении соответствующих факторов защиты хозяина и патогенных факторов [108, 109] даст информацию о новых подходах к профилактике и лечению сепсиса с поздним началом, вызванного Staphylococci spp. .
Поскольку в настоящее время существуют ограниченные стратегии борьбы с заболеваниями, вызываемыми этими патогенами, есть надежда, что недавний прогресс в определении соответствующих факторов защиты хозяина и патогенных факторов [108, 109] даст информацию о новых подходах к профилактике и лечению сепсиса с поздним началом, вызванного Staphylococci spp. . [24] Этот микроорганизм в настоящее время является наиболее часто регистрируемым возбудителем инфекций, связанных с оказанием медицинской помощи (ИСМП) в отделениях интенсивной терапии новорожденных (ОИТН) США [25]. Частота инвазивных инфекций S. aureus высока у новорожденных, особенно у недоношенных детей и детей с низкой массой тела при рождении.[26] Инфекции, вызванные метициллин-резистентным штаммом S. aureus (MRSA), у новорожденных были описаны с начала 1980-х годов [27], и сообщалось о многочисленных вспышках в отделениях интенсивной терапии новорожденных.[6,28–39] Хотя вспышки S. aureus среди пациентов, особенно MRSA, создают серьезные проблемы для отделений интенсивной терапии [40], S. aureus также является эндемичным в отделениях интенсивной терапии [21], необходимость стратегий профилактики как в условиях вспышек, так и в условиях эндемии. В то время как MRSA долгое время был в центре усилий по профилактике из-за сложности его лечения и искоренения, недавние исследования показали, что чувствительный к метициллину S.
[24] Этот микроорганизм в настоящее время является наиболее часто регистрируемым возбудителем инфекций, связанных с оказанием медицинской помощи (ИСМП) в отделениях интенсивной терапии новорожденных (ОИТН) США [25]. Частота инвазивных инфекций S. aureus высока у новорожденных, особенно у недоношенных детей и детей с низкой массой тела при рождении.[26] Инфекции, вызванные метициллин-резистентным штаммом S. aureus (MRSA), у новорожденных были описаны с начала 1980-х годов [27], и сообщалось о многочисленных вспышках в отделениях интенсивной терапии новорожденных.[6,28–39] Хотя вспышки S. aureus среди пациентов, особенно MRSA, создают серьезные проблемы для отделений интенсивной терапии [40], S. aureus также является эндемичным в отделениях интенсивной терапии [21], необходимость стратегий профилактики как в условиях вспышек, так и в условиях эндемии. В то время как MRSA долгое время был в центре усилий по профилактике из-за сложности его лечения и искоренения, недавние исследования показали, что чувствительный к метициллину S. aureus (MSSA) имеет такую же заболеваемость и смертность, что и MRSA, и чаще встречается у пациентов в отделениях интенсивной терапии. .[26,40]
aureus (MSSA) имеет такую же заболеваемость и смертность, что и MRSA, и чаще встречается у пациентов в отделениях интенсивной терапии. .[26,40] aureus в отделениях интенсивной терапии новорожденных является профилактика заболеваний у уязвимых новорожденных. Любая неонатальная инфекция может быть связана с долгосрочными последствиями, включая негативные долгосрочные нейрокогнитивные исходы и неблагоприятный прогноз. На практике пациентов отделений интенсивной терапии с MRSA и в некоторых случаях MSSA деколонизируют с целью предотвращения прогрессирования инвазивных заболеваний и ограничения дальнейшей передачи.Имеются ограниченные данные об оптимальных режимах деколонизации для этой популяции, а новые препараты и альтернативные методы лечения для деколонизации редко изучаются у новорожденных и вряд ли получат одобрение для широкого применения. Крайне необходимы стратегии по снижению риска при колонизации, но в то же время приоритет должен отдаваться усилиям по предотвращению передачи и последующей колонизации.
aureus в отделениях интенсивной терапии новорожденных является профилактика заболеваний у уязвимых новорожденных. Любая неонатальная инфекция может быть связана с долгосрочными последствиями, включая негативные долгосрочные нейрокогнитивные исходы и неблагоприятный прогноз. На практике пациентов отделений интенсивной терапии с MRSA и в некоторых случаях MSSA деколонизируют с целью предотвращения прогрессирования инвазивных заболеваний и ограничения дальнейшей передачи.Имеются ограниченные данные об оптимальных режимах деколонизации для этой популяции, а новые препараты и альтернативные методы лечения для деколонизации редко изучаются у новорожденных и вряд ли получат одобрение для широкого применения. Крайне необходимы стратегии по снижению риска при колонизации, но в то же время приоритет должен отдаваться усилиям по предотвращению передачи и последующей колонизации. Новые лабораторные методы, в том числе полногеномное секвенирование (WGS), позволяют предположить, что на родственные штаммы приходится наибольшая доля событий передачи в отделениях интенсивной терапии, предположительно от пациента к пациенту путем косвенного контакта. передача, но несколько неродственных штаммов могут передаваться одновременно параллельно, и часто появляются новые, неродственные штаммы. [43–46] Резервуары для новых и существующих штаммов изучены не полностью. Меры по профилактике инфекций, направленные на распространение инфекции от медицинского персонала и больничной среды, которым посвящен этот документ, могут оказаться недостаточными для предотвращения всех случаев передачи.В частности, родители являются известным резервуаром, из которого новорожденные могут получить колонизацию S. aureus , и вмешательство, направленное на родителей, может снизить передачу. Необходимы дальнейшие исследования, чтобы определить, когда стратегии по прерыванию передачи инфекции от родителей, такие как просветительские мероприятия по гигиене рук или деколонизация, могут предотвратить неонатальную болезнь S.
Новые лабораторные методы, в том числе полногеномное секвенирование (WGS), позволяют предположить, что на родственные штаммы приходится наибольшая доля событий передачи в отделениях интенсивной терапии, предположительно от пациента к пациенту путем косвенного контакта. передача, но несколько неродственных штаммов могут передаваться одновременно параллельно, и часто появляются новые, неродственные штаммы. [43–46] Резервуары для новых и существующих штаммов изучены не полностью. Меры по профилактике инфекций, направленные на распространение инфекции от медицинского персонала и больничной среды, которым посвящен этот документ, могут оказаться недостаточными для предотвращения всех случаев передачи.В частности, родители являются известным резервуаром, из которого новорожденные могут получить колонизацию S. aureus , и вмешательство, направленное на родителей, может снизить передачу. Необходимы дальнейшие исследования, чтобы определить, когда стратегии по прерыванию передачи инфекции от родителей, такие как просветительские мероприятия по гигиене рук или деколонизация, могут предотвратить неонатальную болезнь S. aureus .
aureus . aureus .
aureus .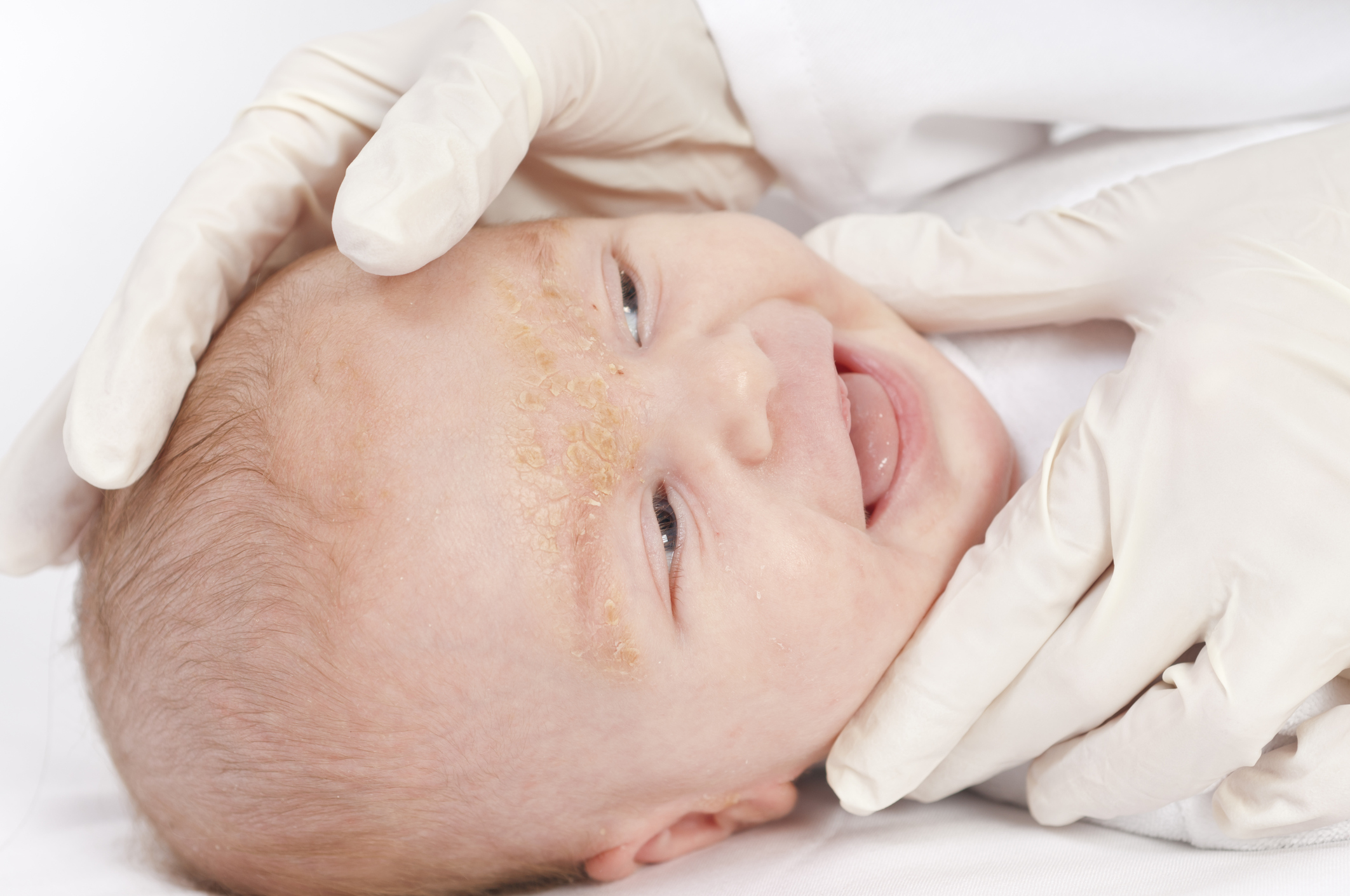 Американский журнал эпидемиологии. 1996;143(5):496-504.
Американский журнал эпидемиологии. 1996;143(5):496-504. ЯМА педиатрия. 2015;169(12):1105-1111.
ЯМА педиатрия. 2015;169(12):1105-1111. Инфекционный контроль и госпитальная эпидемиология. 2006;27(2):139-145.
Инфекционный контроль и госпитальная эпидемиология. 2006;27(2):139-145. Передача MRSA в отделении интенсивной терапии новорожденных: эпидемиологический и геномный филогенетический анализ.ПЛОС Один. 2013;8(1):e54898.
Передача MRSA в отделении интенсивной терапии новорожденных: эпидемиологический и геномный филогенетический анализ.ПЛОС Один. 2013;8(1):e54898. Его можно найти в пищеварительном тракте, мочевыводящих путях и половых органах взрослых. Инфекция GBS обычно не вызывает проблем у здоровых женщин до беременности. Но это может вызвать серьезное заболевание для новорожденного ребенка. Это может вызвать сепсис, пневмонию, менингит или судороги.
Его можно найти в пищеварительном тракте, мочевыводящих путях и половых органах взрослых. Инфекция GBS обычно не вызывает проблем у здоровых женщин до беременности. Но это может вызвать серьезное заболевание для новорожденного ребенка. Это может вызвать сепсис, пневмонию, менингит или судороги. Эти знаки могут включать:
Эти знаки могут включать: Лечащий врач вашего ребенка проверит биологические жидкости вашего ребенка, такие как кровь или спинномозговая жидкость.
Лечащий врач вашего ребенка проверит биологические жидкости вашего ребенка, такие как кровь или спинномозговая жидкость.

 Но у некоторых младенцев признаки проявляются позже. К ним могут относиться:
Но у некоторых младенцев признаки проявляются позже. К ним могут относиться:

 aureus (случаи) и тех, кто не приобрел S. aureus (контроль).
aureus (случаи) и тех, кто не приобрел S. aureus (контроль). приобретение aureus . Контрольная группа и пациенты, получавшие лечение, имели более высокое прогнозируемое количество генов, участвующих в синтезе определенных антимикробных соединений, чем в случаях до приобретения S. aureus .
приобретение aureus . Контрольная группа и пациенты, получавшие лечение, имели более высокое прогнозируемое количество генов, участвующих в синтезе определенных антимикробных соединений, чем в случаях до приобретения S. aureus . aureus вскоре после рождения.
aureus вскоре после рождения. aureus , и сделать вывод о функциональные пути, присутствующие в этих микробных сообществах, которые могут воздействовать на S.колонизация aureus .
aureus , и сделать вывод о функциональные пути, присутствующие в этих микробных сообществах, которые могут воздействовать на S.колонизация aureus . Мы считали случаи младенцев, которые приобрели колонизацию S. aureus , определяемую как наличие по крайней мере 1 контрольной культуры S. aureus , выращенной во время поступления в отделение интенсивной терапии. Время 0 (время = 0) было установлено как дата сбора, когда первая культура наблюдения выросла до с.золотистый . Новорожденных контрольной группы отбирали, если у них был взят мазок в хронологическом возрасте в пределах ±7 дней от возраста случая в момент времени = 0, и у них не было положительных контрольных культур на S. aureus. Поскольку все новорожденные, включенные в это исследование, были госпитализированы в ОИТН при рождении, мы считали хронологический возраст эквивалентным продолжительности пребывания в ОИТН. В дополнение к хронологическому возрасту на момент сбора образцов случаи и контроли были сопоставлены на основе их воздействия системных антибиотиков до времени = 0 (таблица 1).Один контроль был сопоставлен с 2 случаями, и время = 0 контрольных образцов, соответствующих каждому случаю, различалось в зависимости от хронологического возраста на момент приобретения S.
Мы считали случаи младенцев, которые приобрели колонизацию S. aureus , определяемую как наличие по крайней мере 1 контрольной культуры S. aureus , выращенной во время поступления в отделение интенсивной терапии. Время 0 (время = 0) было установлено как дата сбора, когда первая культура наблюдения выросла до с.золотистый . Новорожденных контрольной группы отбирали, если у них был взят мазок в хронологическом возрасте в пределах ±7 дней от возраста случая в момент времени = 0, и у них не было положительных контрольных культур на S. aureus. Поскольку все новорожденные, включенные в это исследование, были госпитализированы в ОИТН при рождении, мы считали хронологический возраст эквивалентным продолжительности пребывания в ОИТН. В дополнение к хронологическому возрасту на момент сбора образцов случаи и контроли были сопоставлены на основе их воздействия системных антибиотиков до времени = 0 (таблица 1).Один контроль был сопоставлен с 2 случаями, и время = 0 контрольных образцов, соответствующих каждому случаю, различалось в зависимости от хронологического возраста на момент приобретения S. aureus (таблица 1). Таким образом, 15 новорожденных предоставили для анализа 8 пар соответствующего возраста при времени = -7 и времени = 0 и 6 пар соответствующего возраста при времени = +7.
aureus (таблица 1). Таким образом, 15 новорожденных предоставили для анализа 8 пар соответствующего возраста при времени = -7 и времени = 0 и 6 пар соответствующего возраста при времени = +7.



 Затем экстрагированную ДНК очищали с использованием набора Zymo Fecal DNA (Zymo Research, Irvine, CA) для получения высококачественной геномной ДНК для профилирования бактериального сообщества.Амплификация гипервариабельной области V3-V4 гена 16S рРНК с помощью полимеразной цепной реакции (ПЦР) и мультиплексирование образцов для высокопроизводительного секвенирования с помощью Illumina HiSeq 2500 (считывание парных концов по 300 п.н.) с использованием универсальных праймеров 319F и 806R и Стратегия двойной индексации выполнялась, как описано ранее [7]. Гель-электрофорез использовали для подтверждения присутствия ампликонов, после чего выполняли нормализацию (25 нг ампликона гена 16S рРНК объединяли для каждого образца) с использованием набора SequalPrep Normalization Plate Kit (Thermo Fisher Scientific, Waltham, MA).Отрицательные контроли были включены на каждом этапе обработки (экстракция, ПЦР-амплификация гена 16S рРНК и секвенирование). Всего было охарактеризовано 89 образцов. Последовательности, созданные и проанализированные в этом исследовании, были депонированы в GenBank со ссылкой на NCBI BioProject ID PRJNA476107.
Затем экстрагированную ДНК очищали с использованием набора Zymo Fecal DNA (Zymo Research, Irvine, CA) для получения высококачественной геномной ДНК для профилирования бактериального сообщества.Амплификация гипервариабельной области V3-V4 гена 16S рРНК с помощью полимеразной цепной реакции (ПЦР) и мультиплексирование образцов для высокопроизводительного секвенирования с помощью Illumina HiSeq 2500 (считывание парных концов по 300 п.н.) с использованием универсальных праймеров 319F и 806R и Стратегия двойной индексации выполнялась, как описано ранее [7]. Гель-электрофорез использовали для подтверждения присутствия ампликонов, после чего выполняли нормализацию (25 нг ампликона гена 16S рРНК объединяли для каждого образца) с использованием набора SequalPrep Normalization Plate Kit (Thermo Fisher Scientific, Waltham, MA).Отрицательные контроли были включены на каждом этапе обработки (экстракция, ПЦР-амплификация гена 16S рРНК и секвенирование). Всего было охарактеризовано 89 образцов. Последовательности, созданные и проанализированные в этом исследовании, были депонированы в GenBank со ссылкой на NCBI BioProject ID PRJNA476107.
 Последовательности также были проанализированы с использованием Филогенетического исследования сообществ путем реконструкции ненаблюдаемых состояний (PICRUSt) с параметрами по умолчанию, чтобы сделать вывод о функциональном генном содержании каждого образца [15].
Последовательности также были проанализированы с использованием Филогенетического исследования сообществ путем реконструкции ненаблюдаемых состояний (PICRUSt) с параметрами по умолчанию, чтобы сделать вывод о функциональном генном содержании каждого образца [15]. Для каждого времени оценки (время = –7, 0 и 7) относительную численность выбранных организмов сравнивали между случаями и контролем, предполагая отрицательное биномиальное распределение с корректировкой значений P с использованием коэффициента ложных обнаружений (FDR). Было вычислено среднее изменение относительной численности видов бактерий в случаях до приобретения (время = -7) и после лечения (время = +7), и распределение относительной численности в случаях в эти 2 временные точки сравнивалось с использованием Уилкоксон подписал ранговый тест.Перестановочный дисперсионный анализ с использованием веганского пакета R использовался для оценки влияния межиндивидуальных вариаций, относительного времени и статуса «случай-контроль» на различия микробных сообществ по трем показателям β-разнообразия: взвешенный UniFrac, невзвешенный UniFrac и несходство Брея-Кертиса ( Дополнительная таблица 1) [16]. Мы сообщаем значения R 2 и P для несходства Брея-Кертиса ниже.
Для каждого времени оценки (время = –7, 0 и 7) относительную численность выбранных организмов сравнивали между случаями и контролем, предполагая отрицательное биномиальное распределение с корректировкой значений P с использованием коэффициента ложных обнаружений (FDR). Было вычислено среднее изменение относительной численности видов бактерий в случаях до приобретения (время = -7) и после лечения (время = +7), и распределение относительной численности в случаях в эти 2 временные точки сравнивалось с использованием Уилкоксон подписал ранговый тест.Перестановочный дисперсионный анализ с использованием веганского пакета R использовался для оценки влияния межиндивидуальных вариаций, относительного времени и статуса «случай-контроль» на различия микробных сообществ по трем показателям β-разнообразия: взвешенный UniFrac, невзвешенный UniFrac и несходство Брея-Кертиса ( Дополнительная таблица 1) [16]. Мы сообщаем значения R 2 и P для несходства Брея-Кертиса ниже.
 1А). Также были проанализированы временные изменения доли организмов, которые были по-разному многочисленны между случаями и контролем. Изменения в относительной численности избранных представляющих интерес организмов: видов S. aureus , видов Corynebacterium и Rothia mucilaginosa показаны с течением времени на рис. 1B-D.Точка времени выборки внесла значительный вклад в изменчивость состава микробиоты носа ( P < 0,01; R 2 = 0,03). Случаи имели значительно более низкое богатство в момент времени = 0, чем новорожденные того же хронологического возраста, которые не были колонизированы S. aureus ( P = 0,02), но 2 группы были сравнительно богатыми во все другие измеренные моменты времени ( Рисунок 1А). В момент времени = 0, S. aureus был наиболее многочисленным видом во всех случаях; однако у всех 15 исследованных новорожденных была низкая, но определяемая численность S.aureus до времени = 0 (рис.
1А). Также были проанализированы временные изменения доли организмов, которые были по-разному многочисленны между случаями и контролем. Изменения в относительной численности избранных представляющих интерес организмов: видов S. aureus , видов Corynebacterium и Rothia mucilaginosa показаны с течением времени на рис. 1B-D.Точка времени выборки внесла значительный вклад в изменчивость состава микробиоты носа ( P < 0,01; R 2 = 0,03). Случаи имели значительно более низкое богатство в момент времени = 0, чем новорожденные того же хронологического возраста, которые не были колонизированы S. aureus ( P = 0,02), но 2 группы были сравнительно богатыми во все другие измеренные моменты времени ( Рисунок 1А). В момент времени = 0, S. aureus был наиболее многочисленным видом во всех случаях; однако у всех 15 исследованных новорожденных была низкая, но определяемая численность S.aureus до времени = 0 (рис. 1B). Контроли были более обогащены видами Corynebacterium , чем случаи для большинства проанализированных временных точек (рис. 1C).
1B). Контроли были более обогащены видами Corynebacterium , чем случаи для большинства проанализированных временных точек (рис. 1C). B, относительная численность S. aureus. C, относительная численность видов Corynebacterium . D, относительная численность Rothia mucilaginosa .
B, относительная численность S. aureus. C, относительная численность видов Corynebacterium . D, относительная численность Rothia mucilaginosa .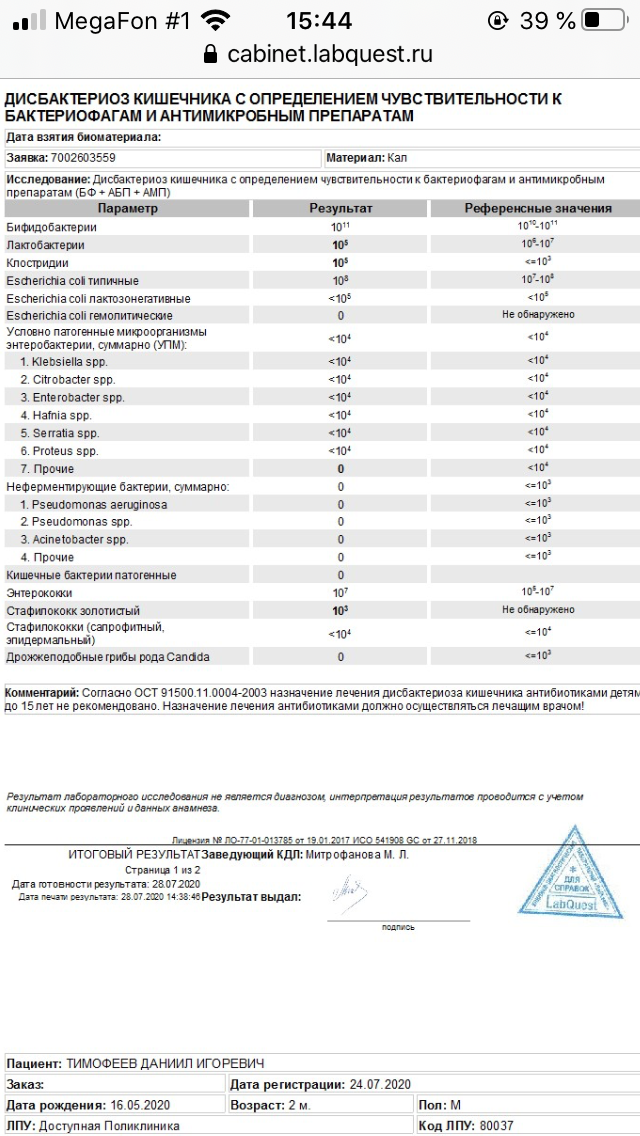 1% в случаях до приобретения колонизации S. aureus (средняя разница, 22,5%; 95% ДИ, от -0,89% до 45,81%; P = 0,03 по сумме рангов Уилкоксона со знаком). В момент времени = +7 у случаев также была более высокая средняя относительная численность Rothia mucilaginosa , чем в контрольной группе (22,5% и 0,4% соответственно; средняя разница 22,1%; 95% ДИ от 1,8% до 42,3%; P = 0,02 по сумме рангов Уилкоксона).
1% в случаях до приобретения колонизации S. aureus (средняя разница, 22,5%; 95% ДИ, от -0,89% до 45,81%; P = 0,03 по сумме рангов Уилкоксона со знаком). В момент времени = +7 у случаев также была более высокая средняя относительная численность Rothia mucilaginosa , чем в контрольной группе (22,5% и 0,4% соответственно; средняя разница 22,1%; 95% ДИ от 1,8% до 42,3%; P = 0,02 по сумме рангов Уилкоксона). 2). В целом, 136 видов были по-разному распространены (с поправкой на FDR P <0,05) между случаями и контролем.Контрольная группа имела значительно более высокую среднюю относительную численность нескольких видов Corynebacterium , включая C. propinquum/pseudodiphtheriticum , C. accolens/fastidiosum и C. simulans/striatum . Стрептококки Viridans, в том числе Streptococcus salivarius/vestibularis , Streptococcus lactarius и Streptococcus oralis, , были значительно более распространены в контроле, чем в случаях. Контрольная группа также имела более высокую среднюю относительную численность Dolosigranulum pigrum , грамположительного кокка, который часто обитает в дыхательных путях.Случаи имели более высокую среднюю численность патобионтов, таких как Pseudomonas aeruginosa , Haemophilus influenzae и Corynebacterium diphtheria e, за неделю до приобретения колонизации S.
2). В целом, 136 видов были по-разному распространены (с поправкой на FDR P <0,05) между случаями и контролем.Контрольная группа имела значительно более высокую среднюю относительную численность нескольких видов Corynebacterium , включая C. propinquum/pseudodiphtheriticum , C. accolens/fastidiosum и C. simulans/striatum . Стрептококки Viridans, в том числе Streptococcus salivarius/vestibularis , Streptococcus lactarius и Streptococcus oralis, , были значительно более распространены в контроле, чем в случаях. Контрольная группа также имела более высокую среднюю относительную численность Dolosigranulum pigrum , грамположительного кокка, который часто обитает в дыхательных путях.Случаи имели более высокую среднюю численность патобионтов, таких как Pseudomonas aeruginosa , Haemophilus influenzae и Corynebacterium diphtheria e, за неделю до приобретения колонизации S. aureus .
aureus . 3). Обсуждаются только избранные пути, связанные с синтезом антимикробных веществ, включая антибиотики группы ванкомицина, поскольку связь других функциональных путей с приспособленностью бактерий остается неясной. В контроле средняя доля предполагаемых генов, участвующих в синтезе определенных противомикробных соединений, включая стрептомицин, антибиотики группы ванкомицина и поликетидные сахара, многие из которых обладают противомикробной активностью, была выше, чем в случаях.Относительное обилие генов, участвующих в синтезе этих антимикробных соединений, в случаях после лечения мупироцином (время = +7) было значительно выше, чем в случаях до лечения (время = –7), и было сходно с контролем (время = +7). .
3). Обсуждаются только избранные пути, связанные с синтезом антимикробных веществ, включая антибиотики группы ванкомицина, поскольку связь других функциональных путей с приспособленностью бактерий остается неясной. В контроле средняя доля предполагаемых генов, участвующих в синтезе определенных противомикробных соединений, включая стрептомицин, антибиотики группы ванкомицина и поликетидные сахара, многие из которых обладают противомикробной активностью, была выше, чем в случаях.Относительное обилие генов, участвующих в синтезе этих антимикробных соединений, в случаях после лечения мупироцином (время = +7) было значительно выше, чем в случаях до лечения (время = –7), и было сходно с контролем (время = +7). . aureus (контрольная группа) в момент времени = -7, и случаи после лечения в момент времени = +7.
aureus (контрольная группа) в момент времени = -7, и случаи после лечения в момент времени = +7. Эти воздействия, наряду с толерантностью неонатальной иммунной системы, приводят к высокой индивидуальной и временной изменчивости резидентных бактерий [17, 18].Хотя мы показываем, что микробиота новорожденных менялась с течением времени, межиндивидуальные вариации играли доминирующую роль в определении состава микробного сообщества, что может указывать на то, что у младенцев развивается отчетливая назальная микробиота в первые недели жизни. Наши результаты показывают, что антагонистические отношения между S. aureus и потенциально защитными комменсалами могут способствовать резистентности к колонизации S. aureus у некоторых госпитализированных новорожденных, несмотря на воздействие окружающей среды и зависящую от времени изменчивость.
Эти воздействия, наряду с толерантностью неонатальной иммунной системы, приводят к высокой индивидуальной и временной изменчивости резидентных бактерий [17, 18].Хотя мы показываем, что микробиота новорожденных менялась с течением времени, межиндивидуальные вариации играли доминирующую роль в определении состава микробного сообщества, что может указывать на то, что у младенцев развивается отчетливая назальная микробиота в первые недели жизни. Наши результаты показывают, что антагонистические отношения между S. aureus и потенциально защитными комменсалами могут способствовать резистентности к колонизации S. aureus у некоторых госпитализированных новорожденных, несмотря на воздействие окружающей среды и зависящую от времени изменчивость. Относительная численность D. pigrum отрицательно связана с вероятностью колонизации S. aureus у взрослых, что предполагает антагонистические отношения между двумя микроорганизмами. D. pigrum сам по себе не превосходит S.aureus , но часто колонизирует носовую полость совместно с некоторыми видами Corynebacterium . Мы обнаружили, что эта взаимосвязь может также существовать у госпитализированных новорожденных, поскольку контрольная группа также была более обогащена видами Corynebacterium , включая C. propinquum/pseudodiphtheriticum , C. simulans/striatum, и C. accolens/fastidiosum. Было показано, что виды Nondiphtheriae Corynebacterium устраняют колонизацию носа S. aureus в исследованиях на взрослых, хотя механизмы, лежащие в основе этих взаимодействий, остаются неясными [20].Стрептококки группы Viridans, которые продемонстрировали способность элиминировать S. aureus посредством образования перекиси водорода, также были более многочисленны в контроле, чем в случаях [21].
Относительная численность D. pigrum отрицательно связана с вероятностью колонизации S. aureus у взрослых, что предполагает антагонистические отношения между двумя микроорганизмами. D. pigrum сам по себе не превосходит S.aureus , но часто колонизирует носовую полость совместно с некоторыми видами Corynebacterium . Мы обнаружили, что эта взаимосвязь может также существовать у госпитализированных новорожденных, поскольку контрольная группа также была более обогащена видами Corynebacterium , включая C. propinquum/pseudodiphtheriticum , C. simulans/striatum, и C. accolens/fastidiosum. Было показано, что виды Nondiphtheriae Corynebacterium устраняют колонизацию носа S. aureus в исследованиях на взрослых, хотя механизмы, лежащие в основе этих взаимодействий, остаются неясными [20].Стрептококки группы Viridans, которые продемонстрировали способность элиминировать S. aureus посредством образования перекиси водорода, также были более многочисленны в контроле, чем в случаях [21].
 aureus препятствует выживанию более разнообразных сообществ.Было показано, что виды Corynebacterium изменяют экспрессию генов, ограничивая рост S. aureus , снижая приспособленность и ослабляя вирулентность, что позволяет предположить, что более высокая относительная численность недифтерийных коринебактерий могла ограничивать численность S. aureus в контрольной группе [ 4].
aureus препятствует выживанию более разнообразных сообществ.Было показано, что виды Corynebacterium изменяют экспрессию генов, ограничивая рост S. aureus , снижая приспособленность и ослабляя вирулентность, что позволяет предположить, что более высокая относительная численность недифтерийных коринебактерий могла ограничивать численность S. aureus в контрольной группе [ 4]. aureus в других анатомических участках. Bacillus subtilis и Staphylococcus caprae продуцируют пептиды, которые мешают опосредованному agr ощущению кворума, необходимому для S.aureus и, как было показано, ингибирует кишечную и кожную колонизацию S. aureus соответственно [22, 23]. Подобный механизм служит одним из многих бактериальных взаимодействий, которые ограничивают рост S. aureus в ноздрях.
aureus в других анатомических участках. Bacillus subtilis и Staphylococcus caprae продуцируют пептиды, которые мешают опосредованному agr ощущению кворума, необходимому для S.aureus и, как было показано, ингибирует кишечную и кожную колонизацию S. aureus соответственно [22, 23]. Подобный механизм служит одним из многих бактериальных взаимодействий, которые ограничивают рост S. aureus в ноздрях. aureus , которые в значительной степени согласуются с предыдущими исследованиями. В контрольной группе было больше таксонов бактерий, которые, как было показано, противодействуют S. aureus либо напрямую, либо путем отбора соколонизаторов, поддерживающих стабильную во времени и разнообразную микробиоту.Эти результаты подтверждают предположения о роли кандидатов в комменсалы в повышении устойчивости к колонизации S. aureus . Необходимы дальнейшие исследования, чтобы лучше установить идентичность и роль защитных видов и их бактериальных пептидов в развивающейся назальной микробиоте госпитализированных младенцев с высоким риском инвазивных инфекций S. aureus .
aureus , которые в значительной степени согласуются с предыдущими исследованиями. В контрольной группе было больше таксонов бактерий, которые, как было показано, противодействуют S. aureus либо напрямую, либо путем отбора соколонизаторов, поддерживающих стабильную во времени и разнообразную микробиоту.Эти результаты подтверждают предположения о роли кандидатов в комменсалы в повышении устойчивости к колонизации S. aureus . Необходимы дальнейшие исследования, чтобы лучше установить идентичность и роль защитных видов и их бактериальных пептидов в развивающейся назальной микробиоте госпитализированных младенцев с высоким риском инвазивных инфекций S. aureus .
 ; Сан-Диего, Калифорния.
; Сан-Диего, Калифорния.