Как проявляется ротавирусная инфекция у детей: ᐈ Ротавирус: симптомы, лечение ~【Киев】
Ротавирус по прозвищу «Кишечный грипп». Как уберечь ребенка от такой компании?
Ротавирусная инфекция — инфекционное заболевание, которое проявляется сочетанием кишечного и респираторного синдрома. Вызывается эта инфекция ротавирусом из семейства реовирусов. Чаще ротавирусная инфекция встречается у детей, заражению особенно подвержены дети от 6 месяцев до 5 лет.
Сезонность у этой инфекции зимне-весенний период, но спорадические вспышки регистрируются на протяжении всего года. Для данной инфекции характерна высокая контагиозность.
Ротавирус также преследует нас на морских курортах. Отели, бассейны и другие места скопления людей – среда, которая способствует его быстрому распространению.
Симптомами ротавируса чаще бывают:
Особенно опасен недуг для детей младшего возраста, так как у них часто развиваются осложнения в виде обезвоживания, сердечно-сосудистой и почечной недостаточности, наиболее частым осложнением после перенесенной инфекции являются дисбактериоз кишечника, гастрит, энтероколит.
При ротавирусной инфекции важна ранняя диагностика и своевременно начатая терапия — этиотропное, патогенетическое, симптоматическое лечение.
Профилактика ротавирусной инфекции включает в себя:
-
соблюдение правил личной гигиены
-
раннее выявление и изоляция заболевшего
-
мероприятия в очаге инфекции.
Еще одна превентивная мера — вакцинация против ротавирусной инфекции.
Вакцинацию от ротавирусной инфекции можно начинать детям с 6-недельного возраста. Первую вакцину ребенок должен получить в возрасте от 6 недель до 3 месяцев. Вакцинация проводится трехкратно, с интервалом в 1 месяц. Если по каким-либо причинам интервалы между вакцинациями увеличиваются, то последнюю, третью вакцинацию, желательно провести не позднее 8-месячного возраста.
В нашей клинике применяется вакцина РотаТек (Merck), которая защищает от 5-ти самых опасных типов ротавируса.
Перед вакцинацией врач-педиатр проводит обязательный профилактический осмотр ребенка.
Ротавирус: избежать опасного недуга поможет вакцинация
Одно из наиболее распространенных детских заболеваний — ротавирусная инфекция. Каждый ребенок как минимум один раз в жизни сталкивался с ней. Из-за особенностей формирования иммунитета дети до двух лет, как правило, переносят болезнь в более тяжелой форме. В 2020 году в Москве заболевание только лабораторно было подтверждено у 2 744 детей, 1 415 (52%) из них — дети в возрасте 1-2 лет. Истинная распространенность значительно выше.
О лечении и профилактике недуга рассказывает Алексей Ртищев, врач-инфекционист Морозовской детской больницы, к. м. н., доцент кафедры инфекционных болезней у детей РНИМУ им. Н. И. Пирогова.
Что представляет собой ротавирусная инфекция?
Ротавирусная инфекция, или как ее еще называют кишечный грипп, — очень заразное инфекционное заболевание пищеварительного тракта. Заражение происходит через грязные руки, инфицированные пищевые продукты или воду. Основной пик заболеваемости приходится на зимние месяцы, но риски инфицирования остаются высокими в течение всего года. В мире циркулирует порядка 50 комбинаций различных штаммов ротавируса, но почти все случаи заражения приходятся на пять основных. Ротавирусная инфекция по распространенности среди детей сравнима с ветряной оспой, и при отсутствии вакцинации с ней справиться сложно.
Заражение происходит через грязные руки, инфицированные пищевые продукты или воду. Основной пик заболеваемости приходится на зимние месяцы, но риски инфицирования остаются высокими в течение всего года. В мире циркулирует порядка 50 комбинаций различных штаммов ротавируса, но почти все случаи заражения приходятся на пять основных. Ротавирусная инфекция по распространенности среди детей сравнима с ветряной оспой, и при отсутствии вакцинации с ней справиться сложно.
Как проявляется болезнь?
Заболевание начинается резко, обычно с высокой температуры. В течение первых часов, а иногда суток, сопровождается многократной рвотой. К концу первых суток присоединяется диарея. Ротавирусная инфекция, как правило, сопровождается явлениями метеоризма, но каких-либо специфических симптомов, отличающих её от других кишечных инфекций, нет. Поэтому диагноз окончательно устанавливается только по результатам лабораторного исследования кала.
Для кого заболевание наиболее опасно?
Тяжелее всего ротавирусную инфекцию переносят дети до двух лет.
Как лечится ротавирусная инфекция?
Главная цель лечения — борьба с интоксикацией и обезвоживанием организма. Решение о назначении дополнительной лекарственной терапии принимает врач после оценки состояния пациента. С начала первых признаков заболевания рекомендовано полноценное и своевременное восполнение жидкости. Ребенка нужно выпаивать дробно: небольшими порциями и небольшими глотками. Подойдут чай, вода, специальные солевые растворы.
Какие меры профилактики наиболее эффективны?
Единственным эффективным способом профилактики ротавирусной инфекции является иммунизация. Ротавирусная вакцина активно применяется в мире с 2008 года, сейчас она включена в календари прививок 112 стран. В Москве с ноября 2019 года вакцинация от ротавирусной инфекции всех детей раннего возраста включена в региональный календарь детских профилактических прививок. В настоящее время безопасность и эффективность такой иммунизации доказана в крупных мировых исследованиях, в которых приняли участие около 70 000 детей. Вакцина содержит пять основных наиболее распространенных штаммов ротавируса и формирует широкий иммунитет к заболеванию.
как она проявляется, как проводится методы диагностики и терапия
Ротавирусная инфекция у ребенка иногда становится настоящим «испытанием на прочность» детей и родителей: она настолько тяжело переносится и сопровождается появлением нескольких отягощающих ее синдромов, что иногда сложно понять, с чего начинать лечение.
Появляется заболевание обычно у детей младшей возрастной группы, тяжелее переносится малышами 1-3-летнего возраста. Передается вирус через грязные руки, при употреблении пищи из одной посуды с больным, при игре одними игрушками, после которых не моются руки. Можно заразиться при употреблении некипяченой воды, реже – молочных продуктов.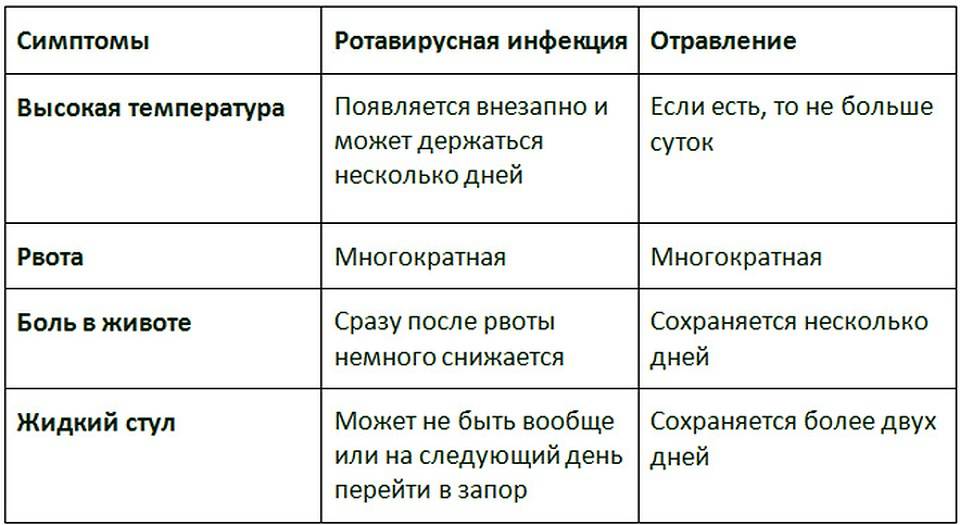 Особо опасны в качестве «распространителей» взрослые: они почти не болеют или их болезнь проявляется только в катаральных явлениях, зато вирус они активно распространяют в окружающую среду. Также достаточно просто заразиться от ребенка или взрослого, у которого понос не особо выражен, но вирус в окружающую среду выделяется с фекалиями до двух месяцев и больше.
Особо опасны в качестве «распространителей» взрослые: они почти не болеют или их болезнь проявляется только в катаральных явлениях, зато вирус они активно распространяют в окружающую среду. Также достаточно просто заразиться от ребенка или взрослого, у которого понос не особо выражен, но вирус в окружающую среду выделяется с фекалиями до двух месяцев и больше.
Ротавирусная инфекция у ребенка проявляется после достаточно короткого инкубационного периода от 12 часов до 2 дней.
У большинства детей болезнь начинается так:
- повышается температура тела, обычно — до высоких показателей, которую довольно трудно сбить;
- появляется насморк, могут быть покраснение и боль в горле;
- головная боль, отказ от еды, слабость;
- возникает рвота, которая повторяется 2-3 раза за несколько часов, потом становится реже;
- появляется понос: стул обычной окраски, жидкий, зловонный, часто – пенистый, иногда с небольшой примесью крови. Когда развивается ротавирусная инфекция у ребенка, стул может отмечаться до 20 и более раз в сутки, приводя без правильной терапии к довольно быстрому обезвоживанию организма.

Возможно разное сочетание симптомов и появление их по времени. Так, первыми признаками болезни могут стать насморк и кашель, потом развиваются рвота и понос. Заболевание может протекать только с рвотой и вовсе без катаральных явлений; понос может быть разной частоты (от 3-4 до 20-30 раз в сутки) и длительности (2-3 дня или дольше). Возможно развитие рецидива болезни, когда состояние малыша только начало нормализовываться, но вдруг опять повышается температура, появляется рвота или понос. Поэтому важно лечить болезнь вместе с врачом-инфекционистом, соблюдать все его рекомендации и не спешить расширять диету.
Как ставится диагноз? Возможно ли провести диагностику в домашних условиях?
Анализ на ротавирусную инфекцию можно сделать и дома. Это поможет вам отличить ее от бактериальной кишечной инфекции. Для этого в аптеке нужно купить «Cito Rota Test» (рота-тест) и выполнить его согласно инструкции, взяв немного кала ребенка из чистого горшка, в котором он не смешался с мочой. Две полоски укажут, что у ребенка имеет место ротавирусная инфекция.
Две полоски укажут, что у ребенка имеет место ротавирусная инфекция.
Что делать, если развилась ротавирусная инфекция у ребенка?
- Не паниковать, обратиться к инфекционисту.
- Купить в аптеке: «Ацетон-тест», свечи «Лаферобион» по 500 тысяч единиц (для детей старше 2 лет) или по 125 единиц – для тех, кто младше, около 10 пакетиков «Хумана электролит», несколько пакетиков «Смекты» или «Белый уголь» в порошке, «Бифилакт-Экстра» — 1-2 пластинки или упаковку «Энтерожермины», свечи «Цефекон» и сироп «Нурофен» или «Эффералган».
- Активно выпаивать ребенка. Он должен выпивать не менее своей суточной нормы (например, для ребенка весом 10 кг – это около 1 л жидкости) плюс ему надо дать ту жидкость, которую он уже потерял с поносом, рвотой и температурой, плюс ту, которую он продолжает терять.
Выпаивать нужно рисовым отваром, водой, в которой растворен «Хумана электролит», отваром ромашки. В день также желательно давать до 50 мл «Боржоми», из которой предварительно выпущен газ.
- «Смекта» или «Уголь» — в возрастной дозировке 4-5 раз в день.
- Свечи «Лаферобион» или «Виферон» — в прямую кишку в возрастной дозировке.
- Активно измеряем ацетон в моче и следим за ее количеством. Мочи должно быть не меньше, чем 2 мл/кг/час, а уровень кетоновых тел, проверенный лакмусовой бумажкой из «Ацетон-теста» — на один «+» или «0».
- Температуру сбиваем свечами «Цефекон» (или «Эффералган»), сиропом, обтиранием прохладной водой со спиртом. При этом важно следить за тем, чтобы вы не превысили суточную дозировку препарата.
Если вы видите, что:
- ребенок сонлив;
- теряет очень много жидкости с поносом или рвотой;
- вы не можете снизить температуру;
- выпоить малыша невозможно из-за постоянной рвоты;
- ацетон мочи больше «+»;
- были судорожные подергивания конечностей, —
вызывайте «Скорую помощь» и езжайте в инфекционный стационар.
Те мамы, у детей которых была ротавирусная инфекция, отзывы оставляют довольно негативные: очень небольшое количество родителей смогли справиться дома с болезнью, многим понадобилась госпитализация, некоторые дети на 1-3 дня попали в отделение интенсивной терапии. Учитывая все это, хочется сказать: увидев понос у малыша, сделайте рота-тест. Если он положителен, не ждите осложнений, ложитесь в инфекционную больницу, будет ребенок хорошо себя чувствовать – уйдете, вас никто держать не будет. Зато вы получите врачебную помощь и будете предупреждены о том, на что в следующий раз обращать внимание в первую очередь.
Учитывая все это, хочется сказать: увидев понос у малыша, сделайте рота-тест. Если он положителен, не ждите осложнений, ложитесь в инфекционную больницу, будет ребенок хорошо себя чувствовать – уйдете, вас никто держать не будет. Зато вы получите врачебную помощь и будете предупреждены о том, на что в следующий раз обращать внимание в первую очередь.
Патогенез кишечной и системной ротавирусной инфекции
1. Adams, W.R., and L.M. Kraft. 1963. Эпизоотические диареи мышей-детенышей: идентификация этиологического агента. Наука 141 : 359-360. [PubMed] [Google Scholar]2. Энджел, Дж., Б. Тан, Н. Фэн, Х. Б. Гринберг и Д. Басс. 1998. Изучение роли NSP4 в патогенезе гомологичной мышиной ротавирусной диареи. Дж. Заразить. Дис. 177 : 455-458. [PubMed] [Google Scholar]3. Болл, Дж. М., П. Тиан, К. Кью. Цзэн, А. П. Моррис и М. К. Эстес. 1996. Возрастная диарея, вызванная неструктурным гликопротеином ротавируса. Наука 272 : 101-104. [PubMed] [Google Scholar]4. Blutt, S.E., C.D. Kirkwood, V. Parreno, K.L. Warfield, M. Ciarlet, M.K. Estes, K. Bok, R.F. Bishop и M.E. Conner. 2003. Ротавирусная антигенемия и виремия: обычное явление? Ланцет 362 : 1445-1449. [PubMed] [Google Scholar]5. Брум, Р.Л., П. Т. Во, Р. Л. Уорд, Х. Ф. Кларк и Х. Б. Гринберг. 1993. Гены мышиного ротавируса, кодирующие белки внешнего капсида VP4 и VP7, не являются основными детерминантами ограничения круга хозяев и вирулентности. Дж. Вирол. 67 : 2448-2455. [Бесплатная статья PMC] [PubMed] [Google Scholar]6. Brunet, J.P., J. Cotte-Laffitte, C. Linxe, A.M. Quero, M. Geniteau-Legendre и A.L. Servin. 2000. Ротавирусная инфекция вызывает повышение концентрации внутриклеточного кальция в эпителиальных клетках кишечника человека: роль в изменении актина микроворсинок.Дж. Вирол. 74 : 2323-2332. [Бесплатная статья PMC] [PubMed] [Google Scholar]7.
Наука 272 : 101-104. [PubMed] [Google Scholar]4. Blutt, S.E., C.D. Kirkwood, V. Parreno, K.L. Warfield, M. Ciarlet, M.K. Estes, K. Bok, R.F. Bishop и M.E. Conner. 2003. Ротавирусная антигенемия и виремия: обычное явление? Ланцет 362 : 1445-1449. [PubMed] [Google Scholar]5. Брум, Р.Л., П. Т. Во, Р. Л. Уорд, Х. Ф. Кларк и Х. Б. Гринберг. 1993. Гены мышиного ротавируса, кодирующие белки внешнего капсида VP4 и VP7, не являются основными детерминантами ограничения круга хозяев и вирулентности. Дж. Вирол. 67 : 2448-2455. [Бесплатная статья PMC] [PubMed] [Google Scholar]6. Brunet, J.P., J. Cotte-Laffitte, C. Linxe, A.M. Quero, M. Geniteau-Legendre и A.L. Servin. 2000. Ротавирусная инфекция вызывает повышение концентрации внутриклеточного кальция в эпителиальных клетках кишечника человека: роль в изменении актина микроворсинок.Дж. Вирол. 74 : 2323-2332. [Бесплатная статья PMC] [PubMed] [Google Scholar]7. Brunet, J.P., N. Jourdan, J. Cotte-Laffitte, C. Linxe, M. Geniteau-Legendre, A.L. Servin и AM Quero. 2000. Ротавирусная инфекция вызывает дезорганизацию цитоскелета в эпителиальных клетках кишечника человека: значение увеличения внутриклеточной концентрации кальция. Дж. Вирол. 74 : 10801-10806. [Бесплатная статья PMC] [PubMed] [Google Scholar]8. Карлсон, Дж. А., П. Дж. Миддлтон, М.Т. Шимански, Дж. Хубер и М. Петрич. 1978. Смертельный ротавирусный гастроэнтерит: анализ 21 случая. Являюсь. Дж. Дис. Ребенок. 132 : 477-479. [PubMed] [Google Scholar]9. Касола, А., М.К. Эстес, С.Е. Кроуфорд, П.Л. Огра, П.Б. Эрнст, Р.П. Гарфало и С.Е. Кроу. 1998. Ротавирусная инфекция культивируемых эпителиальных клеток кишечника индуцирует секрецию хемокинов СХС и СС. Гастроэнтерология 114 : 947-955. [PubMed] [Google Scholar] 10. Кристи, И. Л., Б. М. Тоттерделл и Дж. Э. Банатвала. 1978.
Brunet, J.P., N. Jourdan, J. Cotte-Laffitte, C. Linxe, M. Geniteau-Legendre, A.L. Servin и AM Quero. 2000. Ротавирусная инфекция вызывает дезорганизацию цитоскелета в эпителиальных клетках кишечника человека: значение увеличения внутриклеточной концентрации кальция. Дж. Вирол. 74 : 10801-10806. [Бесплатная статья PMC] [PubMed] [Google Scholar]8. Карлсон, Дж. А., П. Дж. Миддлтон, М.Т. Шимански, Дж. Хубер и М. Петрич. 1978. Смертельный ротавирусный гастроэнтерит: анализ 21 случая. Являюсь. Дж. Дис. Ребенок. 132 : 477-479. [PubMed] [Google Scholar]9. Касола, А., М.К. Эстес, С.Е. Кроуфорд, П.Л. Огра, П.Б. Эрнст, Р.П. Гарфало и С.Е. Кроу. 1998. Ротавирусная инфекция культивируемых эпителиальных клеток кишечника индуцирует секрецию хемокинов СХС и СС. Гастроэнтерология 114 : 947-955. [PubMed] [Google Scholar] 10. Кристи, И. Л., Б. М. Тоттерделл и Дж. Э. Банатвала. 1978. Бессимптомная эндемическая ротавирусная инфекция новорожденных. Ланцет i : 1176-1178. [Бесплатная статья PMC] [PubMed] [Google Scholar]11. Чок, А. М. и Г. Дж. Нуово. 2002. Гистологические и in situ вирусные находки в миокарде в случаях внезапной неожиданной смерти. Мод. Патол. 9 : 914-922. [PubMed] [Google Scholar] 12. Коллинз, Дж., В. Г. Старки, Т. С. Уоллис, Г. Дж. Кларк, К. Дж. Уортон, А. Дж. Спенсер, С. Дж.Хэддон, член парламента Осборн, К. Д. Кэнди и Дж. Стивен. 1988. Профили кишечных ферментов у нормальных и ротавирус-инфицированных мышей. Дж. Педиатр. Гастроэнтерол. Нутр. 7 : 264-272. [PubMed] [Google Scholar]
Бессимптомная эндемическая ротавирусная инфекция новорожденных. Ланцет i : 1176-1178. [Бесплатная статья PMC] [PubMed] [Google Scholar]11. Чок, А. М. и Г. Дж. Нуово. 2002. Гистологические и in situ вирусные находки в миокарде в случаях внезапной неожиданной смерти. Мод. Патол. 9 : 914-922. [PubMed] [Google Scholar] 12. Коллинз, Дж., В. Г. Старки, Т. С. Уоллис, Г. Дж. Кларк, К. Дж. Уортон, А. Дж. Спенсер, С. Дж.Хэддон, член парламента Осборн, К. Д. Кэнди и Дж. Стивен. 1988. Профили кишечных ферментов у нормальных и ротавирус-инфицированных мышей. Дж. Педиатр. Гастроэнтерол. Нутр. 7 : 264-272. [PubMed] [Google Scholar]13. Conner, ME, and R. F. Ramig. 1997. Вирусные кишечные заболевания, с. 713-743. В Н. Натансон (ред.), Вирусный патогенез. Lippincott-Raven Publishers, Philadelphia, Pa.
14. Coulson, B.S., P.D. Witterick, Y. Tan, M.J. Hewish, J.N. Mountford, L. К. Харрисон и М.К. Ханиман. 2002. Рост ротавирусов в первичных клетках поджелудочной железы. Дж. Вирол. 76 : 9537-9544. [Бесплатная статья PMC] [PubMed] [Google Scholar]15. Чех-Шмидт, Г., В. Верхаген, П. Шавай, Дж. Леонхардт и К. Петерсен. 2001. Иммунологический пробел в инфекционной животной модели билиарной атрезии. Дж. Сур. Рез. 101 : 62-67. [PubMed] [Google Scholar] 16. Дэвидсон, Г. П., Д. Г. Галл, М. Петрик, Д. Г. Батлер и Дж. Р. Гамильтон. 1977.Ротавирусный энтерит человека, индуцированный у обычных поросят: структура кишечника и транспорт. Дж. Клин. расследование 60 : 1402-1409. [Бесплатная статья PMC] [PubMed] [Google Scholar]17. дель Кастильо, Дж. Р., Дж. Э. Людерт, А. Санчес, М. К. Руис, Ф. Микеланджели и Ф. Липранди. 1991. Ротавирусная инфекция изменяет гомеостаз Na + и K + в клетках МА104. Дж. Генерал Вирол. 72 : 541-547.
К. Харрисон и М.К. Ханиман. 2002. Рост ротавирусов в первичных клетках поджелудочной железы. Дж. Вирол. 76 : 9537-9544. [Бесплатная статья PMC] [PubMed] [Google Scholar]15. Чех-Шмидт, Г., В. Верхаген, П. Шавай, Дж. Леонхардт и К. Петерсен. 2001. Иммунологический пробел в инфекционной животной модели билиарной атрезии. Дж. Сур. Рез. 101 : 62-67. [PubMed] [Google Scholar] 16. Дэвидсон, Г. П., Д. Г. Галл, М. Петрик, Д. Г. Батлер и Дж. Р. Гамильтон. 1977.Ротавирусный энтерит человека, индуцированный у обычных поросят: структура кишечника и транспорт. Дж. Клин. расследование 60 : 1402-1409. [Бесплатная статья PMC] [PubMed] [Google Scholar]17. дель Кастильо, Дж. Р., Дж. Э. Людерт, А. Санчес, М. К. Руис, Ф. Микеланджели и Ф. Липранди. 1991. Ротавирусная инфекция изменяет гомеостаз Na + и K + в клетках МА104. Дж. Генерал Вирол. 72 : 541-547. [PubMed] [Google Scholar] 18. Дикман, К. Г., С. Дж. Мемпсон, Дж.Андерсон, С. Липпе, Л. Шао и Р. Д. Шоу. 2000. Ротавирус изменяет парацеллюлярную проницаемость и энергетический обмен в клетках Caco-2. Являюсь. Дж. Физиол. 279 : G757-G766. [PubMed] [Google Scholar] 19. Донг Ю., К. К. Цзэн, Дж. М. Болл, М. К. Эсте и А. П. Моррис. 1997. Ротавирусный энтеротоксин NSP4 мобилизует внутриклеточный кальций в клетках кишечника человека, стимулируя опосредованную фосфолипазой С продукцию инозитол-1,4,5-трифосфата. проц. Натл. акад. науч. США 94 : 3960-3965.[Бесплатная статья PMC] [PubMed] [Google Scholar]20. Ebert, E. 1995. Интраэпителиальные лимфоциты кишечника человека обладают мощной хемотаксической активностью. Гастроэнтерология 109 : 1154-1159. [PubMed] [Google Scholar]
[PubMed] [Google Scholar] 18. Дикман, К. Г., С. Дж. Мемпсон, Дж.Андерсон, С. Липпе, Л. Шао и Р. Д. Шоу. 2000. Ротавирус изменяет парацеллюлярную проницаемость и энергетический обмен в клетках Caco-2. Являюсь. Дж. Физиол. 279 : G757-G766. [PubMed] [Google Scholar] 19. Донг Ю., К. К. Цзэн, Дж. М. Болл, М. К. Эсте и А. П. Моррис. 1997. Ротавирусный энтеротоксин NSP4 мобилизует внутриклеточный кальций в клетках кишечника человека, стимулируя опосредованную фосфолипазой С продукцию инозитол-1,4,5-трифосфата. проц. Натл. акад. науч. США 94 : 3960-3965.[Бесплатная статья PMC] [PubMed] [Google Scholar]20. Ebert, E. 1995. Интраэпителиальные лимфоциты кишечника человека обладают мощной хемотаксической активностью. Гастроэнтерология 109 : 1154-1159. [PubMed] [Google Scholar] 21. Эстес, М. К., Г. Канг, С. К. Цзэн, С. Э. Кроуфорд и М. Сиарлет. 2001. Патогенез ротавирусного гастроэнтерита, с. 82-96. В Д. Дж. Чедвик и Дж. А. Гуд, (ред.), Вирусы гастроэнтерита. Симпозиум Novartis Foundation 238. John Wiley & Sons, Inc., New York, NY
82-96. В Д. Дж. Чедвик и Дж. А. Гуд, (ред.), Вирусы гастроэнтерита. Симпозиум Novartis Foundation 238. John Wiley & Sons, Inc., New York, NY
22. Estes, M.K. 2003. Ротавирусный энтеротоксин NSP4: текущее состояние и проблемы, с. 207-224. В У. Дессельбергер и Дж. Грей (ред.), Вирусный гастроэнтерит. Elsevier Science BV, Амстердам, Нидерланды.
23. Эстес, М. К. и А. П. Моррис. 1999. Вирусный энтеротоксин: новый механизм вирусиндуцированного патогенеза, с. 73-82. В П. С. Пол и Д. Х. Фрэнсис (ред.), Механизмы патогенеза кишечных заболеваний 2.Kluwer Academic/Plenum Publishers, New York, NY
24. Flores, J., K. Midthun, Y. Hoshino, K. Green, M. Gorziglia, A.Z. Kapikian и R.M. Chanock. 1986. Сохранение четвертого гена среди ротавирусов, выделенных от бессимптомных новорожденных, и его возможная роль в аттенуации. Дж. Вирол. 60 : 972-979. [Бесплатная статья PMC] [PubMed] [Google Scholar]25. Gershon, MD 1999. Энтеральная нервная система: второй мозг. Хосп. Практика. 34 : 31-39.[PubMed] [Google Scholar] 26. Gilger, M.A., D.O. Matson, M.E. Conner, H.M. Rosenblatt, M.J. Finegold и M.K. Estes. 1992. Внекишечные ротавирусные инфекции у детей с иммунодефицитом. Дж. Педиатр. 120 : 912-917. [PubMed] [Google Scholar]
Gershon, MD 1999. Энтеральная нервная система: второй мозг. Хосп. Практика. 34 : 31-39.[PubMed] [Google Scholar] 26. Gilger, M.A., D.O. Matson, M.E. Conner, H.M. Rosenblatt, M.J. Finegold и M.K. Estes. 1992. Внекишечные ротавирусные инфекции у детей с иммунодефицитом. Дж. Педиатр. 120 : 912-917. [PubMed] [Google Scholar]27. Грэм, Д.Ю. и М.К. Эстес. 1988. Вирусные инфекции кишечника, с. 566-578. В Г. Гитник (ред.), Гастроэнтерология. Издательство Medical Examination Publishing Company, Нью-Гайд-Парк, Нью-Йорк.
28. Graham, D.Y., J.W. Sackman, and M.K. Estes. 1984. Патогенез ротавирусной диареи: предварительные исследования на миниатюрных свиньях. Копать. Дис. науч. 29 : 1028-1035. [Бесплатная статья PMC] [PubMed] [Google Scholar]29. Гринберг, Х. Б., Х. Ф. Кларк и П. А. Оффит. 1994. Ротавирусная патология и патофизиология. Курс. Вверх. микробиол. Иммунол. 185 : 255-283. [PubMed] [Google Scholar] 30. Халайхель, Н., В. Лиевин, Ф. Альварадо и М.Вассер. 2000. Ротавирусная инфекция нарушает активность кишечной щеточной каемки Na + -solute cotransport у молодых кроликов. Являюсь. Дж. Физиол. Гастроинтест. Физиол печени. 279 : G587-G596. [PubMed] [Google Scholar] 31. Halaihel, N., V. Lievin, JM Ball, M.K. Estes, F. Alvarado и M. Vasseur. 2000. Прямое ингибирующее действие пептида ротавируса NSP4(114-135) на Na + -d-глюкозный симпортер мембраны щеточной каемки кишечника кролика. Дж.Вирол. 74 : 9464-9470. [Бесплатная статья PMC] [PubMed] [Google Scholar]32. Холл, Г. А., Дж. К. Бриджер, К. Р. Парсонс и Р. Кук. 1993. Изменение вирулентности ротавирусов: сравнение патогенеза у телят между двумя ротавирусами различной вирулентности. Вет. Патол. 30 : 223-233. [PubMed] [Google Scholar] 33.
Курс. Вверх. микробиол. Иммунол. 185 : 255-283. [PubMed] [Google Scholar] 30. Халайхель, Н., В. Лиевин, Ф. Альварадо и М.Вассер. 2000. Ротавирусная инфекция нарушает активность кишечной щеточной каемки Na + -solute cotransport у молодых кроликов. Являюсь. Дж. Физиол. Гастроинтест. Физиол печени. 279 : G587-G596. [PubMed] [Google Scholar] 31. Halaihel, N., V. Lievin, JM Ball, M.K. Estes, F. Alvarado и M. Vasseur. 2000. Прямое ингибирующее действие пептида ротавируса NSP4(114-135) на Na + -d-глюкозный симпортер мембраны щеточной каемки кишечника кролика. Дж.Вирол. 74 : 9464-9470. [Бесплатная статья PMC] [PubMed] [Google Scholar]32. Холл, Г. А., Дж. К. Бриджер, К. Р. Парсонс и Р. Кук. 1993. Изменение вирулентности ротавирусов: сравнение патогенеза у телят между двумя ротавирусами различной вирулентности. Вет. Патол. 30 : 223-233. [PubMed] [Google Scholar] 33. Журдан, Н., Ж. П. Брюне, К. Сапин, А. Бле, Ж. Котт-Лаффит, Ф. Форестье, А. М. Керо, Г. Труннан и А. Л. Сервин. 1998. Ротавирусная инфекция снижает экспрессию сахаразы-изомальтазы в эпителиальных клетках кишечника человека, нарушая нацеливание белков и организацию микроворсинчатого цитоскелета.Дж. Вирол. 72 : 7228-7236. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Журдан, Н., Ж. П. Брюне, К. Сапин, А. Бле, Ж. Котт-Лаффит, Ф. Форестье, А. М. Керо, Г. Труннан и А. Л. Сервин. 1998. Ротавирусная инфекция снижает экспрессию сахаразы-изомальтазы в эпителиальных клетках кишечника человека, нарушая нацеливание белков и организацию микроворсинчатого цитоскелета.Дж. Вирол. 72 : 7228-7236. [Бесплатная статья PMC] [PubMed] [Google Scholar]34. Капикян А. З., Ю. Хошино и Р. М. Чанок. 2001. Ротавирусы, с. 1787-1833 гг. In D.M. Knipe, P.M. Howley, D.E. Griffin, R.A. Lamb, M.A. Martin, B. Roizman, and S.E. Straus, Fields virology, 4 th ed. Lippincott Williams & Wilkins, Philadelphia, Pa.
35. Keidan, I., I. Shif, G. Keren, and JH Passwell. 1992. Ротавирусная энцефалопатия: свидетельство поражения центральной нервной системы при ротавирусной инфекции.Педиатр. Заразить. Дис. J. 11 : 773-775. [PubMed] [Google Scholar] 36. Китамото, Н. , Н. М. Маттион и М. К. Эстес. 1993. Изменения в последовательности гена 4 ротавируса человека после многократных пассажей в клетках HepG2. Арка Вирол. 130 : 179-185. [PubMed] [Google Scholar] 37. Китамото, Н., Р. Ф. Рамиг, Д. О. Мэтсон и М. К. Эстес. 1991. Сравнительный рост различных штаммов ротавируса в дифференцированных клетках (MA104, HepG2 и CaCo-2). Вирусология 184 : 729-737.[PubMed] [Google Scholar] 38. Ковач А., Л. Чан, К. Хотракитя, Г. Овертурф и Б. Портной. 1986. Повышение уровня трансаминаз в сыворотке у младенцев с ротавирусным гастроэнтеритом. Дж. Педиатр. Гастроэнтерол. Нутр. 5 : 873-877. [PubMed] [Google Scholar] 39. Kraft, LM 1958. Наблюдения за контролем и естественным течением эпидемической диареи мышей-младенцев (EDIM). Йель Дж. Биол. Мед. 31 : 121-137. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Н. М. Маттион и М. К. Эстес. 1993. Изменения в последовательности гена 4 ротавируса человека после многократных пассажей в клетках HepG2. Арка Вирол. 130 : 179-185. [PubMed] [Google Scholar] 37. Китамото, Н., Р. Ф. Рамиг, Д. О. Мэтсон и М. К. Эстес. 1991. Сравнительный рост различных штаммов ротавируса в дифференцированных клетках (MA104, HepG2 и CaCo-2). Вирусология 184 : 729-737.[PubMed] [Google Scholar] 38. Ковач А., Л. Чан, К. Хотракитя, Г. Овертурф и Б. Портной. 1986. Повышение уровня трансаминаз в сыворотке у младенцев с ротавирусным гастроэнтеритом. Дж. Педиатр. Гастроэнтерол. Нутр. 5 : 873-877. [PubMed] [Google Scholar] 39. Kraft, LM 1958. Наблюдения за контролем и естественным течением эпидемической диареи мышей-младенцев (EDIM). Йель Дж. Биол. Мед. 31 : 121-137. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Kraft, L. М. 1962. Два вируса, вызывающие диарею у мышей-детенышей, с.115-127. В Р. Дж. К. Харрис (ред.), Проблемы болезней лабораторных животных. Academic Press, New York, NY
М. 1962. Два вируса, вызывающие диарею у мышей-детенышей, с.115-127. В Р. Дж. К. Харрис (ред.), Проблемы болезней лабораторных животных. Academic Press, New York, NY
43. Lopez, S., and C. F. Arias. 2003. Прикрепляющие и постприкрепляющие рецепторы ротавируса, с.143-163. В У. Дессельбергер и Дж. Грей (ред.), Вирусный гастроэнтерит. Elsevier Science BV, Амстердам, Нидерланды.
45. Лундгрен О. и Л. Свенссон. 2003. Кишечная нервная система и инфекционная диарея, с. 51-68. В У. Дессельбергер и Дж. Грей (ред.), Вирусный гастроэнтерит. Elsevier Science BV, Амстердам, Нидерланды.
46. Лундгрен О., А. Тимар-Перегрин, К. Перссон, С. Кордасти, И. Уноо и Л. Свенссон. 2000.Роль энтеральной нервной системы в секреции жидкости и электролитов при ротавирусной диарее. Наука 287 : 491-495. [PubMed] [Google Scholar]47. Линч, М., В.-Дж. Шейх, К. Татти, Дж. Р. Генч, Т. Фереби-Харрис, Б. Цзян, Дж. Гарнер, Дж. С. Брези, М. Гринвальд, С. Каллен, Х. Д. Дэвис, К. Тревенс, С. Р. Заки и Р. И. Гласс. 2003. Патология ротавирус-ассоциированных смертей с использованием новой молекулярной диагностики. клин. Заразить. Дис. 37 : 1327-1333. [PubMed] [Google Scholar]48. Линч, М., Б. Ли, П. Азими, Дж. Генч, К. Глейзер, С. Гиллиам, Х. Г-Х. Чанг, Р. Уорд и Р. И. Гласс. 2001. Ротавирус и симптомы центральной нервной системы: причина или контаминант? Отчеты о случаях и обзор. клин. Заразить. Дис. 33 : 932-938. [PubMed] [Google Scholar]49. Микеланджели Ф., М.К. Руис, Дж. Р. дель Кастильо, Дж. Э. Людерт и Ф. Липранди. 1991. Влияние ротавирусной инфекции на внутриклеточный гомеостаз кальция в культивируемых клетках.
Уноо и Л. Свенссон. 2000.Роль энтеральной нервной системы в секреции жидкости и электролитов при ротавирусной диарее. Наука 287 : 491-495. [PubMed] [Google Scholar]47. Линч, М., В.-Дж. Шейх, К. Татти, Дж. Р. Генч, Т. Фереби-Харрис, Б. Цзян, Дж. Гарнер, Дж. С. Брези, М. Гринвальд, С. Каллен, Х. Д. Дэвис, К. Тревенс, С. Р. Заки и Р. И. Гласс. 2003. Патология ротавирус-ассоциированных смертей с использованием новой молекулярной диагностики. клин. Заразить. Дис. 37 : 1327-1333. [PubMed] [Google Scholar]48. Линч, М., Б. Ли, П. Азими, Дж. Генч, К. Глейзер, С. Гиллиам, Х. Г-Х. Чанг, Р. Уорд и Р. И. Гласс. 2001. Ротавирус и симптомы центральной нервной системы: причина или контаминант? Отчеты о случаях и обзор. клин. Заразить. Дис. 33 : 932-938. [PubMed] [Google Scholar]49. Микеланджели Ф., М.К. Руис, Дж. Р. дель Кастильо, Дж. Э. Людерт и Ф. Липранди. 1991. Влияние ротавирусной инфекции на внутриклеточный гомеостаз кальция в культивируемых клетках. Вирусология 181 : 520-527.[PubMed] [Google Scholar]
Вирусология 181 : 520-527.[PubMed] [Google Scholar]50. Микеланджели Ф. и М. К. Руис. 2003. Физиология и патофизиология кишечника в связи с вирусной диареей, с. 23-50. В У. Дессельбергер и Дж. Грей (ред.), Вирусный гастроэнтерит. Elsevier Science BV, Амстердам, Нидерланды.
51. Moon, H.W. 1994. Патофизиология вирусной диареи, с. 27-52. В Капикян А.З. (ред.), Вирусные инфекции желудочно-кишечного тракта. Марсель Деккер, Inc., Нью-Йорк.
52. Моррис А. П. и М. К. Эстес. 2001. Микробы и микробные токсины: парадигмы микробно-слизистых взаимодействий. VIII. Патологические последствия ротавирусной инфекции и ее энтеротоксина. Являюсь. Дж. Физиол. Гастроинтест. Физиол печени. 281 : G303-G310. [PubMed] [Google Scholar]53. Моррис, А. П., Дж. К. Скотт, Дж. М. Болл, К. К. Зенг, В. К. О’Нил и М. К. Эстес. 1999. NSP4 вызывает возрастную диарею, а Ca 2+ опосредует приток I — в кишечные крипты мышей CF. Являюсь. Дж. Физиол. 277 : G431-G444. [PubMed] [Google Scholar]54. Mossel, E.C., and R.F. Ramig. 2002. Сегмент 7 генома ротавируса (NSP3) является определяющим фактором внекишечного распространения у новорожденных мышей. Дж. Вирол. 76 : 6502-6509. [Бесплатная статья PMC] [PubMed] [Google Scholar]55. Mossel, E.C., and R.F. Ramig. 2003. Лимфатический механизм внекишечного распространения ротавируса у новорожденных мышей. Дж. Вирол. 77 : 12352-12356. [Бесплатная статья PMC] [PubMed] [Google Scholar]56. Нисимура С., Х. Усиджима и Х. Сираиси. 1993. Выявление ротавируса в спинномозговой жидкости и крови больных с судорогами и гастроэнтеритом методом полимеразной цепной реакции с обратной транскрипцией. Мозг Дев. 15 : 457-459. [PubMed] [Google Scholar]
Являюсь. Дж. Физиол. 277 : G431-G444. [PubMed] [Google Scholar]54. Mossel, E.C., and R.F. Ramig. 2002. Сегмент 7 генома ротавируса (NSP3) является определяющим фактором внекишечного распространения у новорожденных мышей. Дж. Вирол. 76 : 6502-6509. [Бесплатная статья PMC] [PubMed] [Google Scholar]55. Mossel, E.C., and R.F. Ramig. 2003. Лимфатический механизм внекишечного распространения ротавируса у новорожденных мышей. Дж. Вирол. 77 : 12352-12356. [Бесплатная статья PMC] [PubMed] [Google Scholar]56. Нисимура С., Х. Усиджима и Х. Сираиси. 1993. Выявление ротавируса в спинномозговой жидкости и крови больных с судорогами и гастроэнтеритом методом полимеразной цепной реакции с обратной транскрипцией. Мозг Дев. 15 : 457-459. [PubMed] [Google Scholar] 57. Оффит, П. А., Х. Ф. Кларк и Р. Л. Уорд. 2003. Текущее состояние разработки вакцин против ротавируса человека, с. 345-356. В У. Дессельбергер и Дж. Грей (ред.), Вирусный гастроэнтерит.Elsevier Science BV, Амстердам, Нидерланды.
345-356. В У. Дессельбергер и Дж. Грей (ред.), Вирусный гастроэнтерит.Elsevier Science BV, Амстердам, Нидерланды.
 Эмердж. Заразить. Дис. 9 : 565-572. [Бесплатная статья PMC] [PubMed] [Google Scholar]61. Перес, Дж. Ф., М. Э. Чемелло, Ф. Липранди, М. К. Руис и Ф. Микеланджели. 1998. Онкоз клеток МА104 индуцируется ротавирусной инфекцией за счет повышения внутриклеточной концентрации Са 2+ . Вирусология 252 : 17-27. [PubMed] [Google Scholar]
Эмердж. Заразить. Дис. 9 : 565-572. [Бесплатная статья PMC] [PubMed] [Google Scholar]61. Перес, Дж. Ф., М. Э. Чемелло, Ф. Липранди, М. К. Руис и Ф. Микеланджели. 1998. Онкоз клеток МА104 индуцируется ротавирусной инфекцией за счет повышения внутриклеточной концентрации Са 2+ . Вирусология 252 : 17-27. [PubMed] [Google Scholar]62. Poncet, D. 2003. Трансляция мРНК ротавируса в инфицированной клетке, с. 185-205. В У. Дессельбергер и Дж. Грей (ред.), Вирусный гастроэнтерит. Elsevier Science BV, Амстердам, Нидерланды.
63. Ramig, R. F. and K. L. Galle. 1990. Сегмент 4 генома ротавируса определяет фенотип репликации вируса в культивируемых клетках печени (HepG2). Дж. Вирол. 64 : 1044-1049. [Бесплатная статья PMC] [PubMed] [Google Scholar]64. Рипенхофф-Талти, М., Т. Дхаракул, Э. Ковальски, С. Михалак и П. Л. Огра. 1987. Персистирующая ротавирусная инфекция у мышей с тяжелым комбинированным иммунодефицитом. Дж. Вирол. 61 : 3345-3348. [Бесплатная статья PMC] [PubMed] [Google Scholar]65. Рипенхофф-Талти, М., В. Гувеа, М. Дж. Эванс, Л. Свенссон, Э. Хоффенберг, Р. Дж. Сокол, И. Уно, С. Дж. Гринберг, К. Шакель, Г. Жаори, Дж. Фитцджеральд, С. Чонг, М. , Эль-Юсеф, А. Немет, М. Браун, Д. Пикколи, Дж. Хайанс, Д. Раффин и Т. Росси. 1996. Выявление ротавируса группы С у детей раннего возраста с атрезией внепеченочных желчевыводящих путей. Дж. Заразить. Дис. 174 : 8-15. [PubMed] [Google Scholar]66. Ролло, Э. Э., К. П. Кумар, Н. К. Райх, Дж. Коэн, Дж. Энджел, Х. Б. Гринберг, Р. Шет, Дж.Андерсон, Б. О, С. Дж. Хемпсон, Э. Р. Макоу и Р. Д. Шоу. 1999. Ответ эпителиальных клеток на ротавирусную инфекцию. Дж. Иммунол. 163 : 4442-4452. [PubMed] [Google Scholar]67. Руис М., Дж. Коэн и Ф. Микеланджели. 2000. Роль Ca 2+ в репликации и патогенезе ротавирусной и других вирусных инфекций. Клеточный кальций 28 : 137-149.
Дж. Вирол. 61 : 3345-3348. [Бесплатная статья PMC] [PubMed] [Google Scholar]65. Рипенхофф-Талти, М., В. Гувеа, М. Дж. Эванс, Л. Свенссон, Э. Хоффенберг, Р. Дж. Сокол, И. Уно, С. Дж. Гринберг, К. Шакель, Г. Жаори, Дж. Фитцджеральд, С. Чонг, М. , Эль-Юсеф, А. Немет, М. Браун, Д. Пикколи, Дж. Хайанс, Д. Раффин и Т. Росси. 1996. Выявление ротавируса группы С у детей раннего возраста с атрезией внепеченочных желчевыводящих путей. Дж. Заразить. Дис. 174 : 8-15. [PubMed] [Google Scholar]66. Ролло, Э. Э., К. П. Кумар, Н. К. Райх, Дж. Коэн, Дж. Энджел, Х. Б. Гринберг, Р. Шет, Дж.Андерсон, Б. О, С. Дж. Хемпсон, Э. Р. Макоу и Р. Д. Шоу. 1999. Ответ эпителиальных клеток на ротавирусную инфекцию. Дж. Иммунол. 163 : 4442-4452. [PubMed] [Google Scholar]67. Руис М., Дж. Коэн и Ф. Микеланджели. 2000. Роль Ca 2+ в репликации и патогенезе ротавирусной и других вирусных инфекций. Клеточный кальций 28 : 137-149. [PubMed] [Google Scholar]68. Шоу, Р. Д., С. Дж. Хемпсон и Э. Р. Макоу. 1995. Ротавирусная диарея вызывается нереплицирующимися вирусными частицами.Дж. Вирол. 69 : 5946-5950. [Бесплатная статья PMC] [PubMed] [Google Scholar]69. Шет Р., Дж. Андерсон, Т. Сато, Б. О, С. Дж. Хемпсон, Э. Ролло, Э. Р. Макоу и Р. Д. Шоу. 1996. Ротавирус стимулирует секрецию ИЛ-8 из культивируемых эпителиальных клеток. Вирусология 221 : 251-259. [PubMed] [Google Scholar]70. Старки, У. Г., Дж. Коллинз, Т. С. Уоллис, Г. Дж. Кларк, А. Дж. Спенсер, С. Дж. Хэддон, член парламента Осборн, Д. К. Кэнди и Дж. Стивен. 1986. Кинетика, тканевая специфичность и патологические изменения при мышиной ротавирусной инфекции мышей.Дж. Генерал Вирол. 67 : 2625-2634. [PubMed] [Google Scholar]71. Steel, Р. Б. и А. Торрес-Медина. 1984. Влияние факторов окружающей среды и питания на ротавирусную инфекцию человека у гнотобиотических поросят.
[PubMed] [Google Scholar]68. Шоу, Р. Д., С. Дж. Хемпсон и Э. Р. Макоу. 1995. Ротавирусная диарея вызывается нереплицирующимися вирусными частицами.Дж. Вирол. 69 : 5946-5950. [Бесплатная статья PMC] [PubMed] [Google Scholar]69. Шет Р., Дж. Андерсон, Т. Сато, Б. О, С. Дж. Хемпсон, Э. Ролло, Э. Р. Макоу и Р. Д. Шоу. 1996. Ротавирус стимулирует секрецию ИЛ-8 из культивируемых эпителиальных клеток. Вирусология 221 : 251-259. [PubMed] [Google Scholar]70. Старки, У. Г., Дж. Коллинз, Т. С. Уоллис, Г. Дж. Кларк, А. Дж. Спенсер, С. Дж. Хэддон, член парламента Осборн, Д. К. Кэнди и Дж. Стивен. 1986. Кинетика, тканевая специфичность и патологические изменения при мышиной ротавирусной инфекции мышей.Дж. Генерал Вирол. 67 : 2625-2634. [PubMed] [Google Scholar]71. Steel, Р. Б. и А. Торрес-Медина. 1984. Влияние факторов окружающей среды и питания на ротавирусную инфекцию человека у гнотобиотических поросят. Заразить. Иммун. 43 : 906-911. [Бесплатная статья PMC] [PubMed] [Google Scholar]72. Тафазоли, Ф., К. К. Зенг, М. К. Эстес, К.-Э. Магнуссон и Л. Свенссон. 2001. Энтеротоксин ротавируса NSP4 вызывает парацеллюлярную утечку в поляризованных эпителиальных клетках. Дж.Вирол. 75 : 1540-1546. [Бесплатная статья PMC] [PubMed] [Google Scholar]73. Тянь, П., М.К. Эстес, Ю. Ху, Дж. М. Болл, К. К-Ю. Цзэн и В. П. Шиллинг. 1995. Ротавирусный неструктурный гликопротеин NSP4 мобилизует Ca 2+ из эндоплазматического ретикулума. Дж. Вирол. 69 : 5763-5772. [Бесплатная статья PMC] [PubMed] [Google Scholar]74. Тиан П., Ю. Ху, В. П. Шиллинг, Д. А. Линдсей, Дж. Эйден и М. К. Эстес. 1994. Неструктурный гликопротеин ротавируса влияет на уровень внутриклеточного кальция.Дж. Вирол. 68 : 251-257. [Бесплатная статья PMC] [PubMed] [Google Scholar]75. Уно, И., М. Рипенхофф-Талти, Т.
Заразить. Иммун. 43 : 906-911. [Бесплатная статья PMC] [PubMed] [Google Scholar]72. Тафазоли, Ф., К. К. Зенг, М. К. Эстес, К.-Э. Магнуссон и Л. Свенссон. 2001. Энтеротоксин ротавируса NSP4 вызывает парацеллюлярную утечку в поляризованных эпителиальных клетках. Дж.Вирол. 75 : 1540-1546. [Бесплатная статья PMC] [PubMed] [Google Scholar]73. Тянь, П., М.К. Эстес, Ю. Ху, Дж. М. Болл, К. К-Ю. Цзэн и В. П. Шиллинг. 1995. Ротавирусный неструктурный гликопротеин NSP4 мобилизует Ca 2+ из эндоплазматического ретикулума. Дж. Вирол. 69 : 5763-5772. [Бесплатная статья PMC] [PubMed] [Google Scholar]74. Тиан П., Ю. Ху, В. П. Шиллинг, Д. А. Линдсей, Дж. Эйден и М. К. Эстес. 1994. Неструктурный гликопротеин ротавируса влияет на уровень внутриклеточного кальция.Дж. Вирол. 68 : 251-257. [Бесплатная статья PMC] [PubMed] [Google Scholar]75. Уно, И., М. Рипенхофф-Талти, Т. Дхаракул, П. Чегас, Дж. Э. Фишер, Х. Б. Гринберг и П. Л. Огра. 1990. Внеслизистое распространение и развитие гепатита у иммунодефицитных и нормальных мышей, инфицированных ротавирусом-резусом. Дж. Вирол. 64 : 361-368. [Бесплатная статья PMC] [PubMed] [Google Scholar]76. Йолкен, Р. Х., Л. А. Петерсон, С. Л. Вондрфехт, Э. Т. Футс, К. Мидтан и Д. С. Ньюбург. 1992. Муцин грудного молока ингибирует репликацию ротавируса и предотвращает экспериментальный гастроэнтерит. Дж. Клин. расследование 90 : 1984-1991. [Бесплатная статья PMC] [PubMed] [Google Scholar]77. Чжан, М., К. К.-Ю. Цзэн, А. П. Моррис и М. К. Эстес. 2000. Функциональный пептид энтеротоксина NSP4, секретируемый из клеток, инфицированных ротавирусом. Дж. Вирол. 74 : 11663-11670. [Бесплатная статья PMC] [PubMed] [Google Scholar]78. Zijlstra, R.T., S.M. Donovan, J. Odle, H.B. Gelberg, B.В. Петшоу и Х. Р. Гаскинс. 1997.
Дхаракул, П. Чегас, Дж. Э. Фишер, Х. Б. Гринберг и П. Л. Огра. 1990. Внеслизистое распространение и развитие гепатита у иммунодефицитных и нормальных мышей, инфицированных ротавирусом-резусом. Дж. Вирол. 64 : 361-368. [Бесплатная статья PMC] [PubMed] [Google Scholar]76. Йолкен, Р. Х., Л. А. Петерсон, С. Л. Вондрфехт, Э. Т. Футс, К. Мидтан и Д. С. Ньюбург. 1992. Муцин грудного молока ингибирует репликацию ротавируса и предотвращает экспериментальный гастроэнтерит. Дж. Клин. расследование 90 : 1984-1991. [Бесплатная статья PMC] [PubMed] [Google Scholar]77. Чжан, М., К. К.-Ю. Цзэн, А. П. Моррис и М. К. Эстес. 2000. Функциональный пептид энтеротоксина NSP4, секретируемый из клеток, инфицированных ротавирусом. Дж. Вирол. 74 : 11663-11670. [Бесплатная статья PMC] [PubMed] [Google Scholar]78. Zijlstra, R.T., S.M. Donovan, J. Odle, H.B. Gelberg, B.В. Петшоу и Х. Р. Гаскинс. 1997. Белково-энергетическая недостаточность задерживает восстановление тонкого кишечника у новорожденных свиней, инфицированных ротавирусом. Дж. Нутр. 127 : 1118-1127. [PubMed] [Google Scholar]79. Zijlstra, R.T., B.A. McCracken, J. Odle, S.M. Donovan, H.B. Gelberg, B.W. Petschow, F.A. Zuckermann и H.R. Gaskins. 1999. Недоедание изменило воспалительную реакцию тонкого кишечника свиней на ротавирус. Дж. Нутр. 129 : 838-843. [PubMed] [Google Scholar]
Белково-энергетическая недостаточность задерживает восстановление тонкого кишечника у новорожденных свиней, инфицированных ротавирусом. Дж. Нутр. 127 : 1118-1127. [PubMed] [Google Scholar]79. Zijlstra, R.T., B.A. McCracken, J. Odle, S.M. Donovan, H.B. Gelberg, B.W. Petschow, F.A. Zuckermann и H.R. Gaskins. 1999. Недоедание изменило воспалительную реакцию тонкого кишечника свиней на ротавирус. Дж. Нутр. 129 : 838-843. [PubMed] [Google Scholar]Ротавирус // Миддлсекс Здоровье
Обзор
Ротавирус — очень заразный вирус, вызывающий диарею.До разработки вакцины большинство детей были инфицированы вирусом хотя бы один раз к 5 годам.
Несмотря на то, что ротавирусные инфекции неприятны, обычно вы можете лечить эту инфекцию в домашних условиях дополнительным питьем, чтобы предотвратить обезвоживание. Иногда тяжелое обезвоживание требует введения жидкости через вену (внутривенно) в стационаре.
Хорошая гигиена, например, регулярное мытье рук, очень важна. Но вакцинация – лучший способ предотвратить ротавирусную инфекцию.
Но вакцинация – лучший способ предотвратить ротавирусную инфекцию.
Симптомы
Ротавирусная инфекция обычно начинается в течение двух дней после контакта с вирусом. Ранними симптомами являются лихорадка и рвота, за которыми следует от трех до семи дней водянистая диарея. Инфекция также может вызвать боль в животе.
У здоровых взрослых ротавирусная инфекция может вызывать только легкие признаки и симптомы или не вызывать их вообще.
Когда обращаться к врачу
Позвоните своему детскому врачу, если ваш ребенок:
- Диарея длится более 24 часов
- Частая рвота
- Имеет черный или дегтеобразный стул или стул с кровью или гноем
- Имеет температуру 102 F (38.9 С) или выше
- Кажется усталым, раздражительным или испытывающим боль
- Имеет признаки или симптомы обезвоживания, включая сухость во рту, плач без слез, малое мочеиспускание или его отсутствие, необычную сонливость или отсутствие реакции
Если вы взрослый, позвоните своему врачу, если вы:
- Не может удерживать жидкости в течение 24 часов
- Диарея длится более двух дней
- Наличие крови в рвотных массах или испражнениях
- Иметь температуру выше 103 F (39.
 4 С)
4 С) - Имеют признаки или симптомы обезвоживания, включая чрезмерную жажду, сухость во рту, незначительное мочеиспускание или его отсутствие, сильную слабость, головокружение при вставании или предобморочное состояние
Причины
Ротавирус присутствует в стуле инфицированного человека за два дня до появления симптомов и до 10 дней после их уменьшения. Вирус легко распространяется через контакт из рук в рот на протяжении всего этого времени, даже если у инфицированного человека нет симптомов.
Если у вас ротавирус, и вы не моете руки после посещения туалета, или у вашего ребенка ротавирус, и вы не моете руки после смены подгузника или помощи ребенку в туалете, вирус может распространиться на что угодно к которым вы прикасаетесь, в том числе к еде, игрушкам и посуде.Если другой человек прикоснется к вашим немытым рукам или зараженному предмету, а затем коснется своего рта, может возникнуть инфекция. Вирус может оставаться заразным на поверхностях, которые не дезинфицировались в течение нескольких недель или месяцев.
Можно заразиться ротавирусом более одного раза, даже если вы были привиты. Однако повторные инфекции обычно менее серьезны.
Факторы риска
Ротавирусные инфекции часто встречаются у детей в возрасте от 3 до 35 месяцев, особенно у тех, кто проводит время в детских учреждениях.Пожилые люди и взрослые, ухаживающие за маленькими детьми, также подвержены повышенному риску заражения.
В Соединенных Штатах риск заражения ротавирусом наиболее высок зимой и весной.
Осложнения
Тяжелая диарея может привести к обезвоживанию организма, особенно у маленьких детей. При отсутствии лечения обезвоживание может стать опасным для жизни состоянием независимо от его причины.
Профилактика
Чтобы уменьшить распространение ротавируса, тщательно и часто мойте руки, особенно после посещения туалета, смены подгузника или помощи ребенку в туалете.Но даже строгое мытье рук не дает никаких гарантий. А обычно используемые дезинфицирующие средства для рук на спиртовой основе мало влияют на ротавирус.
Всемирная организация здравоохранения рекомендует всем странам прививать младенцев ротавирусной вакциной. Доступны две вакцины:
- Ротатек. Эту вакцину вводят перорально тремя дозами, часто в возрасте 2, 4 и 6 месяцев. Вакцина не одобрена для использования у детей старшего возраста или взрослых.
- Ротарикс. Эта жидкая вакцина вводится двумя дозами младенцам в возрасте 2 и 4 месяцев.
Вакцины считаются безопасными и эффективными, и исследования показывают, что они ежегодно предотвращают развитие ротавируса у тысяч детей. Однако в редких случаях они могут вызвать загиб части кишечника (инвагинация), что может привести к опасной для жизни кишечной непроходимости.
Дети, перенесшие инвагинацию кишечника, с большей вероятностью заболеют ею снова после вакцинации против ротавируса. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США рекомендует не вводить вакцину детям с инвагинацией кишечника в анамнезе.
Для детей, у которых в анамнезе не было инвагинации кишечника, существует очень небольшой риск ее развития после введения ротавирусной вакцины. Тем не менее, преимущества вакцины намного перевешивают риски.
Если у вашего ребенка после прививки от ротавирусной вакцины появились боли в животе, рвота, диарея, кровь в стуле или изменение стула, немедленно обратитесь к врачу.
Диагностика
Многие болезни вызывают диарею. Таким образом, хотя ротавирус часто диагностируется на основании симптомов и физического осмотра, для подтверждения диагноза может использоваться анализ образца стула.
Лечение
Специфического лечения ротавирусной инфекции не существует. Антибиотики и противовирусные препараты не помогут при ротавирусной инфекции. Обычно инфекция проходит в течение трех-семи дней.
Предотвращение обезвоживания является самой большой проблемой. Чтобы предотвратить обезвоживание во время распространения вируса, пейте много жидкости. Если у вашего ребенка тяжелая диарея, попросите своего врача предложить жидкость для пероральной регидратации, такую как Pedialyte или Enfalyte, особенно если диарея длится дольше нескольких дней.
Если у вашего ребенка тяжелая диарея, попросите своего врача предложить жидкость для пероральной регидратации, такую как Pedialyte или Enfalyte, особенно если диарея длится дольше нескольких дней.
У детей жидкость для регидратации может заменить потерянные минералы более эффективно, чем вода или другие жидкости. Тяжелое обезвоживание может потребовать внутривенного введения жидкости в больнице.
Противодиарейные препараты не рекомендуются при ротавирусной инфекции.
Образ жизни и домашние средства
Если ваш ребенок болен, давайте ему небольшое количество жидкости. Если вы кормите грудью, дайте ребенку пососать.
Если ваш ребенок пьет смесь, предложите ему небольшое количество жидкости для пероральной регидратации или обычной смеси.Не разбавляйте смесь для вашего ребенка.
Если ваш старший ребенок плохо себя чувствует, предложите ему или ей отдохнуть. Предлагайте легкие продукты без добавления сахара, такие как цельнозерновой хлеб или крекеры, нежирное мясо, йогурт, фрукты и овощи.
Большое количество жидкости также важно, в том числе жидкость для пероральной регидратации. Избегайте газированных напитков, яблочного сока, молочных продуктов, кроме йогурта, и сладких продуктов, которые могут усилить диарею.
Избегайте всего, что может раздражать желудок, включая сильно приправленные продукты, кофеин, алкоголь и никотин.
Подготовка к встрече
Если вам или вашему ребенку необходимо обратиться к врачу, вы, скорее всего, сначала обратитесь к своему лечащему врачу. Если есть вопросы по диагнозу, врач может направить вас к гастроэнтерологу или инфекционисту.
Что вы можете сделать
Подготовка списка вопросов поможет вам максимально эффективно проводить время с врачом. Некоторые вопросы, которые вы, возможно, захотите задать своему врачу или врачу вашего ребенка, включают:
- Какова вероятная причина этих симптомов? Возможны ли другие причины?
- Нужны ли тесты?
- Какой подход к лечению лучше? Есть ли альтернативы?
- Нужно ли принимать какие-либо лекарства?
- Как облегчить симптомы?
Чего ожидать от врача
Врач может задать следующие вопросы:
- Когда появились симптомы?
- Были ли симптомы постоянными или они приходят и уходят?
- Насколько серьезны симптомы?
- Что-нибудь улучшает симптомы?
- Что, по-видимому, ухудшает симптомы?
Что вы можете сделать в это время
Пейте много жидкости. Как можно скорее возобновите здоровую диету, ограничив сахар и жиры. Если ваш ребенок болен, используйте тот же подход.
Как можно скорее возобновите здоровую диету, ограничив сахар и жиры. Если ваш ребенок болен, используйте тот же подход.
Если вы кормите грудью или используете смесь, продолжайте кормить ребенка как обычно. Спросите у врача вашего ребенка, уместно ли давать ребенку жидкость для пероральной регидратации.
©1998-2022 Фонд медицинского образования и исследований Мэйо (MFMER). Все права защищены. Условия использования
Появление лошадиных штаммов G3 в качестве доминирующего ротавируса среди детей в возрасте до пяти лет с диареей в штате Сабах, Малайзия, в 2018–2019 гг.
Abstract
Ротавирусная инфекция представляет собой дилемму для развивающихся стран, включая Малайзию.Хотя имеются коммерческие ротавирусные вакцины, они не включены в национальную программу иммунизации Малайзии. Нехватка данных о распределении генотипов ротавируса может быть частично виновата в этом политическом решении, поскольку данные о распределении генотипов ротавируса в Малайзии за последние 20 лет отсутствуют. С января 2018 г. по март 2019 г. мы провели исследование для выяснения бремени ротавирусной инфекции и распределения генотипов в округах Кота-Кинабалу и Кунак штата Сабах.Образцы стула были собраны у детей в возрасте до 5 лет, и антиген ротавируса в этих образцах был обнаружен с использованием имеющегося в продаже набора. Электроферотипы определяли электрофорезом геномной РНК в полиакриламидном геле. Генотипы G и P определяли с помощью ОТ-ПЦР с использованием типоспецифических праймеров. Нуклеотидную последовательность ампликонов определяли секвенированием по Сэнгеру, а филогенетический анализ выполняли методом соседнего соединения. Ротавирус выявлен у 43 (15,1%) детей с водянистой диареей.Соотношение мужчин и женщин (1,9:1) у детей, инфицированных ротавирусом, ясно показало, что он поражает преимущественно мальчиков и детей в возрасте 12–23 месяцев. Были идентифицированы генотипы G3P[8] (74% n = 31), за которыми следуют G1P[8] (14% n = 6), G12P[6] (7% n = 3), G8P[8] (3% n = 1) и GxP[8] (3% n = 1).
С января 2018 г. по март 2019 г. мы провели исследование для выяснения бремени ротавирусной инфекции и распределения генотипов в округах Кота-Кинабалу и Кунак штата Сабах.Образцы стула были собраны у детей в возрасте до 5 лет, и антиген ротавируса в этих образцах был обнаружен с использованием имеющегося в продаже набора. Электроферотипы определяли электрофорезом геномной РНК в полиакриламидном геле. Генотипы G и P определяли с помощью ОТ-ПЦР с использованием типоспецифических праймеров. Нуклеотидную последовательность ампликонов определяли секвенированием по Сэнгеру, а филогенетический анализ выполняли методом соседнего соединения. Ротавирус выявлен у 43 (15,1%) детей с водянистой диареей.Соотношение мужчин и женщин (1,9:1) у детей, инфицированных ротавирусом, ясно показало, что он поражает преимущественно мальчиков и детей в возрасте 12–23 месяцев. Были идентифицированы генотипы G3P[8] (74% n = 31), за которыми следуют G1P[8] (14% n = 6), G12P[6] (7% n = 3), G8P[8] (3% n = 1) и GxP[8] (3% n = 1). Преобладающим ротавирусом, циркулирующим среди детей, был лошадиноподобный G3P[8] (59,5% n = 25) с коротким электроферотипом. Среди 34 штаммов было идентифицировано одиннадцать электроферотипов, что указывает на существенное разнообразие среди циркулирующих штаммов.Циркулирующие генотипы также были филогенетически разнообразными и относились к штаммам из нескольких разных стран. Антигенные эпитопы, присутствующие на VP7 и VP4 Sabahan G3 и лошадиноподобного G3, значительно отличались от эпитопов вакцинного штамма RotaTeq. Наши результаты также показывают, что в штаммах Sabahan происходит значительный генетический обмен. Сабах является домом для ряда различных этнических групп, некоторые из которых в культурном отношении находятся в тесном контакте с животными, что может способствовать эволюции различных штаммов ротавируса.Сабах также является популярным туристическим направлением, и большое количество туристов из разных стран, возможно, способствует разнообразию циркулирующих генотипов ротавируса.
Преобладающим ротавирусом, циркулирующим среди детей, был лошадиноподобный G3P[8] (59,5% n = 25) с коротким электроферотипом. Среди 34 штаммов было идентифицировано одиннадцать электроферотипов, что указывает на существенное разнообразие среди циркулирующих штаммов.Циркулирующие генотипы также были филогенетически разнообразными и относились к штаммам из нескольких разных стран. Антигенные эпитопы, присутствующие на VP7 и VP4 Sabahan G3 и лошадиноподобного G3, значительно отличались от эпитопов вакцинного штамма RotaTeq. Наши результаты также показывают, что в штаммах Sabahan происходит значительный генетический обмен. Сабах является домом для ряда различных этнических групп, некоторые из которых в культурном отношении находятся в тесном контакте с животными, что может способствовать эволюции различных штаммов ротавируса.Сабах также является популярным туристическим направлением, и большое количество туристов из разных стран, возможно, способствует разнообразию циркулирующих генотипов ротавируса. Принимая во внимание все эти факторы, которые способствуют разнообразию генотипов ротавируса, непрерывный эпиднадзор за штаммами ротавируса имеет первостепенное значение для мониторинга эффективности ротавирусных вакцин до и после вакцинации в штате Сабах.
Принимая во внимание все эти факторы, которые способствуют разнообразию генотипов ротавируса, непрерывный эпиднадзор за штаммами ротавируса имеет первостепенное значение для мониторинга эффективности ротавирусных вакцин до и после вакцинации в штате Сабах.
Образец цитирования: Амит Л.Н., Мори Д., Джон Дж.Л., Чин А.З., Мосюн А.К., Джеффри М.С. и др.(2021) Появление лошадиных штаммов G3 в качестве доминирующего ротавируса среди детей в возрасте до пяти лет с диареей в штате Сабах, Малайзия, в 2018–2019 гг. ПЛОС ОДИН 16(7): e0254784. https://doi.org/10.1371/journal.pone.0254784
Редактор: Кок Кенг Ти, Университет Малайи, МАЛАЙЗИЯ
Получено: 12 января 2021 г.; Принято: 3 июля 2021 г .; Опубликовано: 28 июля 2021 г.
Авторское право: © 2021 Amit et al.Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в рукописи.
Финансирование: Это исследование финансировалось Министерством высшего образования в рамках гранта FRGS (Программа грантов для фундаментальных исследований) (FRGS 0457-2017) (URL: https://mygrants.гов.мы) к КА. Спонсор не играл никакой роли в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Ротавирус является безоболочечным двухцепочечным РНК-вирусом, принадлежащим к семейству Reoviridae [1]. Его геном состоит из 11 генных сегментов, окруженных внутренним ядром, самым внутренним слоем, который соединен с внешним капсидом промежуточным капсидом.Внешний капсид состоит из гликозилированного белка VP7 и остроконечного белка VP4, чувствительного к протеазе [2,3]. Белки VP4 и VP7 содержат эпитопы, индуцирующие нейтрализующие антитела [4,5]. Эти белки также определяют генотипы P и G, которые в совокупности образуют двойную систему классификации ротавирусов. На сегодняшний день у ротавирусов идентифицировано 36 генотипов G и 51 P [6]. Генотипы G1, G2, G3, G4, G9, P4, P6 и P8 обычно выявляются у циркулирующих штаммов. Во всем мире G1P[8], G2[P4], G3P[8], G4P[8], G9P[8]/P[6] и G12P[8]/P[6] являются доминирующими генотипами, выявляемыми при инфекциях человека. 7,8].Более того, новые ротавирусы с различными генотипами были обнаружены в результате реассортации генов между ротавирусами человека и животных [9,10].
Эти белки также определяют генотипы P и G, которые в совокупности образуют двойную систему классификации ротавирусов. На сегодняшний день у ротавирусов идентифицировано 36 генотипов G и 51 P [6]. Генотипы G1, G2, G3, G4, G9, P4, P6 и P8 обычно выявляются у циркулирующих штаммов. Во всем мире G1P[8], G2[P4], G3P[8], G4P[8], G9P[8]/P[6] и G12P[8]/P[6] являются доминирующими генотипами, выявляемыми при инфекциях человека. 7,8].Более того, новые ротавирусы с различными генотипами были обнаружены в результате реассортации генов между ротавирусами человека и животных [9,10].
Ротавирусы также можно классифицировать на основе модели миграции сегментированного генома в электрофорезе в полиакриламидном геле (PAGE), называемой электроферотипом. Существует два основных паттерна электроферотипов, длинные и короткие, различающиеся по скорости миграции сегмента 10, содержащего ген NSP5. Это происходит в результате вставки AT-богатых последовательностей в 3-концевую некодирующую область 11-го сегмента [11], что вызывает инверсию порядка миграции 10-го и 11-го сегментов гена [8]. Существует общая корреляция между типом G/P и электроферотипами. Штаммы G1P[8], G3P[8], G4P[8] и G9P[8] демонстрируют длинный паттерн электроферотипа, тогда как G2P[4] демонстрирует короткий паттерн электроферотипа.
Существует общая корреляция между типом G/P и электроферотипами. Штаммы G1P[8], G3P[8], G4P[8] и G9P[8] демонстрируют длинный паттерн электроферотипа, тогда как G2P[4] демонстрирует короткий паттерн электроферотипа.
Две имеющиеся в продаже вакцины, Rotarix и RotaTeq, были рекомендованы Всемирной организацией здравоохранения (ВОЗ) для всех национальных программ иммунизации и, в частности, для стран Южной и Юго-Восточной Азии и Африки к югу от Сахары [12], после того как они привели к значительному сокращению при тяжелых ротавирусных инфекциях в промышленно развитых странах [13,14].В Малайзии обе ротавирусные вакцины доступны на частном рынке по состоянию на 15 июля 2019 г. Rotarix — это моновалентная вакцина, полученная из изолята G1P[8] человека. RotaTeq является пятивалентным, состоящим из смеси моноассортантов ротавируса крупного рогатого скота человека, несущих гены, кодирующие белки G1, G2, G3, G4 и P[8] человека на генетическом фоне ротавируса крупного рогатого скота G6P[5] [15]. По состоянию на апрель 2018 г. 95 стран внедрили ротавирусные вакцины в свои национальные программы иммунизации, в том числе многие страны с низким уровнем дохода [16].Помимо этих вакцин, несколько стран разрабатывают свои собственные ротавирусные вакцины на основе преобладающих генотипов, циркулирующих в этих странах; например, в 2016 году Индия представила Rotavac, моновалентную вакцину, полученную из штамма G9P[11] [16,17]. Эта вакцина внесена в список преквалифицированных ВОЗ вакцин [16]. В 2018 г. Индия включила Rotasil, поливалентную (G1, G2, G3, G4, G9 и P[8]) ротавирусную вакцину, в свою национальную программу иммунизации [18].
По состоянию на апрель 2018 г. 95 стран внедрили ротавирусные вакцины в свои национальные программы иммунизации, в том числе многие страны с низким уровнем дохода [16].Помимо этих вакцин, несколько стран разрабатывают свои собственные ротавирусные вакцины на основе преобладающих генотипов, циркулирующих в этих странах; например, в 2016 году Индия представила Rotavac, моновалентную вакцину, полученную из штамма G9P[11] [16,17]. Эта вакцина внесена в список преквалифицированных ВОЗ вакцин [16]. В 2018 г. Индия включила Rotasil, поливалентную (G1, G2, G3, G4, G9 и P[8]) ротавирусную вакцину, в свою национальную программу иммунизации [18].
Ротавирус остается наиболее значимым возбудителем острого гастроэнтерита у детей в возрасте до 5 лет во всем мире и ежегодно вызывает около 25 миллионов госпитализаций и 450 000 смертей [19].Развивающиеся страны Азии и Африки имеют высокое бремя ротавирусной инфекции, на них приходится более 90% смертей, по оценке 2015 г. [20]. В Малайзии ротавирус является причиной 31 000 госпитализаций, 41 000 амбулаторных посещений, 145 000 эпизодов гастроэнтерита, леченных на дому, и 27 смертей в год [21]. Сообщалось об исследованиях циркулирующих генотипов ротавируса в Малайзии с 1970-х по 2000-е годы [22]. Были идентифицированы распространенные генотипы ротавирусов G1P[8], G2P[4], G3P[8] G9P[8], и их преобладание время от времени менялось [22].Однако, начиная с 2000 г., G9P[8] стал преобладающим ротавирусом, идентифицированным в Джохоре (42%) [23], Куала-Лумпуре и Кучинге (73,3%) [23,24]. Непрерывный надзор за генотипическим распространением ротавируса на региональном уровне имеет решающее значение для обеспечения того, чтобы Rotarix и RotaTeq обеспечивали защиту от циркулирующих штаммов. Однако большинство исследований ротавируса было проведено в западной части Малайзии, особенно в Куала-Лумпуре [22–24].
Сообщалось об исследованиях циркулирующих генотипов ротавируса в Малайзии с 1970-х по 2000-е годы [22]. Были идентифицированы распространенные генотипы ротавирусов G1P[8], G2P[4], G3P[8] G9P[8], и их преобладание время от времени менялось [22].Однако, начиная с 2000 г., G9P[8] стал преобладающим ротавирусом, идентифицированным в Джохоре (42%) [23], Куала-Лумпуре и Кучинге (73,3%) [23,24]. Непрерывный надзор за генотипическим распространением ротавируса на региональном уровне имеет решающее значение для обеспечения того, чтобы Rotarix и RotaTeq обеспечивали защиту от циркулирующих штаммов. Однако большинство исследований ротавируса было проведено в западной части Малайзии, особенно в Куала-Лумпуре [22–24].
Малайзия состоит из 13 штатов и трех федеральных территорий, разделенных на Западную и Восточную Малайзию (рис. S1).Западная Малайзия включает Малайский полуостров. Восточная Малайзия состоит из двух штатов и одной федеральной территории на острове Борнео. Однако восприимчивость к ротавирусу различается в разных областях; например, дети в Восточной Малайзии более уязвимы к диарее, чем дети в Западной Малайзии (8,7 госпитализаций на 1000 детей против 4,3 госпитализаций на 1000 детей). Кроме того, у детей из числа коренных народов частота госпитализаций (11,6 госпитализаций на 1000 детей) из-за диареи выше, чем у детей других национальностей (2.9–8,0 госпитализаций/1000 детей) [25].
Кроме того, у детей из числа коренных народов частота госпитализаций (11,6 госпитализаций на 1000 детей) из-за диареи выше, чем у детей других национальностей (2.9–8,0 госпитализаций/1000 детей) [25].
За исключением одного исследования, проведенного в больнице королевы Елизаветы в Кота-Кинабалу в 2005–2006 гг., которое показало, что 16% образцов оказались положительными на ротавирусную инфекцию [26], исследования в штате Сабах не проводились, несмотря на важность этого вируса и наличие вакцины. Также за последние 20 лет не было опубликовано исследований распределения генотипов ротавирусов в Малайзии. Более того, не проводились исследования распределения генотипов ротавируса среди детей штата Сабах, что имеет решающее значение перед внедрением ротавирусной вакцины.Поэтому настоящее исследование было проведено для определения циркулирующих генотипов среди детей в возрасте до 5 лет в штате Сабах, что может быть полезно для информированного принятия решений по внедрению ротавирусной вакцины в этом штате.
Материалы и методы
Сбор образцов водянистого стула и информация о пациентах
С января 2018 г. по март 2019 г. образцы водянистого стула были собраны у детей в возрасте до 5 лет с диареей, посещающих женскую и детскую больницу Сабах, районную больницу Кунак, поликлинику Менггатал и поликлинику Телипок.Кунакская районная больница расположена в районе Кунак, а остальные больницы — в районе Кота-Кинабалу. Случаи диареи определяли как наличие трех жидких стулов в течение 24 часов (27), и для сбора образцов использовали удобный метод отбора проб. Перед взятием проб у опекунов детей было взято письменное информированное согласие. Регистрировались возраст, пол и раса детей. Собранные образцы стула были отправлены в холодильной цепи в лабораторию Университета Малайзии Сабах, Кота-Кинабалу.Образцы хранили при -80°С до использования.
Одобрение этики
Утверждение этики было получено от Национального регистратора медицинских исследований для клиник Телипок и Менггатал (NMRR-16-2245-32787), женской и детской больницы штата Сабах (NMRR-19-3925-52370) и районной больницы Кунак (NMRR- 20-1324-55178).
Идентификация ротавируса
Образцы стула были разбавлены в 10 раз фосфатно-буферным раствором. Ротавирус идентифицировали с помощью коммерческого иммуноферментного анализа согласно инструкции производителя (Rotaclone, Meridien Diagnostics Inc, Цинциннати, США).
Выделение РНК и определение генотипа G и P ротавируса
Геномную РНК ротавируса экстрагировали из образцов, положительных на ротавирус, с использованием мини-набора QIAamp Viral RNA в соответствии с инструкциями производителя (Qiagen GmbH, Hilden, Germany). Гены VP7 и VP4 амплифицировали с помощью полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) [27] с использованием AccessQuick RT PCR MasterMix (Promega Corporation, Мэдисон, Висконсин, США). Для генотипирования G использовали праймеры VP7-R, G1, G2, G4 и G8, как описано ранее [28], а для генотипов G3 и G9 использовали праймеры, описанные Gouvea et al., [28]. Праймеры для генотипирования P использовали согласно Gunasena et al. [29]. Соответствующие генотипы определяли прежде всего путем оценки молекулярной массы ампликонов после обработки в агарозном геле. Определена нуклеотидная последовательность ампликонов; генотипы определяли, отправляя нуклеотидные последовательности в инструмент генотипирования ротавируса (https://www.viprbrc.org/brc/rvaGenotyper.spg?method=ShowCleanInputPage&decorator=reo).
[29]. Соответствующие генотипы определяли прежде всего путем оценки молекулярной массы ампликонов после обработки в агарозном геле. Определена нуклеотидная последовательность ампликонов; генотипы определяли, отправляя нуклеотидные последовательности в инструмент генотипирования ротавируса (https://www.viprbrc.org/brc/rvaGenotyper.spg?method=ShowCleanInputPage&decorator=reo).
Секвенирование нуклеотидов, филогенетический анализ и идентификация нуклеотидов
Нуклеотидную последовательность ампликонов определяли с помощью набора для секвенирования BigDye Terminator Cycle Sequencing Kit (v.3.1; Applied Biosystems, Фостер-Сити, Калифорния, США) в соответствии с инструкциями производителя, а продукт запускали на генетическом анализаторе ABI Prism 3100 (Applied Biosystems). Для филогенетического анализа использовали нуклеотидные последовательности генов VP7 и VP4 штаммов Sabahan и других штаммов, извлеченных из GenBank. Филогенетический анализ был выполнен методом соседнего соединения с использованием MEGA X (https://www. megasoftware.net) после выравнивания нуклеотидных последовательностей с использованием CLUSTAL W. Паттерны ветвления оценивались с использованием бутстрэп-анализа 1000 повторов.Идентичность нуклеотидов генов VP7 и VP4 разных линий была рассчитана с помощью онлайн-программного обеспечения (www.bioinformatics.org).
megasoftware.net) после выравнивания нуклеотидных последовательностей с использованием CLUSTAL W. Паттерны ветвления оценивались с использованием бутстрэп-анализа 1000 повторов.Идентичность нуклеотидов генов VP7 и VP4 разных линий была рассчитана с помощью онлайн-программного обеспечения (www.bioinformatics.org).
Определение электроферотипов
Геномную дцРНК экстрагировали из образцов, положительных на ротавирус, и определяли электроферотип, подвергая извлеченную дцРНК электрофорезу в ПААГ в соответствии с ранее опубликованным методом [30,31]. Вкратце, 5 мкл экстрагированной дцРНК, смешанной с 5 мкл загрузочного буфера, загружали в каждую дорожку 10% полиакриламидного геля и запускали в течение 16 ч при постоянном токе 8 мА.Нумерация электроферотипов была назначена произвольно и основана на отчетливых изменениях в характере миграции как минимум в одной из четырех групп сегментов, т. е. сегментах с 1 по 4, с 5 по 6, с 7 по 9 или с 10 по 11.
Результаты
Всего за период исследования было отобрано 285 проб. Соотношение мужчин и женщин среди испытуемых составляло 1,5:1 (153 мужчины, 102 женщины и 30 неопределенных). Их средний возраст составлял 18 месяцев и колебался от 15 дней до 66 месяцев (только одному ребенку было 66 месяцев).Ротавирус был обнаружен в 15,1% (43/285) образцов. Соотношение мужчин и женщин среди ротавирусно-инфицированных детей составило 1,9:1. Средний возраст пациентов с ротавирусной диареей составил 14 месяцев и колебался от 15 дней до 55 месяцев. Ротавирус чаще всего выявляли у детей в возрасте 12–23 месяцев, затем следовали дети в возрасте 24–35 месяцев (рис. 1). Ротавирус реже поражал детей в возрасте 6–11 месяцев и 48–59 месяцев.
Соотношение мужчин и женщин среди испытуемых составляло 1,5:1 (153 мужчины, 102 женщины и 30 неопределенных). Их средний возраст составлял 18 месяцев и колебался от 15 дней до 66 месяцев (только одному ребенку было 66 месяцев).Ротавирус был обнаружен в 15,1% (43/285) образцов. Соотношение мужчин и женщин среди ротавирусно-инфицированных детей составило 1,9:1. Средний возраст пациентов с ротавирусной диареей составил 14 месяцев и колебался от 15 дней до 55 месяцев. Ротавирус чаще всего выявляли у детей в возрасте 12–23 месяцев, затем следовали дети в возрасте 24–35 месяцев (рис. 1). Ротавирус реже поражал детей в возрасте 6–11 месяцев и 48–59 месяцев.
Сорок два положительных на ротавирус образца были доступны для генотипирования G и P.Преобладающим генотипом G был G3 (74% n = 31), за которым следовали G1 (14% n = 6), G12 (7% n = 3), G8 (2% n = 1) и в одном образце (2%). генотип G определить не удалось. Генотипы P были идентифицированы в 42 ротавирус-позитивных образцах. Преобладающим генотипом P был P[8], который был обнаружен в 39 (93%) образцах, за ним следовал P[6] в 3 (7%) образцах. Исходя из комбинаций генотипов G и P, преобладающим генотипом был G3P[8] (74% n = 31), за которым следовали G1P[8] (14% n = 6), G12P[6] (7% n = 3). , G8P[8](3% n = 1) и GxP[8] (3% n = 1).
Исходя из комбинаций генотипов G и P, преобладающим генотипом был G3P[8] (74% n = 31), за которым следовали G1P[8] (14% n = 6), G12P[6] (7% n = 3). , G8P[8](3% n = 1) и GxP[8] (3% n = 1).
Из образцов, подвергнутых электрофорезу, в 34 образцах удалось идентифицировать все 11 сегментов и определить их электроферотипы. Все 11 сегментов не были видны в остальных образцах, поскольку выход геномной РНК был менее вероятным из-за более низкой концентрации вирусных частиц. Были идентифицированы три коротких и восемь длинных паттернов электроферотипа (рис. 2). Среди коротких электроферотипов 11 штаммов относились к S1, 11 к S2 и 1 к S3 электроферотипу. Среди длинных электроферотипов было по два электроферотипа L1, L2 и L3.Было по одному штамму каждого электроферотипа L4, L5, L6, L7 и L8.
Рис. 2. Электроферотипы ротавирусов, идентифицированных в штате Сабах.
Всего выделено 11 электроферотипов, выделено три коротких (S1–S3) и восемь длинных (L1–L8) паттернов электроферотипов. Номер штамма и генотип каждого электроферотипа показаны над электроферотипом.
Номер штамма и генотип каждого электроферотипа показаны над электроферотипом.
https://doi.org/10.1371/journal.pone.0254784.g002
Филогенетический анализ гена VP7 генотипа G1 показал, что два штамма ротавируса G1 из штата Сабах образовали независимый кластер, но были тесно связаны со штаммами из Индонезии и принадлежали к линии Ic (рис. 3).Гены VP7 Штаммы Сабахана имеют 99,9% идентичности нуклеотидов между собой и 99,5–99,8% идентичности с индонезийскими штаммами. Один штамм G1 образовал кластер со штаммами из Южной Африки и Вьетнама и принадлежал к линии II. Эти штаммы имели между собой идентичность нуклеотидов на 99,2–99,5%. Остальные три штамма из Сабаха также принадлежали к линии II и группировались со штаммом из Пакистана. Среди штаммов из Сабаха идентичность нуклеотидов составляла 99,8–99,9%. Штаммы Сабахана делили 99.Идентичность нуклеотидов 5–99,6% с пакистанским штаммом.
Рис. 3. Филогенетическое дерево, построенное с использованием нуклеотидных последовательностей гена VP7 штаммов G1.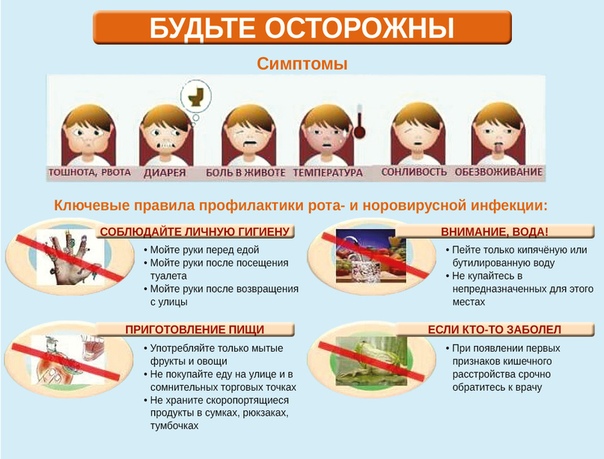
В качестве внешней группы использовали ротавирус человека Х310 (G5). Число рядом с узлом представляет собой значение начальной загрузки, а значения ниже 70% не указаны. Масштабная линейка показывает генетическое расстояние, выраженное в виде нуклеотидных замен на сайт. Штаммы, выявленные в этом исследовании, отмечены закрашенным кружком. Штаммы из Сабаха принадлежат к линиям Ia и II.Нуклеотидные последовательности наших штаммов внесены в базы данных DNA DataBank Японии, Европейской лаборатории молекулярной биологии и GenBank. Номера доступа указаны в начале каждого штамма.
https://doi.org/10.1371/journal.pone.0254784.g003
Филогенетический анализ генов VP7 показал, что наши штаммы G12 P[6] принадлежали к линии III и образовывали независимый кластер; эти штаммы имели 100% нуклеотидную идентичность. Штамм из Китая был близок к этому кластеру и разделял 99.6% идентичность со штаммами Sabahan (рис. 4). Единственный штамм G8P[8] из штата Сабах образовал кластер со штаммами из Таиланда, Японии, Вьетнама и Чехии (рис. 5). Эти штаммы имели между собой идентичность нуклеотидов на 99,5–99,7%.
5). Эти штаммы имели между собой идентичность нуклеотидов на 99,5–99,7%.
Рис. 4. Филогенетическое дерево, построенное с использованием нуклеотидных последовательностей гена VP7 штаммов G12.
Ротавирус человека Wa-40-AG (G1) использовали в качестве внешней группы. Число рядом с узлом представляет собой значение начальной загрузки, а значения ниже 70% не указаны.Масштабная линейка показывает генетическое расстояние, выраженное в виде нуклеотидных замен на сайт. Штаммы, выявленные в этом исследовании, отмечены закрашенным кружком. Штаммы из Сабаха относятся к линии III. Нуклеотидные последовательности наших штаммов внесены в базы данных DNA DataBank Японии, Европейской лаборатории молекулярной биологии и GenBank. Номера доступа указаны в начале каждого штамма.
https://doi.org/10.1371/journal.pone.0254784.g004
Рис. 5.Филогенетическое дерево, построенное с использованием нуклеотидных последовательностей гена VP7 штаммов G8.
Ротавирус человека Wa-40-AG (G1) использовали в качестве внешней группы. Число рядом с узлом представляет собой значение начальной загрузки, а значения ниже 70% не указаны. Масштабная линейка показывает генетическое расстояние, выраженное в виде нуклеотидных замен на сайт. Штаммы, выявленные в этом исследовании, отмечены закрашенным кружком. Нуклеотидные последовательности наших штаммов внесены в базы данных DNA DataBank Японии, Европейской лаборатории молекулярной биологии и GenBank.Номера доступа указаны в начале каждого штамма.
Число рядом с узлом представляет собой значение начальной загрузки, а значения ниже 70% не указаны. Масштабная линейка показывает генетическое расстояние, выраженное в виде нуклеотидных замен на сайт. Штаммы, выявленные в этом исследовании, отмечены закрашенным кружком. Нуклеотидные последовательности наших штаммов внесены в базы данных DNA DataBank Японии, Европейской лаборатории молекулярной биологии и GenBank.Номера доступа указаны в начале каждого штамма.
https://doi.org/10.1371/journal.pone.0254784.g005
Штаммы G3 из Сабаха делятся на линии I и III. Линия I включает штаммы G3, подобные лошадям (n = 25, 59,5%), происходящие от человека и от лошадей и других животных, таких как собаки и кошки. Lineage III содержит только человеческие штаммы G3 (рис. 6). Лошадиные штаммы G3 из Сабаха были разделены на три кластера. В одном кластере, хотя штаммы Сабаха сгруппированы вместе, они были тесно связаны со штаммами из Японии, Венгрии, Таиланда, Испании, Австралии, Бразилии, США и Индонезии. Штаммы Сабахана имели 99,7–100% и 99–99,8% нуклеотидную идентичность между собой и со штаммами из этих стран соответственно. Другой кластер содержал один штамм из Сабаха и другие из Индонезии, Таиланда и Японии. Эти штаммы имели между собой идентичность нуклеотидов на 99,2–99,6%. Третий кластер состоял только из штаммов из Сабаха и имел между собой идентичность нуклеотидов на 99,5–100%. Штаммы линии III были разделены на два кластера; один содержал только штаммы из Сабаха (99.идентичность нуклеотидов 8–100%), другой содержал штаммы из Китая (идентичность нуклеотидов 99,4–100%).
Штаммы Сабахана имели 99,7–100% и 99–99,8% нуклеотидную идентичность между собой и со штаммами из этих стран соответственно. Другой кластер содержал один штамм из Сабаха и другие из Индонезии, Таиланда и Японии. Эти штаммы имели между собой идентичность нуклеотидов на 99,2–99,6%. Третий кластер состоял только из штаммов из Сабаха и имел между собой идентичность нуклеотидов на 99,5–100%. Штаммы линии III были разделены на два кластера; один содержал только штаммы из Сабаха (99.идентичность нуклеотидов 8–100%), другой содержал штаммы из Китая (идентичность нуклеотидов 99,4–100%).
Рис. 6. Филогенетическое дерево, построенное с использованием нуклеотидных последовательностей гена VP7 штаммов G3.
Ротавирус человека Wa-40-AG (G1) использовали в качестве внешней группы. Число рядом с узлом представляет собой значение начальной загрузки, а значения ниже 70% не указаны. Масштабная линейка показывает генетическое расстояние, выраженное в виде нуклеотидных замен на сайт. Штаммы, выявленные в этом исследовании, отмечены закрашенным кружком. Штаммы из Сабаха принадлежат к линиям I и III. Нуклеотидные последовательности наших штаммов внесены в базы данных DNA DataBank Японии, Европейской лаборатории молекулярной биологии и GenBank. Номера доступа указаны в начале каждого штамма.
Штаммы из Сабаха принадлежат к линиям I и III. Нуклеотидные последовательности наших штаммов внесены в базы данных DNA DataBank Японии, Европейской лаборатории молекулярной биологии и GenBank. Номера доступа указаны в начале каждого штамма.
https://doi.org/10.1371/journal.pone.0254784.g006
Все гены VP4 ротавирусов P[8] принадлежали к линии III (рис. 7). Было два кластера, содержащих только лошадиные ротавирусы G3 из штата Сабах.Штаммы в этих двух кластерах также сформировали кластеры на филогенетическом дереве VP7. Первый кластер тесно связан со штаммами из Японии, Таиланда и Венгрии, как и в дереве VP7. Ген VP4 штаммов Sabahan имеет идентичность нуклеотидов на 100% и 99,5% между собой и со штаммом из Японии. Второй кластер был очень тесно связан со штаммами из Китая, но был независимым кластером в дереве VP7. Ген VP4 штаммов Sabahan имеет идентичность нуклеотидов на 99,4–100% и 99,1–99,6% между собой и со штаммом из Китая.Независимый кластер был образован тремя G3, которые также содержали лошадиноподобный G3 (штамм MS18). Эти штаммы имели между собой идентичность нуклеотидов на 99,9–100%. Другой кластер содержал три G3 и один лошадиный G3 (KN4) и штаммы из Индии. Ген VP4 штаммов Sabahan имеет идентичность нуклеотидов на 99,9–100% и 99,6–99,9% между собой и с индийскими штаммами. G3, подобный лошадям, образовал кластер с этими индийскими штаммами на филогенетическом дереве VP7. Ген VP4 штаммов P[8] G1 формировал три кластера.В одном кластере ротавирус G1P[8] из штата Сабах сгруппировался с ротавирусом G1P[8] из Южной Африки. Эти штаммы имели идентичность нуклеотидов на 99,6%. Этот южноафриканский штамм был тем же самым, что и этот штамм Sabahan, сгруппированный в филогенетическом дереве VP7. Другой кластер был образован двумя штаммами G1 из Сабаха со 100% идентичностью нуклеотидов и был очень близок к штамму G3P[8] из Японии, что указывает на возможное общее происхождение гена VP4 P[8] для этих ротавирусов G1 и G3. . Кроме того, еще один кластер был образован тремя ротавирусами G1P[8] из Сабаха, который был очень близок к индийскому и пакистанскому ротавирусам G1P[8].
Эти штаммы имели между собой идентичность нуклеотидов на 99,9–100%. Другой кластер содержал три G3 и один лошадиный G3 (KN4) и штаммы из Индии. Ген VP4 штаммов Sabahan имеет идентичность нуклеотидов на 99,9–100% и 99,6–99,9% между собой и с индийскими штаммами. G3, подобный лошадям, образовал кластер с этими индийскими штаммами на филогенетическом дереве VP7. Ген VP4 штаммов P[8] G1 формировал три кластера.В одном кластере ротавирус G1P[8] из штата Сабах сгруппировался с ротавирусом G1P[8] из Южной Африки. Эти штаммы имели идентичность нуклеотидов на 99,6%. Этот южноафриканский штамм был тем же самым, что и этот штамм Sabahan, сгруппированный в филогенетическом дереве VP7. Другой кластер был образован двумя штаммами G1 из Сабаха со 100% идентичностью нуклеотидов и был очень близок к штамму G3P[8] из Японии, что указывает на возможное общее происхождение гена VP4 P[8] для этих ротавирусов G1 и G3. . Кроме того, еще один кластер был образован тремя ротавирусами G1P[8] из Сабаха, который был очень близок к индийскому и пакистанскому ротавирусам G1P[8]. Ген VP4 штаммов Sabahan имеет идентичность нуклеотидов на 99,9–100% и 98,1–98,9% между собой и со штаммом из Пакистана. Филогенетическое дерево VP7 этих G1 также было близко к другому пакистанскому штамму G1P[8]. Два штамма G8P[8] и GxP[8] из Сабаха сформировали независимый кластер, но были очень близки к штамму G8P[8] из Сингапура; однако на филогенетическом дереве VP7 этот штамм Sabahan G8 сгруппирован со штаммами из Японии, Вьетнама и Чехии. Ген VP4 штаммов Sabahan разделяет 99.6% и 99,4–99,5% идентичности нуклеотидов между собой и со штаммом из Сингапура. Штаммы G8P[8] и GxP[8] были очень похожи друг на друга, что указывает на возможность существования другого штамма G8.
Ген VP4 штаммов Sabahan имеет идентичность нуклеотидов на 99,9–100% и 98,1–98,9% между собой и со штаммом из Пакистана. Филогенетическое дерево VP7 этих G1 также было близко к другому пакистанскому штамму G1P[8]. Два штамма G8P[8] и GxP[8] из Сабаха сформировали независимый кластер, но были очень близки к штамму G8P[8] из Сингапура; однако на филогенетическом дереве VP7 этот штамм Sabahan G8 сгруппирован со штаммами из Японии, Вьетнама и Чехии. Ген VP4 штаммов Sabahan разделяет 99.6% и 99,4–99,5% идентичности нуклеотидов между собой и со штаммом из Сингапура. Штаммы G8P[8] и GxP[8] были очень похожи друг на друга, что указывает на возможность существования другого штамма G8.
Ротавирус человека DS-1 (P[4]) использовали в качестве внешней группы. Число рядом с узлом представляет собой значение начальной загрузки, а значения ниже 70% не указаны. Масштабная линейка показывает генетическое расстояние, выраженное в виде нуклеотидных замен на сайт. Штаммы, выявленные в этом исследовании, отмечены закрашенным кружком. Все штаммы из Сабаха относятся к линии III. Нуклеотидные последовательности наших штаммов внесены в базы данных DNA DataBank Японии, Европейской лаборатории молекулярной биологии и GenBank. Номера доступа указаны в начале каждого штамма.
Штаммы, выявленные в этом исследовании, отмечены закрашенным кружком. Все штаммы из Сабаха относятся к линии III. Нуклеотидные последовательности наших штаммов внесены в базы данных DNA DataBank Японии, Европейской лаборатории молекулярной биологии и GenBank. Номера доступа указаны в начале каждого штамма.
https://doi.org/10.1371/journal.pone.0254784.g007
P[6], принадлежащий к линии I наших штаммов G12P[6], был близок к штаммам G12P[6] человека из Пакистана, и Китай (рис. 8).Штаммы Sabahan имели идентичность нуклеотидов на 98,5–99,8% и 97,8–99,3% между собой, а также с пакистанскими и китайскими штаммами соответственно. Китайский штамм был тем же, что сгруппировался вместе со штаммами Sabahan в филогенетическом дереве VP7.
Рис. 8. Филогенетическое дерево, построенное с использованием нуклеотидных последовательностей гена VP4 штаммов P[6]. В качестве внешней группы использовали ротавирус человека Wa (P[8]). Число рядом с узлом представляет собой значение начальной загрузки, а значения ниже 70% не указаны.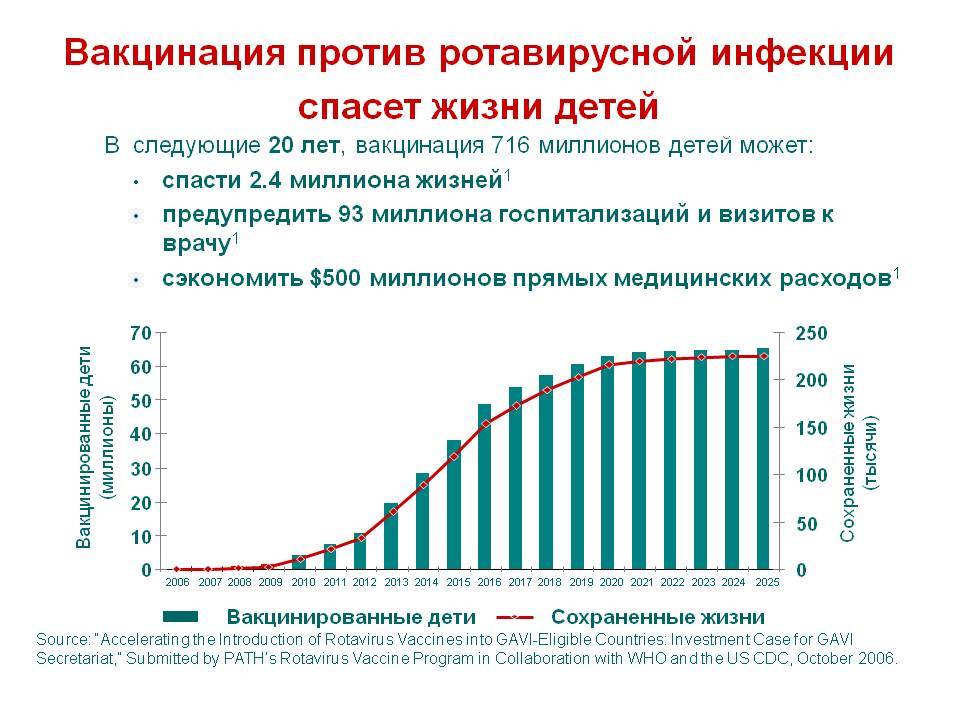 Масштабная линейка показывает генетическое расстояние, выраженное в виде нуклеотидных замен на сайт. Штаммы, выявленные в этом исследовании, отмечены закрашенным кружком. Все штаммы из Сабаха принадлежат к линии I. Нуклеотидные последовательности наших штаммов внесены в базы данных DNA DataBank Японии, Европейской лаборатории молекулярной биологии и GenBank. Номера доступа указаны в начале каждого штамма.
Масштабная линейка показывает генетическое расстояние, выраженное в виде нуклеотидных замен на сайт. Штаммы, выявленные в этом исследовании, отмечены закрашенным кружком. Все штаммы из Сабаха принадлежат к линии I. Нуклеотидные последовательности наших штаммов внесены в базы данных DNA DataBank Японии, Европейской лаборатории молекулярной биологии и GenBank. Номера доступа указаны в начале каждого штамма.
https://doi.org/10.1371/journal.pone.0254784.g008
В настоящем исследовании мы сравнили антигенные эпитопы VP7 и VP4 (VP8*) штаммов Sabahan G3 и лошадиных G3 с эпитопами Вакцинный штамм RotaTeq (WI78-8).Среди 29 аминокислотных остатков, составляющих антигенные эпитопы VP7, у наших штаммов было обнаружено семь различий (рис. 9). Только у лошадиных штаммов G3 одна замена (T87I) произошла в области 7-1a. В эпитопе 7-1b лошадиноподобных штаммов G3 и G3 были обнаружены четыре замены (A212T, N213T, K238D/K238N, D242A) и три замены (A212T, K238N, D242N) соответственно. В эпитопе 7–2 лошадиноподобных штаммов G3 и G3 были обнаружены две (A221T и L148M) и одна замена (A221D) соответственно.
В эпитопе 7–2 лошадиноподобных штаммов G3 и G3 были обнаружены две (A221T и L148M) и одна замена (A221D) соответственно.
Рис. 9. Сравнение антигенных остатков VP7, присутствующих в штаммах RotaTeq с генотипом G3 и штаммах, циркулирующих в штате Сабах, Малайзия.
Соответствующие антигенные эпитопы показаны над номерами остатков. Аминокислотные остатки в штаммах Sabahan, отличающиеся от таковых в вакцинных штаммах, выделены желтым цветом.
https://doi.org/10.1371/journal.pone.0254784.g009
Из 25 аминокислотных остатков, составляющих антигенные эпитопы VP4, у наших штаммов было обнаружено шесть различий (рис. 10).В эпитопе 8–1 штаммов G3 и G3, подобных лошадиным, были обнаружены две замены (S146G, D196S) и три замены (S146G, N150S, D196S/D196G) соответственно. В эпитопе 8-2 замены не обнаружено. В эпитопе 8–3 была обнаружена одна замена (N113D) в лошадиноподобных штаммах G3 и G3. В эпитопе 8–4 штаммов G3 и G3, подобных лошадям, были обнаружены одна (T88I) и две замены (T88I и N89S) соответственно.
Рис. 10. Сравнение антигенных остатков VP4, присутствующих в штаммах RotaTeq с генотипом G3 и штаммах, циркулирующих в штате Сабах, Малайзия.
Соответствующие антигенные эпитопы показаны над номерами остатков. Аминокислотные остатки в штаммах Sabahan, отличающиеся от таковых в вакцинных штаммах, выделены желтым цветом.
https://doi.org/10.1371/journal.pone.0254784.g010
Обсуждение
Ротавирусные генотипы G1–G4, G9 и G12 в сочетании с P[8], P[6] и P[4] ответственны за более чем 90% случаев ротавирусной диареи во всем мире [18]. Спорадическая заболеваемость редкими генотипами, такими как G5, G6, G8, G10, G11, P[1], P[3], P[9], P[10], P[19], P[14] и P[ 25] были обнаружены [11,18,27,32–36].В целом, модели распределения G и P ротавируса колеблются от места к месту и от года к году [37]. Исследования, проведенные в Малайзии с 1977 по 2010 год, показали, что кодоминантными являются G1P[8] и G4P[8], за которыми следуют G9P[8], G2P[4] и G3P[8] [22]. Хотя G3 никогда не был преобладающим генотипом в этих исследованиях, они не включали Sabah. В настоящем исследовании мы обнаружили, что лошадиноподобный G3P[8] является преобладающим (59,5%) генотипом, циркулирующим в штате Сабах.
Хотя G3 никогда не был преобладающим генотипом в этих исследованиях, они не включали Sabah. В настоящем исследовании мы обнаружили, что лошадиноподобный G3P[8] является преобладающим (59,5%) генотипом, циркулирующим в штате Сабах.
Филогенетический анализ ясно показывает, что несколько штаммов как человеческого G3P[8], так и лошадиного G3P[8] циркулируют среди детей в штате Сабах, что указывает на присутствие штаммов, обнаруженных только в штате Сабах, и других штаммов, которые, возможно, проникли в штат Сабах из разных источников. , после чего произошло локальное распространение и они распространились по штату.В период нашего исследования (2018–2019 гг.) человеческий G3P[8] был доминирующим генотипом в Бангладеш; эти штаммы были филогенетически связаны с индийскими штаммами, циркулировавшими в 2015–2017 гг. [38,39]. В Пакистане и Мьянме человеческий G3P[8] также преобладал в 2016 и 2017 годах соответственно [6,40]. Однако эти штаммы не были связаны с штаммами из Сабаха; скорее, последние были независимыми от эфира или связаны с китайскими штаммами.
сабахских лошадиных G3P[8] ротавирусов демонстрировали короткие электроферотипы, сходные с тайскими лошадиными G3P[8], которые доминировали в 2015 и 2016 годах [37].Однако только один из наших штаммов сгруппировался с этим штаммом в филогенетическом дереве. Другой наш лошадиный G3P[8] принадлежал к независимым кластерам, что указывает на то, что предки этих кластеров, возможно, вошли в Сабах в прошлом и эволюционировали. Лошадиноподобный G3P[8] с короткими электроферотипами появился в Австралии и Таиланде в 2013 г., в Испании и Венгрии в 2015 г., а также в Бразилии, Индонезии и Японии в 2016 г. [37]. Анализ последовательности всего генома показал, что эти лошадиноподобные G3P[8] с короткими электроферотипами имели DS-1-подобную основу; я.э., созвездие G3P[8]-I2-R2-C2-M2-A2-N1/2-T2-E2-h3 [37]. В соседних районах Индонезии, Центральной Яве и Джокьякарте, лошадиноподобный G3P[8] с созвездием G3P[8]-I2-R2-C2-M2-A2-N1/2-T2-E2-h3 стал доминирующим и был идентифицирован в выборки 2014 и 2015 гг. [41]. Исследование из Сурабая, Индонезия, идентифицировало два различных лошадиных штамма G3P[8] и G3P[6] с короткими электроферотипами, циркулировавшими в 2015–2016 годах [42]. Примечательно, что тайские лошадиноподобные линии обладали разными генами NSP4: один бычий, а другой человекоподобный [37].Поскольку мы не уверены, к какому из этих штаммов принадлежат наши штаммы, в будущем можно будет провести анализ последовательности всего генома лошадиноподобных штаммов G3, чтобы прояснить события реассортации.
[41]. Исследование из Сурабая, Индонезия, идентифицировало два различных лошадиных штамма G3P[8] и G3P[6] с короткими электроферотипами, циркулировавшими в 2015–2016 годах [42]. Примечательно, что тайские лошадиноподобные линии обладали разными генами NSP4: один бычий, а другой человекоподобный [37].Поскольку мы не уверены, к какому из этих штаммов принадлежат наши штаммы, в будущем можно будет провести анализ последовательности всего генома лошадиноподобных штаммов G3, чтобы прояснить события реассортации.
Хотя лошадиноподобный G3P[8] был обнаружен в нескольких странах, частота обнаружения различается. Несколько лошадиных штаммов G3P[8] были обнаружены в Германии, Венгрии, Японии и США [37]. В Австралии и Испании уровень обнаружения был умеренным, от 14,4 до 37,4%. Лошадиноподобный G3[P8] преобладал в Бразилии [42, 43], Индонезии [44] и Таиланде в течение сезонов 2016–2017 гг. [37].В Австралии доминирование лошадиноподобного G3P[8] объясняется высоким селективным давлением, связанным с охватом вакциной Rotarix [45]. Доминирование лошадиноподобного G3P[8] в Таиланде и Венгрии также объясняется селективным давлением, вызванным вакциной, хотя Rotarix доступен только на частном рынке и имеет более низкий национальный охват в этих двух странах [45]. Кроме того, доминирование G3P[8] в Испании также связано с селективным давлением, вызванным вакциной, хотя RotaTeq в основном использовался там [45].В Малайзии национальный охват ротавирусной вакциной неизвестен [46]. Поскольку испытания в Малайзии не проводились, неясно, насколько эффективны эти вакцины в местных условиях.
Доминирование лошадиноподобного G3P[8] в Таиланде и Венгрии также объясняется селективным давлением, вызванным вакциной, хотя Rotarix доступен только на частном рынке и имеет более низкий национальный охват в этих двух странах [45]. Кроме того, доминирование G3P[8] в Испании также связано с селективным давлением, вызванным вакциной, хотя RotaTeq в основном использовался там [45].В Малайзии национальный охват ротавирусной вакциной неизвестен [46]. Поскольку испытания в Малайзии не проводились, неясно, насколько эффективны эти вакцины в местных условиях.
Чтобы пролить свет на эффективность вакцины, мы сравнили антигенные эпитопы наших штаммов G3 и лошадиных штаммов G3 с эпитопами вакцинного штамма RotaTeq G3 и выявили ряд замен. Хотя количество замен в эпитопе 7-1а было небольшим, в эпитопе 7-1b было обнаружено несколько замен (аа208-223), что могло привести к десятикратному увеличению устойчивости к связыванию нейтрализующего антитела [47]. .Также известно, что замена K238N в этом эпитопе связана с потенциальным N -связанным сайтом гликозилирования [48], который предотвращает нейтрализующую активность антител [49].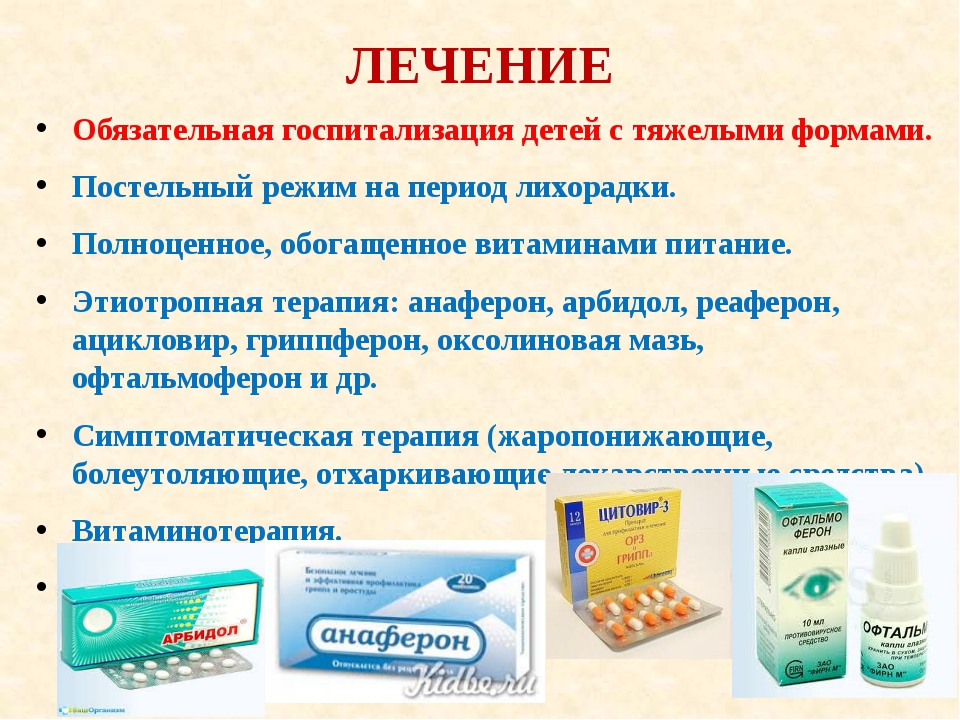 Замена (K238N) ранее была идентифицирована у бельгийских [48], иранских [50], российских [51] и тунисских [52] штаммов. Аминокислотные замены в остатках 100, 146, 148, 150, 188, 190, 194, 180, 183, 114, 116, 133, 135, 87, 88, 89 вызывают уклонение от нейтрализации моноклональными антителами [53]. .В этом исследовании VP4 штаммов Sabahan G3 и лошадиных штаммов G3, которые подверглись заменам в аа146, 150, 88, 89, потенциально могут избежать нейтрализации антителами, индуцированными вакциной.
Замена (K238N) ранее была идентифицирована у бельгийских [48], иранских [50], российских [51] и тунисских [52] штаммов. Аминокислотные замены в остатках 100, 146, 148, 150, 188, 190, 194, 180, 183, 114, 116, 133, 135, 87, 88, 89 вызывают уклонение от нейтрализации моноклональными антителами [53]. .В этом исследовании VP4 штаммов Sabahan G3 и лошадиных штаммов G3, которые подверглись заменам в аа146, 150, 88, 89, потенциально могут избежать нейтрализации антителами, индуцированными вакциной.
Как и во многих других странах, в Малайзии распространенность ротавирусной инфекции варьируется в зависимости от региона. Предыдущие исследования показали, что распространенность ротавирусной инфекции является самой высокой в Пенанге (54%), затем следуют Кучинг, Саравак (46%) и Куала-Лумпур (22–46%), затем Джохор-Бару, Джохор (18%). самый низкий в Кота-Кинабалу (16%) [26].Этот предыдущий результат из Кота-Кинабалу согласуется с нашими результатами. Хотя возрастная распространенность ротавирусной инфекции различается между развитыми и развивающимися регионами, она обычно встречается у детей в возрасте 4–23 месяцев [27, 54–56].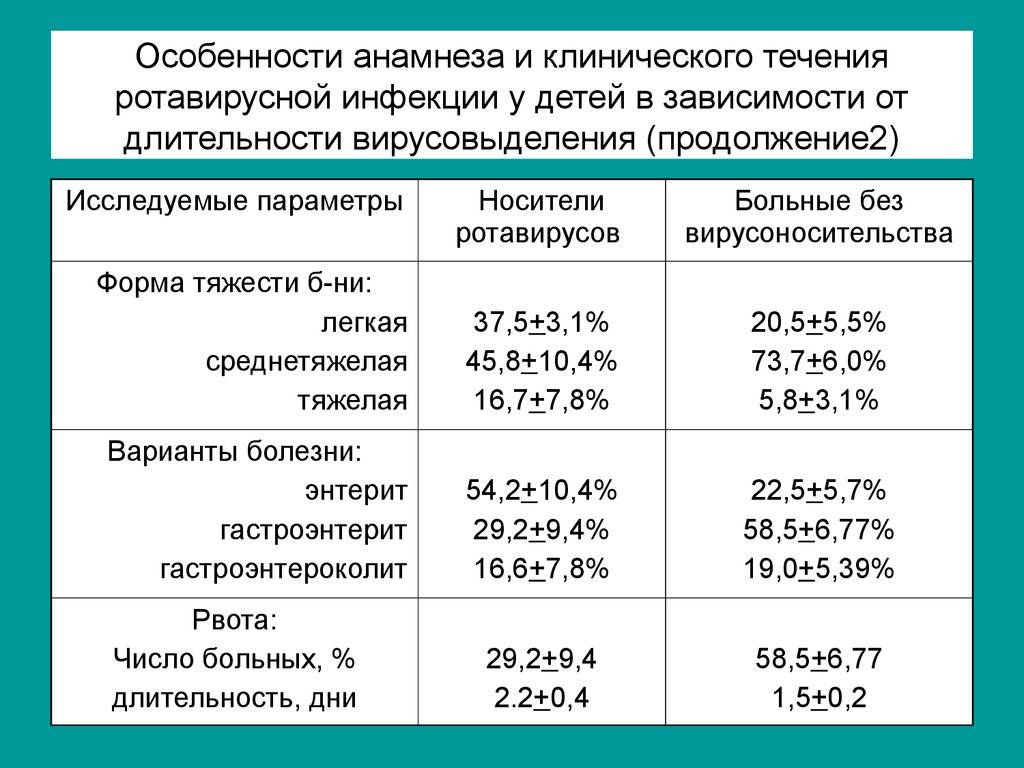 Мы обнаружили большинство ротавирусных инфекций у детей в возрасте 6–23 месяцев (рис. 1) с пиком в возрасте 12–17 месяцев. Эти результаты аналогичны результатам исследования, проведенного в Бангладеш, где ротавирус в основном поражал детей в возрасте 3–23 месяцев и достиг пика в возрасте 6–11 месяцев [11].
Мы обнаружили большинство ротавирусных инфекций у детей в возрасте 6–23 месяцев (рис. 1) с пиком в возрасте 12–17 месяцев. Эти результаты аналогичны результатам исследования, проведенного в Бангладеш, где ротавирус в основном поражал детей в возрасте 3–23 месяцев и достиг пика в возрасте 6–11 месяцев [11].
Число ротавирусных инфекций было самым низким у пациентов в возрасте до 3 месяцев, предположительно из-за наличия материнских антител от грудного вскармливания. Как было обнаружено в нашем исследовании, пациенты мужского пола чаще страдают острым ротавирусным гастроэнтеритом [57–59]. Подобно находкам в странах Индийского субконтинента [11,34], G12, обнаруженный в Сабахе, был в сочетании с P[6]. Однако наши штаммы G12 образовали независимый подкластер со штаммами G12P[6] из Китая.Генотип P[6] в основном распространен у свиней [60–62]. Исследования показали, что редкие ротавирусы с генотипом P[6] появились в популяциях человека в результате генетической рекомбинации ротавирусов человека и свиней [36]. Филогенетический анализ также показал, что штамм Sabahan P[6] был похож на штамм P[6] человека, а не на штамм P[6] свиньи, хотя P[6] человека изначально был получен из штамма P[6] свиньи.
Филогенетический анализ также показал, что штамм Sabahan P[6] был похож на штамм P[6] человека, а не на штамм P[6] свиньи, хотя P[6] человека изначально был получен из штамма P[6] свиньи.
G9P[8] является пятым наиболее распространенным генотипом G в мире и одним из распространенных генотипов, циркулирующих в развивающихся странах [63,64].В настоящем исследовании G9 не был идентифицирован; однако генотип G9 был идентифицирован ранее как преобладающий генотип в Джохоре, Западная Малайзия [23].
Еще одним важным открытием в этом исследовании является идентификация штамма G8P[8]. Неожиданное появление штамма ротавируса G8 впервые в Малайзии повысило эпидемиологическое значение этого штамма. Первоначально G8 была обнаружена в соседней Индонезии [65], а затем и в других странах [66–69], но никогда не регистрировалась в Малайзии.В Африке детские инфекции, вызванные штаммами G8, более распространены, составляя 5–20% штаммов, и часто связаны с P[6], P[4] или P[8] [70]. Идентификация близкородственных штаммов G8P[8] во Вьетнаме, Японии и Таиланде указывает на то, что они распространяются в Азии [69,71,72], предполагая общее происхождение. Согласно анализу последовательности VP7, штаммы G8 из Азии связаны со штаммами животных и более отдаленно со штаммами G8 из Африки, где исторически этот генотип выявлялся чаще [69].Фактически, полногеномный анализ репрезентативного штамма G8, полученного во время вспышки 2014 года в Японии, показал, что он возник в результате рекомбинации сегментов генома ротавируса человека, овцы и крупного рогатого скота [73]. Было высказано предположение, что высокий охват вакцинацией сыграл значительную роль в недавнем появлении штаммов G8 в Австралии [45].
Идентификация близкородственных штаммов G8P[8] во Вьетнаме, Японии и Таиланде указывает на то, что они распространяются в Азии [69,71,72], предполагая общее происхождение. Согласно анализу последовательности VP7, штаммы G8 из Азии связаны со штаммами животных и более отдаленно со штаммами G8 из Африки, где исторически этот генотип выявлялся чаще [69].Фактически, полногеномный анализ репрезентативного штамма G8, полученного во время вспышки 2014 года в Японии, показал, что он возник в результате рекомбинации сегментов генома ротавируса человека, овцы и крупного рогатого скота [73]. Было высказано предположение, что высокий охват вакцинацией сыграл значительную роль в недавнем появлении штаммов G8 в Австралии [45].
Обнаружение 11 различных электроферотипов среди 34 электрофоротипированных образцов в нашем исследовании может указывать на значительное разнообразие ротавирусов, циркулирующих в штате Сабах, по сравнению с Турцией (5/38) [27], Шри-Ланкой (18/74) [35], Гонконгом ( 35/432) [74], Бутан (10/38) [34] и Бангладеш (15/88) [11]. Хотя причина большого разнообразия ротавирусов в штате Сабах неизвестна, это указывает на высокую скорость взаимодействия между различными штаммами, которые могут быть причиной реассортантных штаммов. Поддержку этому предположению также дает филогенетический анализ генов VP7 и VP4 различных штаммов. Некоторые из компонентов VP7 и VP4 произошли от одних и тех же штаммов, в то время как произошли от разных штаммов, что указывает на рекомбинацию генов. Факторы, лежащие в основе большого разнообразия штаммов и необычного распределения генотипов, обнаруженных в Сабахе, сложны.
Хотя причина большого разнообразия ротавирусов в штате Сабах неизвестна, это указывает на высокую скорость взаимодействия между различными штаммами, которые могут быть причиной реассортантных штаммов. Поддержку этому предположению также дает филогенетический анализ генов VP7 и VP4 различных штаммов. Некоторые из компонентов VP7 и VP4 произошли от одних и тех же штаммов, в то время как произошли от разных штаммов, что указывает на рекомбинацию генов. Факторы, лежащие в основе большого разнообразия штаммов и необычного распределения генотипов, обнаруженных в Сабахе, сложны.
Большое количество иммигрантов без документов из соседней Индонезии и Филиппин. Эти перемещения людей могут способствовать возникновению разнообразия в генофонде ротавируса Сабахана. Кроме того, в Сабахе проживает 32 различных этнических группы со своим различным образом жизни. Некоторые из них, особенно в сельской местности, имеют тесный контакт с животными, что создает возможности для смены видов. Поэтому постоянный надзор за циркулирующими штаммами ротавируса в штате Сабах важен не только для наблюдения за распределением генотипов до и после вакцинации, но и для наблюдения за появлением новых реассортантных штаммов.
Выводы
В штате Сабах ротавирус в основном поражает детей в возрасте до двух лет. Преобладающим ротавирусом, циркулирующим среди детей в этом исследовании, был лошадиный G3P[8] с коротким электроферотипом. Другими генотипами, циркулирующими среди детей Сабаха, были G3P[8], G1P[8], G12P[6] и G8P[8]. Циркулирующие генотипы были филогенетически разнообразны и родственны штаммам из разных стран. Ряд электроферотипов также наблюдался среди штаммов ротавируса Сабахана.Эти результаты показывают, что в штаммах из Сабаха происходит значительный генетический обмен. По сравнению с вакцинным штаммом RotaTeq антигенные эпитопы, присутствующие на VP7 и VP4 Sabahan G3 и лошадиноподобного G3, значительно различались. Непрерывный эпиднадзор за штаммами ротавируса необходим для мониторинга циркулирующих генотипов ротавируса до и после введения ротавирусной вакцины в штате Сабах.
Благодарности
Авторы выражают благодарность Генеральному директору Министерства здравоохранения Малайзии за разрешение опубликовать эту статью.
Каталожные номера
- 1. Кинг А.М., Лефковиц Э., Адамс М.Дж., Карстенс Э.Б., редакторы. Таксономия вирусов: девятый отчет Международного комитета по таксономии вирусов. Эльзевир; 2011.
- 2. Шундермарк-ван де Вен Э., Ван Ранст М., де Брюин В., ван ден Хурк П., Зеллер М., Маттейнссенс Дж. и др. Колония кроликов, зараженная бычьим штаммом ротавируса G6P [11]. Вет микробиол. 2013;166(1–2):154–64. пмид:23830050
- 3. Харрисон SC, Дормитцер PR.Структура и функция ротавирусной частицы. В: Свенссон Л., Дессельбергер У., редакторы. Вирусный гастроэнтерит. Академическая пресса; 2016. С. 89–102.
- 4. Хосино Ю., Серено М.М., Мидтан К., Флорес Дж., Капикян А.З., Чанок Р.М. Независимая сегрегация двух антигенных специфичностей (VP3 и VP7), участвующих в нейтрализации инфекционности ротавируса. Proc Natl Acad Sci USA. 1985; 82 (24): 8701–4. пмид:3001716
- 5.
Эстес М.К., Коэн Дж.Э. Структура и функция генов ротавируса.
 Microbiol Rev. 1989;53(4):410–49. пмид:2556635
Microbiol Rev. 1989;53(4):410–49. пмид:2556635 - 6. Садик А., Бостан Н., Бохари Х., Маттейнссенс Дж., Йинда К.С., Раза С. и др. Молекулярная характеристика генотипов ротавирусов группы А человека, циркулировавших в Равалпинди, Исламабад, Пакистан, в 2015–2016 гг. ПлоС один. 2019;14(7):e0220387. пмид:31361761
- 7. Тамим С., Хасан Ф., Маттейнссенс Дж., Шариф С., Шаукат С., Алам М.М. и др. Эпидемиология и филогенетический анализ генов VP7 и VP4 ротавирусов, циркулирующих в Равалпинди, Пакистан, в 2010 г.Заразить Генет Эвол. 2013; 14:161–8. пмид:23187023
- 8. Ахмед К., Накагоми Т., Накагоми О. Выделение и молекулярная характеристика природного реассортанта гена неструктурного белка 5 (NSP5) ротавируса группы А серотипа G2P [4] с длинной РНК. J Med Virol. 2005;77(2):323–30. пмид:16121367
- 9.
Theamboonlers A, Maiklang O, Thongmee T, Chieochansin T, Vuthitanachot V, Poovorawan Y. Полный анализ генома редкого человеческого ротавируса G3P [9], выдающего себя за AU-1-подобный штамм.
 СпрингерПлюс. 2013;2(1):569. пмид:24255863
СпрингерПлюс. 2013;2(1):569. пмид:24255863 - 10. Накагоми Т., Нгуен М.К., Гаучан П., Агбемабисе К.А., Канеко М., До Л.П. и др. Эволюция DS-1-подобных G1P [8] двухгенных реассортантных штаммов ротавируса А, вызывающих гастроэнтерит у детей во Вьетнаме в 2012/2013 гг. Арх Вирол. 2017;162(3):739–48. пмид:27878638
- 11. Ахмед К., Ахмед С., Митуи М.Т., Рахман А., Кабир Л., Ханнан А. и др. Молекулярная характеристика гена VP7 ротавирусов человека из Бангладеш.Гены вирусов. 2010;40(3):347–56. пмид:20217207
- 12. Всемирная организация здравоохранения. Ротавирусные вакцины. Документ с изложением позиции ВОЗ — январь 2013 г. Wkly Epidemiol Rec. 2013;88(05): 49–64.
- 13. Баярд В., ДеАнтонио Р., Контрерас Р., Тинахеро О., Кастрехон М.М., Ортега-Барриа Э. и др. Влияние ротавирусной вакцинации на смертность от детского гастроэнтерита и выписку из больниц в Панаме. Int J Infect Dis. 2012;16(2):e94–8. пмид:22154592
- 14.
 Гастанадуй П.А., Курнс А.Т., Парашар У.Д., Лопман Б.А.Госпитализации по поводу гастроэнтерита у детей старшего возраста и взрослых в США до и после вакцинации младенцев против ротавирусной инфекции. ДЖАМА. 2013;310(8):851–3. пмид:23982372
Гастанадуй П.А., Курнс А.Т., Парашар У.Д., Лопман Б.А.Госпитализации по поводу гастроэнтерита у детей старшего возраста и взрослых в США до и после вакцинации младенцев против ротавирусной инфекции. ДЖАМА. 2013;310(8):851–3. пмид:23982372 - 15. Дессельбергер У. Различия в эффективности ротавирусной вакцины по странам: вероятные причины и способствующие факторы. Возбудители. 2017;6(4):65. пмид:29231855
- 16. Soares-Weiser K, Bergman H, Henschke N, Pitan F, Cunliffe N. Вакцины для профилактики ротавирусной диареи: вакцины в использовании.Кокрановская система базы данных, ред. 2019(10).
- 17. Джордж С., Джаган О.А., Бай С., Чанди С. Генетическое разнообразие штаммов ротавируса в эпоху вакцинации: экспериментальное исследование в Центральной Керале, Индия. J Clin Diagn Res. 2018;12(9).
- 18.
Наяк М.К., Банерджи А., Саркар Р., Митра С., Датта К., Гангули Н. и др. Генетическая характеристика ротавирусов группы А среди детей в восточной Индии в 2014–2016 гг.
 : Филодинамика совместно циркулирующих генотипов. вакцина. 2019;37(45):6842–56.пмид:31543416
: Филодинамика совместно циркулирующих генотипов. вакцина. 2019;37(45):6842–56.пмид:31543416 - 19. Тейт Дж. Э., Бертон А. Х., Босчи-Пинто С., Стил А. Д., Дьюк Дж., Парашар УД. Оценка смертности от ротавирусной инфекции у детей в возрасте до 5 лет во всем мире за 2008 г. до введения всеобщих программ вакцинации против ротавирусной инфекции: систематический обзор и метаанализ. Ланцет Infect Dis. 2012;12(2):136–41. пмид:22030330
- 20. Котлов К.Л. Бремя и этиология диарейных заболеваний в развивающихся странах. Педиатр Клин Норт Ам.2017;64(4):799–814. пмид:28734511
- 21. Loganathan T, Ng CW, Lee WS, Jit M. Скрытое медицинское и экономическое бремя ротавирусного гастроэнтерита в Малайзии. Pediatr Infect Dis J. 2016;35(6):601–6. пмид:27008464
- 22. Lee WS, Lim BT, Chai PF, Kirkwood CD, Lee JK. Генотипы ротавируса в Малайзии и всеобщая ротавирусная вакцинация. Hum Вакцина Иммунотер. 2012;8(10):1401–6. пмид:23022710
- 23.
 Зуридах Х., Кирквуд К.Д., Епископ РФ, Богданович-Сакран Н., Яп К.Л.Молекулярная характеристика и эпидемиология изолятов ротавируса, полученных от детей с диареей в Малайзии. Med J Малайзия. 2009;64(3):193–6. пмид:20527266
Зуридах Х., Кирквуд К.Д., Епископ РФ, Богданович-Сакран Н., Яп К.Л.Молекулярная характеристика и эпидемиология изолятов ротавируса, полученных от детей с диареей в Малайзии. Med J Малайзия. 2009;64(3):193–6. пмид:20527266 - 24. Хунг Л.С., Вонг С.Л., Чан Л.Г., Росли Р., Нг А.Н., Бреси Дж.С. Эпидемиология и характеристика штаммов ротавирусной диареи в Малайзии. Int J Infect Dis. 2006;10(6):470–4. пмид:17046306
- 25. Хсу В.П., Рахман Х.Б., Вонг С.Л., Ибрагим Л.Х., Юсофф А.Ф., Чан Л.Г. и др. Оценки бремени ротавирусной инфекции в Малайзии.J заразить дис. 2005; 192 (Приложение_1): S80–6. пмид:16088810
- 26. Го К.Т., Чеа П.К., Су Т.Л., Ли В.С. Эпидемиология и бремя детской ротавирусной инфекции в больнице третичного уровня в штате Сабах, Малайзия. Med J Малайзия. 2009;64(2):146–9. пмид:20058575
- 27.
Боздайи Г., Доган Б., Далгич Б., Бостанджи И., Сари С., Батталоглу Н.О. и др. Разнообразие ротавируса человека G9 среди детей в Турции.
 J Med Virol. 2008;80(4):733–40. пмид:18297696
J Med Virol. 2008;80(4):733–40. пмид:18297696 - 28.Гувеа В., Гласс Р.И., Вудс П., Танигучи К., Кларк Х.Ф., Форрестер Б. и др. Амплификация полимеразной цепной реакцией и типирование нуклеиновой кислоты ротавируса из образцов стула. Дж. Клин Микробиол. 1990;28(2):276–82. пмид:2155916
- 29. Гунасена С.У., Накагоми О.С., Исегава Ю.Ю., Кага Э.И., Накагоми Т., Стил А.Д. и др. Относительная частота аллелей гена VP4 среди ротавирусов человека, выявленных за 10-летний период (1982–1991 гг.) у японских детей с диареей. Дж. Клин Микробиол.1993;31(8):2195–7. пмид:8396591
- 30. Ватанабэ М., Накагоми Т., Кошимура Ю., Накагоми О. Прямые доказательства рекомбинации сегментов генома между одновременно циркулирующими штаммами ротавируса человека. Арх Вирол. 2001;146(3):557–70. пмид:11338390
- 31.
Koshimura Y, Nakagomi T, Nakagomi O. Относительная частота серотипов G ротавирусов, выздоровевших от госпитализированных детей с диареей: 10-летнее исследование (1987–1996) в Японии с обзором данных, собранных во всем мире.
 Микробиол Иммунол. 2000;44(6):499–510. пмид:10941933
Микробиол Иммунол. 2000;44(6):499–510. пмид:10941933 - 32. Ахмед К., Анх Д.Д., Накагоми О. Ротавирус G5P [6] у ребенка с диареей, Вьетнам. Эмердж Инфекция Дис. 2007;13(8):1232. пмид:17953100
- 33. Учида Р., Пандей Б.Д., Шерчанд Дж.Б., Ахмед К., Йокоо М., Накагоми Т. и др. Молекулярная эпидемиология ротавирусной диареи среди детей и взрослых в Непале: обнаружение штаммов G12 с P [6] или P [8] и штамма G11P [25]. Дж. Клин Микробиол. 2006;44(10):3499–505.пмид:17021073
- 34. Вангчук С., Митуи М.Т., Церинг К., Яхиро Т., Бандхари П., Зангмо С. и др. Доминирование новых генотипов G9 и G12 и полиморфизма VP7 и VP4 ротавирусов у бутанских детей с тяжелой диареей до введения вакцины. ПлоС один. 2014;9(10):e110795. пмид:25330070
- 35.
Ахмед К., Батувантхудаве Р., Чандрасена Т.Н., Митуи М.Т., Раджиндраджит С., Галагода Г. и др. Ротавирусные инфекции с множественными появляющимися генотипами в Шри-Ланке.Арх Вирол. 2010;155(1): 71–5.
 пмид:19921392
пмид:19921392 - 36. Яхиро Т., Такаки М., Чандрасена Т.Н., Раджиндраджит С., Иха Х., Ахмед К. Реассортантный ротавирус человека и свиньи, генерируемый множественными событиями реассортации у шри-ланкийского ребенка с диареей. Заразить Генет Эвол. 2018;65: 170–86. пмид:30055329
- 37. Тачароенмуанг Р., Комото С., Гунтапонг Р., Упачай С., Сингчай П., Иде Т. и др. Высокая распространенность лошадиного G3P [8] ротавируса у детей и взрослых с острым гастроэнтеритом в Таиланде.J Med Virol. 2020;92(2):174–86. пмид:31498444
- 38. Мазид Р., Аунг М.С., Пол С.К., Ахмад Ф.У., Алам М., Али М.А. и др. Возрождение и преобладание ротавирусов человека G3P [8] в северо-центральной части Бангладеш, 2018–2019 гг. Новые микробы Новые инфекции. 2020;33: 100621. pmid:311
- 39.
Банерджи А., Ло М., Индвар П., Деб А.К., Дас С., Манна Б. и др. Всплеск и распространение ротавирусов G3 в Восточной Индии (2014–2016 гг.): Анализ полного генома выявил гетерогенность внутри Wa-подобного геномного созвездия.
 Заразить Генет Эвол. 2018; 63: 158–74. пмид:29842980
Заразить Генет Эвол. 2018; 63: 158–74. пмид:29842980 - 40. Myat TW, Thu HM, Lin H, Hom NS, Khine WK, Kham MM, et al. Эпидемиологический надзор за ротавирусным гастроэнтеритом (2015–2017 гг.): эпидемиология и циркулирующие генотипы ротавируса в период введения доротавирусной вакцины в Мьянме. Представитель по расследованию эпидемий, 2019;12(3).
- 41. Коули Д., Нирвати Х., Донато С.М., Богданович-Сакран Н., Бонифаций К., Кирквуд К.Д. и др. Молекулярная характеристика штаммов ротавируса, обнаруженных в ходе клинических испытаний ротавирусной вакцины для новорожденных (RV3-BB) в Индонезии.вакцина. 2018;36(39):5872–8. пмид:30145099
- 42. Лучс А., Килли А., Морилло С., Боэн Л., Кармона Р.Д., Тименецки М.Д. Распространение появляющегося штамма ротавируса с генетической основой, похожего на G3P [8] лошадиного типа [8] DS-1, в Бразилии. Джей Ген Вирол. 2018;73: 190. pmid:30457517
- 43.
Герра С.Ф., Соарес Л.С., Лобо П.
 С., Джуниор Э.Т., Джуниор Э.К., Безерра Д.А. и др. Обнаружение нового ротавируса G3, подобного лошадям, связанного с острым гастроэнтеритом в Бразилии. Джей Ген Вирол. 2016 97(12):3131–8.пмид:276
С., Джуниор Э.Т., Джуниор Э.К., Безерра Д.А. и др. Обнаружение нового ротавируса G3, подобного лошадям, связанного с острым гастроэнтеритом в Бразилии. Джей Ген Вирол. 2016 97(12):3131–8.пмид:276 - 44. Утсуми Т., Вахьюни Р.М., Доан Ю.Х., Динана З., Соэгиджанто С., Фуджии Ю. и др. Штаммы ротавируса G3, подобные лошадиным, преобладали среди детей в Индонезии в 2015–2016 гг. Заразить Генет Эвол. 2018; 61: 224–8. пмид:29614325
- 45. Магуайр Дж. Э., Глазго К., Гласс К., Роцо-Фаркас С., Бинс Дж. Э., Шеппард В. и др. Эпидемиология ротавируса и эффективность моновалентной ротавирусной вакцины в Австралии: 2010–2017 гг. Педиатрия. 2019;144(4). пмид:31530719
- 46.Всемирная организация здравоохранения. Малайзия: оценки охвата иммунизацией ВОЗ и ЮНИСЕФ: редакция 2019 г. 2021 г., 15 июля. Доступно по адресу: https://www.who.int/immunization/monitoring_surveillance/data/mys.pdf.
- 47.
Дьялл-Смит М.Л., Лаздиньш И., Трегир Г.
 В., Холмс И.Х. Расположение основных антигенных сайтов, участвующих в нейтрализации серотипа ротавируса. Proc Natl Acad Sci USA. 1986; 83 (10): 3465–8. пмид:2422651
В., Холмс И.Х. Расположение основных антигенных сайтов, участвующих в нейтрализации серотипа ротавируса. Proc Natl Acad Sci USA. 1986; 83 (10): 3465–8. пмид:2422651 - 48. Зеллер М., Паттон Дж. Т., Хейлен Э., Де Костер С., Сиарлет М., Ван Ранст М. и др.Генетический анализ выявил различия в антигенных эпитопах VP7 и VP4 между ротавирусами человека, циркулирующими в Бельгии, и ротавирусами Rotarix и RotaTeq. Дж. Клин Микробиол. 2012;50(3):966–76. пмид:22189107
- 49. Кирквуд С., Масендыч П.Дж., Коулсон Б.С. Характеристики и расположение перекрестно-реактивных и специфичных для серотипа сайтов нейтрализации на VP7 ротавирусов G типа 9 человека. Вирусология. 1993;196(1):79–88. пмид:8395127
- 50.
Мотамеди-Рад М., Фарахманд М., Арашкиа А., Джалилванд С., Шоджа З.Генотипы ротавирусов VP7 и VP4, совместно циркулирующие в Иране, с 2015 по 2017 год: сравнение с убедительными последовательностями вакцинных штаммов Rotarix и RotaTeq перед их использованием для всеобщей массовой вакцинации.
 J Med Virol. 2020;92(8):1110–23. пмид:31774174
J Med Virol. 2020;92(8):1110–23. пмид:31774174 - 51. Морозова О.В., Сашина Т.А., Фомина С.Г., Новикова Н.А. Сравнительная характеристика антигенных эпитопов VP7 и VP4 ротавирусов, циркулирующих в России (Нижний Новгород), и вакцин Ротарикс и РотаТек. Арх Вирол. 2015;160(7):1693–703.пмид:25944143
- 52. Fredj MB, BenHamida-Rebaï M, Heylen E, Zeller M, Moussa A, Kacem S, et al. Секвенирование и филогенетический анализ штаммов ротавируса человека: сравнение антигенных эпитопов VP7 и VP8* между тунисскими и вакцинными штаммами до введения национальной ротавирусной вакцины. Заразить Генет Эвол. 2013; 18: 132–44. пмид:23684631
- 53. Виззи Э., Пиньерос О.А., Оропеса М.Д., Наранхо Л., Суарес Х.А., Фернандес Р. и соавт. Штаммы ротавируса человека, циркулирующие в Венесуэле после введения вакцины: преобладание G2P [4] и повторное появление G1P [8].Вирол Дж. 2017;14(1):58. пмид:28320411
- 54.
Веласкес Р., Кальва Дж.
 Дж., Герреро Л., Масс Д. А., Гласс Р. И., Пикеринг Л. К. и др. Когортное исследование моделей серотипов ротавируса при симптоматических и бессимптомных инфекциях у мексиканских детей. Pediatr Infect Dis J. 1993;12(1):54–61. пмид:8380235
Дж., Герреро Л., Масс Д. А., Гласс Р. И., Пикеринг Л. К. и др. Когортное исследование моделей серотипов ротавируса при симптоматических и бессимптомных инфекциях у мексиканских детей. Pediatr Infect Dis J. 1993;12(1):54–61. пмид:8380235 - 55.
Payne DC, Staat MA, Edwards KM, Szilagyi PG, Gentsch JR, Stockman LJ, et al. Активный популяционный эпиднадзор за тяжелым ротавирусным гастроэнтеритом у детей в США.Педиатрия. 2008;122(6):1235–43. пмид:1
40
- 56. Аземи М., Бериша М., Исмаили-Джаха В., Колгеджи С., Авдиу М., Якупи Х. и др. Социально-демографические, клинико-лабораторные особенности ротавирусного гастроэнтерита у детей, находящихся на лечении в детской поликлинике. Матер Социомед. 2013;25(1):9. пмид:23678334
- 57. Бораде А., Байс А.С., Бапат В., Донгаде Р. Характеристики ротавирусного гастроэнтерита у госпитализированных детей в Пуне. Индийская J Med Sci. 2010;64(5). пмид:22842320
- 58.Джунаид С.А., Умех С., Олабоде А.
 О., Банда Дж.М. Заболеваемость ротавирусной инфекцией у детей с гастроэнтеритом, посещающих учебную больницу при университете Джос, Нигерия. Вирол Дж. 20118(1):233. пмид: 21575246
О., Банда Дж.М. Заболеваемость ротавирусной инфекцией у детей с гастроэнтеритом, посещающих учебную больницу при университете Джос, Нигерия. Вирол Дж. 20118(1):233. пмид: 21575246 - 59. Хегази М.А., Сайед М.Х., Синди Х.Х., Бехит О.Е., Эль-Дик Б.С., Альшудри Ф.М. и др. Остается ли ротавирус основной причиной диареи у госпитализированных детей после включения ротавирусной вакцины в национальную программу иммунизации Саудовской Аравии? Лекарство. 2017; 96(15) e6574.пмид:28403085
- 60. Мартелла В., Чиарлет М., Баньяи К., Лоруссо Э., Ариста С., Лавацца А. и др. Идентификация штаммов ротавируса свиней группы А, несущих новый генотип VP4 (P), в итальянских стадах свиней. Дж. Клин Микробиол. 2007;45(2):577–80. пмид:17122003
- 61. Collins PJ, Martella V, Sleator RD, Fanning S, O’shea H. Обнаружение и характеристика ротавируса группы A у бессимптомных поросят в южной Ирландии. Арх Вирол. 2010;155(8):1247–59. пмид:20526785
- 62.
 Папп Х., Ласло Б., Якаб Ф., Ганеш Б., Де Грация С., Маттейнссенс Дж. и др. Обзор штаммов ротавируса группы А, обнаруженных у свиней и крупного рогатого скота. Вет микробиол. 2013;165(3–4):190–9. пмид:23642647
Папп Х., Ласло Б., Якаб Ф., Ганеш Б., Де Грация С., Маттейнссенс Дж. и др. Обзор штаммов ротавируса группы А, обнаруженных у свиней и крупного рогатого скота. Вет микробиол. 2013;165(3–4):190–9. пмид:23642647 - 63. Интамасо У., Поомипак В., Чутоам П., Чотчуанг П., Санкхам В., Срисофа С. Распределение генотипов и филогенетический анализ ротавирусов в Таиланде и появление необычных генотипов. Арч Клин Микробиол. 2017;8(4):60–70.
- 64. Heylen E, Likele BB, Zeller M, Stevens S, De Coster S, Conceição-Neto N, et al.Эпиднадзор за ротавирусом в Кисангани, Демократическая Республика Конго, выявил большое количество необычных генотипов и генных сегментов животного происхождения у непривитых детей с симптомами. ПлоС один. 2014;9(6): e100953. пмид: 24968018
- 65. Мацуно С., Хасэгава А., Мукояма А., Иноуэ С. Кандидат на новый серотип ротавируса человека. Дж Вирол. 1985; 54 (2): 623–4. пмид: 2985825
- 66.
Мукерджи А.
 , Маллик С., Деб А.К., Панда С., Чавла-Саркар М. Первое сообщение о ротавирусном гастроэнтерите G8P [4] человека в Индии: свидетельство зоонозной передачи от жвачных животных человеку.J Med Virol. 2013;85(3):537–45. пмид:23280762
, Маллик С., Деб А.К., Панда С., Чавла-Саркар М. Первое сообщение о ротавирусном гастроэнтерите G8P [4] человека в Индии: свидетельство зоонозной передачи от жвачных животных человеку.J Med Virol. 2013;85(3):537–45. пмид:23280762 - 67.
Хоке С.А., Кобаяши М., Таканаши С., Анвар К.С., Ватанабэ Т., Хамрин П. и др. Роль ротавирусной вакцинации против нового штамма ротавируса G8P [8], вызвавшего вспышку в центральной Японии. вакцина. 2018;36(1):43–9. пмид:2
32
- 68. Лусеро Ю., О’Райан М., Липароти Г., Уэрта Н., Мамани Н., Рамани С. и др. Преобладание ротавируса G8P [8] в городе Чили, стране без вакцинации против ротавируса. J Педиатр.2019; 204: 298–300. пмид:30297290
- 69. Кондо К., Цугава Т., Оно М., Охара Т., Фудзибаяси С., Тахара Ю. и др. Клинические и молекулярные характеристики вспышечного штамма ротавируса человека G8P [8], Япония, 2014 г. Emerg Infect Dis. 2017;23(6):968. пмид: 28518031
- 70.
Делогу Р.
 , Прести А.Л., Руджери Ф.М., Целла Э., Джованетти М., Чиккоцци М. и др. Полногеномная характеристика ротавируса G8P [8], появившегося среди детей с диареей в Хорватии в 2006 г. J Clin Microbiol.2013;51(5):1583–1588. пмид:23426928
, Прести А.Л., Руджери Ф.М., Целла Э., Джованетти М., Чиккоцци М. и др. Полногеномная характеристика ротавируса G8P [8], появившегося среди детей с диареей в Хорватии в 2006 г. J Clin Microbiol.2013;51(5):1583–1588. пмид:23426928 - 71. Hoa-Tran TN, Nakagomi T, Vu HM, Do LP, Gauchan P, Agbemabiese CA, et al. Резкое появление и преобладание во Вьетнаме штаммов ротавируса А, обладающих бычьим G8 на фоне DS-1. Арх Вирол. 2016;161(2):479–82. пмид:26586330
- 72. Тачароенмуанг Р., Комото С., Гунтапонг Р., Иде Т., Синчай П., Упачай С. и др. Полная характеристика генома новых DS-1-подобных штаммов ротавируса G8P [8], появившихся в Таиланде: рекомбинация генных сегментов ротавирусов крупного рогатого скота и человека в новых DS-1-подобных межгеногрупповых реассортантных штаммах.ПЛОС Один. 2016;11(11): e0165826. пмид: 27802339
- 73.
Agbemabiese CA, Nakagomi T, Doan YH, Nakagomi O. Полногеномная совокупность первого штамма ротавируса G8 человека, обнаруженного в Японии.
 Заразить Генет Эвол. 2015; 35: 184–93. пмид:26275468
Заразить Генет Эвол. 2015; 35: 184–93. пмид:26275468 - 74. Митуи М.Т., Чан П.К., Нельсон Э.А., Леунг Т.Ф., Нишизоно А., Ахмед К. Совместное доминирование ротавирусов G1 и новых ротавирусов G3 в Гонконге: трехлетнее наблюдение в трех крупных больницах. Джей Клин Вирол. 2011;50(4):325–33.пмид: 21330195
Антисептики для рук как средство профилактики пандемии COVID-19, его характеристики и вредное воздействие: обзор | Журнал Египетской ассоциации общественного здравоохранения
Центры по контролю и профилактике заболеваний. Руководство пользователя CDC Clear Communication Index. Июль 2014 г. Доступно по адресу: https://www.cdc.gov/ccindex/tool/index.html [Проверено 13 февраля 2021 г.]
Britannica. Санитайзер для рук. Определение, ингредиенты, типы и факты.Британика. Доступно по адресу: https://www.britannica.com/topic/hand-sanitizer [Проверено 13 февраля 2021 г.]
Dyer DL, Gerenraich KB, Wadhams PS. Тестирование нового безалкогольного дезинфицирующего средства для рук для борьбы с инфекцией. АОРН Дж. 1998;68(2):239–51. https://doi.org/10.1016/S0001-2092(06)62517-9
Бартлетт Дж.Г. Руководство общественного здравоохранения по обеспечению готовности на уровне сообществ и реагированию на тяжелый острый респираторный синдром (ТОРС). Infect Dis Clin Pract. 2004;12(3):185–7. https://дои.org/10.1097/01.idc.0000129851.34508.48
Университет Флориды. Гигиена рук и дезинфицирующие средства для рук. 2019. Доступно по адресу: https://edis.ifas.ufl.edu/publication/FY732 [По состоянию на 13 февраля 2021 г.]
FDA США. 84 FR 14847 — Безопасность и эффективность потребительских антисептических протираний; противомикробные лекарственные препараты для местного применения, отпускаемые без рецепта. 2019;84(71):3–20 Доступно по адресу: https://www.federalregister. gov/documents/2019/04/12/2019-06791/safety-and-efficientness-of-consumer-antiseptic-rubs-topical -антимикробные-лекарственные-продукты-для [По состоянию на 14 февраля 2021 г.].
gov/documents/2019/04/12/2019-06791/safety-and-efficientness-of-consumer-antiseptic-rubs-topical -антимикробные-лекарственные-продукты-для [По состоянию на 14 февраля 2021 г.].
Информационный центр по наркотикам и ядам Британской Колумбии (BC DPIC). Безопасность дезинфицирующего средства для рук на спиртовой основе. 2010. Доступно по адресу: http://www.dpic.org/article/professional/alcohol-based-hand-sanitizer-safety [По состоянию на 14 февраля 2021 г.]
Голин А.П., Чой Д., Гахари А. Дезинфицирующие средства для рук: обзор ингредиентов, механизмов действия, способов доставки и эффективности против коронавирусов. Am J Infect Control. 2020;48(9):1062–7. https://doi.org/10.1016/j.ajic.2020.06.182
CNBC. Коронавирус: история дезинфицирующего средства для рук и почему это важно. 2020. Доступно по адресу: https://www.cnbc.com/2020/03/27/coronavirus-the-history-of-hand-sanitizer-and-why-its-important. html [Проверено 14 февраля 2021 г.]
html [Проверено 14 февраля 2021 г.]
GlanHealth: натуральные дезинфицирующие и дезинфицирующие растворы. История дезинфицирующих средств для рук. Доступно по адресу: https://glanhealth.com/blog/history-of-hand-sanitizers/ [По состоянию на 14 февраля 2021 г.]
McDonnell G, Russell AD.Антисептики и дезинфицирующие средства: активность, действие, стойкость. Clin Microbiol Rev. 1999;12(1):147–79. Доступно по адресу: https://journals.asm.org/doi/full/10.1128/CMR.12.1.147
Haft RJF, Keating DH, Schwaegler T, Schwalbach MS, Vinokur J, Tremaine M, et al. Коррекция прямого воздействия этанола на механизмы трансляции и транскрипции обеспечивает толерантность к этанолу у бактерий. Proc Natl Acad Sci U S A. 2014;111(25):E2576–85. https://doi.org/10.1073/pnas.1401853111
У Ф., Чжао С., Ю. Б., Чен Ю. М., Ван В., Сун З. Г. и др.Новый коронавирус, связанный с респираторным заболеванием человека в Китае. Природа. 2020; 579 (7798): 265–9. https://doi.org/10.1038/s41586-020-2008-3
Природа. 2020; 579 (7798): 265–9. https://doi.org/10.1038/s41586-020-2008-3
Zhou P, Yang X, Lou WXG, Hu B, Zhang L, Zhang W и др. Вспышка пневмонии, связанная с новым коронавирусом вероятного происхождения от летучих мышей. Природа. 2020; 579 (7798): 270–3. https://doi.org/10.1038/s41586-020-2012-7
Olloquequi J. Подверженность COVID-19 при хронической обструктивной болезни легких. Евро Джей Клин Инвест.2020;50(10):1–8. https://doi.org/10.1111/eci.13382
Goldsmith CS, Tatti KM, Ksiazek TG, Rollin PE, Comer JA, Lee WW и др. Ультраструктурная характеристика коронавируса SARS. Эмердж Инфекция Дис. 2004;10(2):320–6. https://doi.org/10.3201/eid1002.030913
Центры по контролю и профилактике заболеваний. Инфекционный контроль. Руководство по дезинфекции и стерилизации. Библиотека руководств. Химические дезинфицирующие средства: Руководство по дезинфекции и стерилизации в медицинских учреждениях. 2008. Доступно по адресу: https://www.cdc.gov/infectioncontrol/guidelines/disinfection/disinfection-methods/chemical.html [По состоянию на 17 февраля 2021 г.]
2008. Доступно по адресу: https://www.cdc.gov/infectioncontrol/guidelines/disinfection/disinfection-methods/chemical.html [По состоянию на 17 февраля 2021 г.]
Всемирная организация здравоохранения. Примерный перечень основных лекарственных средств ВОЗ (апрель 2015 г.). Доступно по адресу: https://www.who.int/groups/expert-committee-on-selection-and-use-of-essential-medicines/essential-medicines-lists [Проверено 17 февраля 2021 г.]
Siddharta A , Pfaender S, Vielle NJ, Dijkman R, Friesland M, Becker B, et al.Вирулицидная активность препаратов, рекомендованных Всемирной организацией здравоохранения, в отношении оболочечных вирусов, включая вирус Зика, лихорадку Эбола и новые коронавирусы. J заразить дис. 2017;215(6):902–6. https://doi.org/10.1093/infdis/jix046
Ларсон Э.Л., Коэн Б., Бакстер К.А. Анализ систем доставки дезинфицирующих средств для рук на спиртовой основе: эффективность пены, геля и салфеток против вируса гриппа A (h2N1) на руках. Am J Infect Control. 2012;40(9):806–9. https://doi.org/10.1016/j.ajic.2011.10.016
Am J Infect Control. 2012;40(9):806–9. https://doi.org/10.1016/j.ajic.2011.10.016
Кампф Г.Эффективность этанола против вирусов при дезинфекции рук. Джей Хосп заражает. 2018;98(4):331–38. https://doi.org/10.1016/j.jhin.2017.08.025
Хаммонд Б., Али Ю., Фендлер Э., Долан М., Донован С. Влияние использования дезинфицирующего средства для рук на пропуски занятий в начальной школе. Am J Infect Control. 2000;28(5):340–6. https://doi.org/10.1067/mic.2000.107276
Дайер Д.Л., Шиндер А., Шиндер Ф. Безалкогольное дезинфицирующее средство для рук мгновенного действия снижает количество прогулов по болезни в начальной школе. Фам Мед.2000;32(9):633–8.
Ансари С.А., Саттар С.А., Спрингторп В.С., Уэллс Г.А., Тостоварик В. Протокол in vivo для проверки эффективности средств для мытья рук против вирусов и бактерий: эксперименты с ротавирусом и кишечной палочкой. Appl Environ Microbiol. 1989;55(12):3113–8. https://doi.org/10.1128/aem.55.12.3113-3118.1989
Appl Environ Microbiol. 1989;55(12):3113–8. https://doi.org/10.1128/aem.55.12.3113-3118.1989
Hübner NO, Hübner C, Wodny M, Kampf G, Kramer A. Эффективность дезинфицирующих средств для рук на спиртовой основе в государственном управлении: влияние на здоровье и работоспособность, связанные с острыми респираторными симптомами и диареей.BMC Infect Dis. 2010;10(1):1–8. https://doi.org/10.1186/1471-2334-10-250
Fung ICH, Cairncross S. Эффективность мытья рук в профилактике атипичной пневмонии: обзор. Троп Мед Int Health. 2006; 11(11):1749–58. https://doi.org/10.1111/j.1365-3156.2006.01734.x
Peeri NC, Shrestha N, Rahman MS, Zaki R, Tan Z, Bibi S, et al. Эпидемии атипичной пневмонии, MERS и нового коронавируса (COVID-19), новейшие и крупнейшие глобальные угрозы здоровью: какие уроки мы извлекли? Int J Эпидемиол.2020;49(3):717–26. https://doi.org/10.1093/ije/dyaa033
Кампф Г., Тодт Д., Пфендер С., Штайнманн Э. Стойкость коронавирусов на неодушевленных поверхностях и их инактивация биоцидными агентами. Джей Хосп заражает. 2020;104(3):246–51. https://doi.org/10.1016/j.jhin.2020.01.0222.
Jing JLJ, Yi TP, Bose RJC, McCarthy JR, Tharmalingam N, Madheswaran T. Дезинфицирующие средства для рук: обзор аспектов состава, побочных эффектов и правил. Общественное здравоохранение Int J Environ Res.2020;17(9). https://doi.org/10.3390/ijerph27093326
USP. Составление дезинфицирующего средства для рук на спиртовой основе во время пандемии COVID-19 и введения. 2020;2019–21. Доступно по адресу: https://www.usp.org/sites/default/files/usp/document/about/public-policy/usp-covid19-handrub.pdf [Проверено 20 февраля 2021 г.]
Всемирная организация здравоохранения. Руководство по местному производству: рекомендованный ВОЗ состав для антисептики рук. 2010 г. , 7 мая. Доступно по адресу: https://www.who.int/publications/i/item/WHO-IER-PSP-2010.5 [По состоянию на 20 февраля 2021 г.]
, 7 мая. Доступно по адресу: https://www.who.int/publications/i/item/WHO-IER-PSP-2010.5 [По состоянию на 20 февраля 2021 г.]
Берарди А., Перинелли Д.Р., Мерчант Х.А., Бишарат Л., Башети И.А., Бонакучина Г. и др. Дезинфицирующие средства для рук в условиях CoViD-19: критический обзор продуктов на спиртовой основе на рынке и подходов к рецептуре в ответ на растущий спрос. Инт Дж Фарм. 2020;584:119431. https://doi.org/10.1016/j.ijpharm.2020.119431
Центры по контролю и профилактике заболеваний. Коронавирусная болезнь 2019 (COVID-19). Как защитить себя и других.2019. пара. 4. Доступно по адресу: https://www.cdc.gov/coronavirus/2019-ncov/prevent-getting-sick/prevention.html [По состоянию на 20 февраля 2021 г.]
Сето В.Х., Цанг Д., Юнг Р.В.Х., Чинг TY, Ng TK, Ho M, et al. Эффективность мер предосторожности против воздушно-капельного и контактного воздействия в профилактике внутрибольничной передачи тяжелого острого респираторного синдрома (ТОРС). Ланцет. 2003;361(9368):1519–20. https://doi.org/10.1016/S0140-6736(03)13168-6
Ланцет. 2003;361(9368):1519–20. https://doi.org/10.1016/S0140-6736(03)13168-6
Manocha S, Walley KR, Russell JA, et al.Тяжелый острый респираторный дистресс-синдром (ТОРС): перспектива интенсивной терапии. Крит Уход Мед. 2003;31(11):2684–92. https://doi.org/10.1097/01.CCM.0000091929.51288.5F
Ionidis G, Hübscher J, Jack T, Becker B, Bischoff B, Todt D, et al. Разработка и вирулицидная активность нового дезинфицирующего средства для рук на спиртовой основе с добавлением мочевины и лимонной кислоты. BMC Infect Dis. 2016;16(1). https://doi.org/10.1186/s12879-016-1410-9
Ансари С.А., Спрингторп В.С., Саттар С.А., Ривард С., Рахман М.Потенциальная роль рук в распространении респираторных вирусных инфекций: исследования вируса парагриппа человека 3 и риновируса 14. J Clin Microbiol. 1991;29(10):2115–9. https://doi.org/10.1128/jcm.29.10.2115-2119.1991
Sattar SA. Микробициды и экологический контроль нозокомиальных вирусных инфекций. Джей Хосп заражает. 2004; 56 (ДОП. 2): 64–9. https://doi.org/10.1016/j.jhin.2003.12.033
Fact.MR. Отчет об исследовании рынка. Рынок дезинфицирующих средств для рук. Размер рынка дезинфицирующих средств для рук, анализ тенденций и отслеживание конкуренции — глобальный анализ рынка с 2021 по 2031 год.2021. Доступно по адресу: https://www.factmr.com/report/4705/hand-sanitizer-market [По состоянию на 23 февраля 2021 г.]
Fortune Business Insights. Анализ COVID-19. Влияние COVID-19 на размер рынка дезинфицирующих средств для рук, долю, отраслевой анализ и региональный прогноз, 2019–2026 гг. 2020. Доступно по адресу: https://www.fortunebusinessinsights.com/impact-of-covid-19-on-hand-sanitizer-market-102719 [По состоянию на 23 февраля 2021 г.]
Weber CT, Ranzan L, Luís L. , Лизеганг М., Триервейлер Л. Ф., Триервейлер Д.О.Модель экономики замкнутого цикла для этанола и дезинфицирующего средства для рук на спиртовой основе из отходов сладкого картофеля в контексте COVID-19. БЖО и ПМ. 2020;17(3):1–12. https://doi.org/10.14488/BJOPM.2020.028
Ф., Триервейлер Д.О.Модель экономики замкнутого цикла для этанола и дезинфицирующего средства для рук на спиртовой основе из отходов сладкого картофеля в контексте COVID-19. БЖО и ПМ. 2020;17(3):1–12. https://doi.org/10.14488/BJOPM.2020.028
Шарки Дж.В. Бензалкония хлорид (BZK) Дезинфицирующие средства для рук во время Covid-19. 2020. Ссылка на источник. Доступно по адресу: https://www.linkedin.com/pulse/benzalkonium-chloride-bzk-hand-sanitizers-during-covid-19-sharkey/ [Проверено 25 февраля 2021 г.]
Bondurant S , Маккинни Т., Бондюран Л., Фитцпатрик Л.Оценка дезинфицирующего средства для рук с хлоридом бензалкония в снижении транзиторного бактериального заражения кожи золотистым стафилококком у медицинских работников. Am J Infect Control. 2020;48(5):522–6. https://doi.org/10.1016/j.ajic.2019.08.030
Томсон Э.Л., Bullied AR. Производство дезинфицирующего средства для рук на основе этанола на пивоварнях во время кризиса COVID-19. MBAA TQ. 2020;57(1):47–52. https://doi.org/10.1094/TQ-57-1-0417-01
MBAA TQ. 2020;57(1):47–52. https://doi.org/10.1094/TQ-57-1-0417-01
Центры по контролю и профилактике заболеваний.Гигиена рук в медицинских учреждениях : обзор. 2002. с. 1–27. Доступно по адресу: https://www.cdc.gov/handhygiene/index.html [Проверено 25 февраля 2021 г.]
Blaney DD, Daly ER, Kirkland KB, Tongren JE, Kelso PT, Talbot EA. Использование дезинфицирующих средств для рук на спиртовой основе как фактор риска вспышек норовируса в учреждениях длительного ухода на севере Новой Англии: с декабря 2006 г. по март 2007 г. Am J Infect Control. 2011;39(4):296–301. https://doi.org/10.1016/j.ajic.2010.10.010
Oughton MT, Loo VG, Dendukuri N, Fenn S, Libman MD.Гигиена рук с мылом и водой лучше, чем протирание спиртом и антисептические салфетки для удаления Clostridium difficile. Infect Control Hosp Epidemiol. 2009;30(10):939–44. https://doi.org/10.1086/605322
Kampf G, Marschall S, Eggerstedt S, Ostermeyer C. Эффективность пены для рук на основе этанола при использовании клинически значимых количеств: перекрестное контролируемое исследование среди здоровых добровольцев. BMC Infect Dis. 2010;10(1):1–5. https://doi.org/10.1186/1471-2334-10-78
Пинхас АР.Кинетическое исследование с использованием испарения различных типов дезинфицирующих средств для рук. J Chem Educ. 2010;87(9):950–1. https://doi.org/10.1021/ed1003492
Coronado GD, Holte SE, Vigoren EM, Griffith WC, Barr DB, Faustman EM, et al. Защищают ли сельскохозяйственных работников методы защиты на рабочем месте и дома? Результаты исследования «Для здоровых детей». J оккупировать Environ Med. 2012;54(9). https://doi.org/10.1097/JOM.0b013e31825902f5
Foddai ACG, Grant IR, Dean M. Эффективность дезинфицирующих средств для рук мгновенного действия против патогенов пищевого происхождения по сравнению с мытьем рук с мылом и водой в условиях приготовления пищи: систематический обзор . J Пищевая защита. 2016;79(6):1040–54. https://doi.org/10.4315/0362-028X.JFP-15-492
J Пищевая защита. 2016;79(6):1040–54. https://doi.org/10.4315/0362-028X.JFP-15-492
Steinmann J, Paulmann D, Becker B, Bischoff B, Steinmann E, Steinmann J. Сравнение вирулицидной активности рук на спиртовой основе дезинфицирующие средства по сравнению с противомикробным мылом для рук in vitro и in vivo. Джей Хосп заражает. 2012;82(4):277–80. https://doi.org/10.1016/j.jhin.2012.08.005
Tuladhar E, Hazeleger WC, Koopmans M, Zwietering MH, Duizer E, Beumer RR. Уменьшение заражения вирусами с подушечек пальцев: мытье рук более эффективно, чем дезинфицирующие средства для рук на спиртовой основе.Джей Хосп заражает. 2015;90(3):226–34. https://doi.org/10.1016/j.jhin.2015.02.019
Vogel L. Дезинфицирующие средства для рук могут увеличить риск норовируса. CMAJ. 2011;183(12):799–800. https://doi.org/10.1503/cmaj.109-3922
Ларсон Э.Л., Хьюз К.А., Пирек Д. Д., Спаркс С.М., Чагатай Э.У., Барткус Д.М. Изменения бактериальной флоры, связанные с повреждением кожи рук медицинского персонала. Am J Infect Control. 1998;26(5):513–21. https://doi.org/10.1016/S0196-6553(98)70025-2
Д., Спаркс С.М., Чагатай Э.У., Барткус Д.М. Изменения бактериальной флоры, связанные с повреждением кожи рук медицинского персонала. Am J Infect Control. 1998;26(5):513–21. https://doi.org/10.1016/S0196-6553(98)70025-2
Lauharanta J, Ojajärvi J, Sarna S, Mäkelä P.Профилактика сухости и экземы рук медперсонала путем очищения эмульсией вместо мытья с мылом. Джей Хосп заражает. 1991;17(3):207–15. https://doi.org/10.1016/0195-6701(91)-W
Lachenmeier DW. Оценка безопасности местного применения этанола на коже и внутри полости рта. J Occup Med Toxicol. 2008;3(1):1–6. https://doi.org/10.1186/1745-6673-3-26
Jones AW, Rajs J. Заметная концентрация этанола в крови после промывания ссадин и порезов кожи хирургическим спиртом.J Анальный токсикол. 1997;21(7):587–8. https://doi.org/10.1093/jat/21.7.587
Al Jawad ST. Чрескожная абсорбция алкоголя и некроз кожи у недоношенного ребенка. Арч Дис Чайлд. 1983; 58(5):395. http://dx.doi.org/10.1136/adc.58.5.395
Арч Дис Чайлд. 1983; 58(5):395. http://dx.doi.org/10.1136/adc.58.5.395
Wilson M, Guru P, Park J. Рецидивирующий молочнокислый ацидоз, вторичный по отношению к проглатыванию дезинфицирующего средства для рук. Индийский Дж. Нефрол. 2015;25(1):57–9. https://doi.org/10.4103/0971-4065.135351
Макбей А.Дж. Токсикологические заключения при отравлениях со смертельным исходом.Клин Хим. 1973;19(4):361–5. Доступно по ссылке: https://pubmed.ncbi.nlm.nih.gov/4574410/.
КАС Статья Google Scholar
Эмади А., Коберли Л. Интоксикация госпитализированного пациента дезинфицирующим средством для рук на основе изопропанола. N Engl J Med. 2007;356(5):530–1. https://doi.org/10.1056/NEJMc063237
Заман Ф., Первез А., Абрео К. Интоксикация изопропиловым спиртом: диагностическая проблема. Am J почек Dis.2002;40(3):e12–1.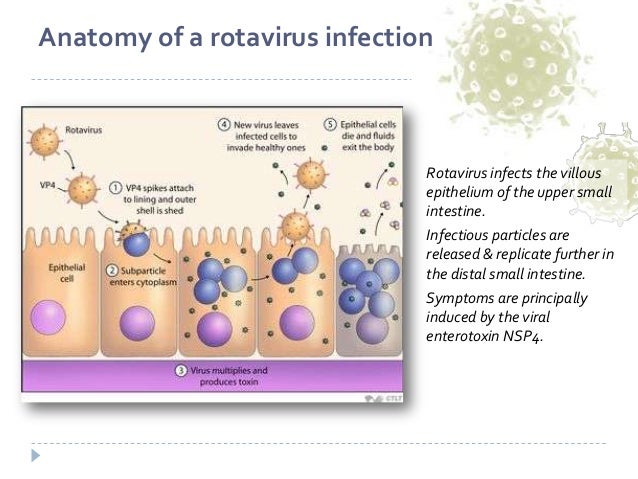 https://doi.org/10.1053/ajkd.2002.34938
https://doi.org/10.1053/ajkd.2002.34938
Департамент здравоохранения и обслуживания пожилых людей штата Нью-Джерси. Информационный бюллетень «Право знать опасные вещества». Изопропиловый спирт, 2016 г. Доступно по адресу: https://nj.gov/health/eoh/rtkweb/documents/fs/1076.pdf [Проверено 3 марта 2021 г.]
Sung J, Cossarini F, Palaiodimos L, Benson B, Мехолли М. Дополнительный кислород приводит к проблемам с пузырями: газовая эмболия воротной вены из-за приема внутрь 3% перекиси водорода. Куреус. 2018;10(2).https://doi.org/10.7759/cureus.2136
Национальный институт охраны труда и здоровья (NIOSH). Пероксид водорода. Доступно по адресу: https://www.cdc.gov/niosh/topics/hydrogen-peroxide/. [По состоянию на 4 марта 2021 г.].
Карр Д. Американская ассоциация токсикологических центров. Энциклопедия токсикологии: третье издание. 2014. с. 172. Доступно по адресу: https://www. aapcc.org/ [Проверено 4 марта 2021 г.]
aapcc.org/ [Проверено 4 марта 2021 г.]
Сантос С., Кишак С., Ван А., Лоу Р., Шир Дж., Волкин А.Зарегистрированные неблагоприятные последствия для здоровья детей в результате приема спиртосодержащих дезинфицирующих средств для рук — США, 2011–2014 гг. ММВР. 2017;66(8):223. http://dx.doi.org/10.15585/mmwr.mm6608a5
Mahmood A, Eqan M, Pervez S, Ahmed H, Bari A, Yasar A, et al. COVID-19 и частое использование дезинфицирующих средств для рук; опасности для здоровья человека и окружающей среды по путям воздействия. Sci Total Environ 2020; 742: 140561. https://doi.org/10.1016/j.scitotenv.2020.140561
Тачикава Т.Чрезмерное использование дезинфицирующих средств для рук может увеличить риск заражения коронавирусом. Kyodo News, 15 февраля 2020 г. Доступно по ссылке: https://english.kyodonews.net/news/2020/02/690b9e1c9b86-focus-overreliance-on-hand-sanitizers-may-increase-risk-of-virus-infection. HTML. [По состоянию на 3 сентября 2020 г.].
Лакшми С., Шринивас Ч.Р. Экзема рук: обновление. Индийский J Дерматол Венереол Лепрол. 2012;78(5):569–82. https://doi.org/10.4103/0378-6323.100547
ВОЗ. Риски/опасности для обработки рук на спиртовой основе.2009 г. Доступно по адресу: https://www.who.int/gpsc/5may/tools/who_guidelineshandhygiene_summary.pdf. [По состоянию на 4 марта 2021 г.].
Diepgen TL, Coenraads PJ. Эпидемиология профессионального контактного дерматита. Int Arch Occup Environ Health. 1999;72(8):496–506. https://doi.org/10.1007/s004200050407
MacGibeny MA, Wassef C. Предотвращение неблагоприятных кожных реакций в результате усиленных гигиенических процедур во время пандемии COVID-19: как дерматологи могут помочь с помощью заблаговременного руководства.Арка Дерматол Рез. 2021;313(6):501–3. https://doi.org/10.1007/s00403-020-02086-x
Интраназальная вакцина против гриппа с наночастицами обеспечивает надежную защиту, обнаружили исследователи По словам исследователей из Института биомедицинских наук Университета штата Джорджия, он обеспечивает надежную защиту от различных штаммов вируса гриппа.
Интраназальная вакцина способствовала многогранному иммунному ответу, что привело к надежной перекрестной защите от гриппа у мышей.Вакцина состоит из наночастиц PEI-HA/CpG. PEI (полиэтиленимин), надежная и универсальная система доставки, может одновременно нести антигены (гемагглютинин, HA), которые вызывают иммунный ответ в организме, и адъюванты (CpG), которые усиливают иммунный ответ организма на антиген для оптимального усиления иммунитета.
Эти комплексные иммунные ответы и перекрестная защита были длительными, демонстрируя защиту от вируса гриппа в течение шести месяцев после иммунизации. Результаты опубликованы в журнале ACS Applied Materials & Interfaces.
Интраназальная вакцинация является идеальным методом лечения инфекционных респираторных заболеваний, таких как грипп. Вакцины против сезонного гриппа обычно вызывают узкие иммунные реакции, которые быстро ослабевают, что делает население уязвимым для новых штаммов гриппа. Достижения в технологии вакцин против гриппа необходимы для защиты от широкого спектра вирусов гриппа. Интраназальная вакцинация может улучшить местные иммунные реакции слизистых оболочек, предотвращая гриппозную инфекцию в воротах проникновения вируса.
В вирусе гриппа НА представляет собой белок, играющий решающую роль на ранних стадиях вирусной инфекции. НА вируса гриппа имеет головную и ножковую области. Существующие противогриппозные вакцины вызывают иммунный ответ против головки HA, но эта область головки очень изменчива и объясняет более низкую эффективность против различных штаммов. Область стебля HA более консервативна для разных штаммов вирусов гриппа.
Белковые антигены, которые вводятся интраназально, обычно менее способны вызывать иммунный ответ, поэтому для создания высокоэффективных интраназальных вакцин необходимы адъюванты.Адъюванты, такие как CpG, могут усиливать и управлять иммунными ответами, тем самым улучшая эффективность и широту защиты.
«Наночастицы PEI-HA/CpG демонстрируют хороший потенциал в качестве кандидата на вакцину против гриппа с перекрестной защитой», — сказал доктор Баочжонг Ван, автор исследования и профессор Института биомедицинских наук штата Джорджия. «Сочетание PEI и CpG в группе наночастиц PEI-HA/CpG способствовало многогранному иммунному ответу, что привело к мощной перекрестной защите.Включение CpG и антигенов в одни и те же наночастицы усиливало клеточный иммунный ответ.
«Наши результаты показали, что наночастицы значительно повышают иммуногенность HA или способность вызывать иммунный ответ, обеспечивая перекрестную защиту от различных штаммов вируса гриппа. Сохранившаяся область стебля HA индуцировала значительное количество антител в группах иммунизации наночастицами».
«Платформы наночастиц продемонстрировали интригующие характеристики и большой потенциал в разработке перекрестно защищающих вакцин против гриппа нового поколения», — сказал д-р.Чунхонг Донг, первый автор исследования и научный сотрудник Института биомедицинских наук. «Однако существуют проблемы с успешными исследованиями и разработками вакцин на основе наночастиц. Хотя в исследовании не наблюдалось явных побочных эффектов, перед клиническими испытаниями необходима более полная оценка безопасности адъювантной системы с наночастицами».
Соавторами исследования являются Baozhong Wang, Chunhong Dong (первый автор), Ye Wang, Wandi Zhu, Yao Ma, Joo Kim, Lai Wei и Gilbert X.Гонсалес.
Исследование финансировалось Национальным институтом аллергии и инфекционных заболеваний (NIAID) Национального института здравоохранения.
Чтобы ознакомиться с исследованием, посетите https://pubs.acs.org/doi/10.1021/acsami.1c19192.
/Публичная версия. Этот материал от исходной организации/автора (авторов) может иметь характер на определенный момент времени, отредактированный для ясности, стиля и длины. Высказанные взгляды и мнения принадлежат автору (авторам). Посмотреть полностью здесь.Когда следует беспокоиться о диарее? Симптомы, осложнения
Диарея часто является симптомом, который проходит в течение 48 часов; тем не менее, именно здесь это может указывать на серьезную проблему со здоровьем.
— Реклама —
В большинстве случаев диарея обычно является краткосрочным симптомом, который проходит сам по себе в течение 48 часов , но обычно она может быть длительной и сопровождаться серьезным заболеванием .
Обратитесь к квалифицированному медицинскому работнику в следующих случаях:
Для младенцев и детей ясельного возраста, если диарея длится более 24 часов или шесть или больше раз в день, необходимо медицинское вмешательство.
— Реклама —
Что такое диарея?
Диарея – это выделение нескрепленного водянистого стула с болью или без боли 2 или более раз в день.
Это стандартная ситуация, которая затрагивает многих людей, как взрослых, так и детей, и часто не вызывает беспокойства, кроме страданий и неудобств.
— Реклама —
Диарея может быть двух сортов:
- Острый:
- длится от одного до 2 дней
- Обычно не требуется вмешательства
- хронический:
- длится 4 недели или больше
- Диарея то появляется, то прекращается в течение длительного времени
Симптомы диареи
В зависимости от триггера, наряду с диареей, у вас могут быть дополнительные симптомы, напоминающие:
Как распознать диарею?
Диарея распознается с помощью следующих методов:
Как предотвратить диарею
Вы можете принять следующие меры для предотвращения диареи:
- Соблюдайте гигиену, мойте руки очищающим мылом и водой после посещения туалета и перед употреблением или приготовление еды.
- Дезинфицируйте сиденье и ручки для ванной после каждого эпизода диареи.
- Поддерживайте гигиену приема пищи, часто мойте кухонные поверхности и посуду.
- Избегайте употребления сырых или недоваренных блюд.
- Всегда полностью готовьте ужин.
- Избегайте непастеризованного молока и молочных продуктов.
- Проверяйте герметичность бутылок с водой и консервов.
- Не используйте консервные банки с истекшим сроком годности.
- Вакцинация детей против ротавирусной инфекции.
СЛАЙД-ШОУ
Суперсоветы для улучшения пищеварения: вздутие живота, запоры и многое другое
См. Слайд-шоу
Медицинский обзор от 10.02.2022
Ссылки
Источник изображения: Изображения : https://my.clevelandclinic.org/health/diseases/4108-diarrheaMary Gavin Diarrhea YoungstersHealth: https://kidshealth.org/en/parents/diarrhea.html
| Daily Tech News 11 февраля 2022 г. |
Главный
| Утренняя художественная тема 11 февраля 2022 г. Утренний отчет — 22.11.2011Доброе утро, дети. Наступили выходные, и в то время как подстрекательство, ложь и угрозы насилием на канадской границе, мексиканское противостояние нарастает — исходящие исключительно от тиранических политиков и их СМИ по обе стороны 49-й параллели — здесь моя кровь поднимается выше медленного кипения .Потому что те, кто облачается в кожаный костюм мира, любви и понимания, при этом важничая, прихорашиваясь и изображая из себя борцов за свободу и справедливость, никого не обманывают. То, что потенциально может произойти в Канаде, то, о чем Джастин Кастро молится, чтобы произошло там, наверху, произошло здесь 6 января 2021 года. буквально в политическом мученичестве Эшли Бэббит и Розанны Бойланд.Им сошло с рук Бэббита, а теперь им сошло с рук и Бойленда. Чтобы добавить оскорбление к травме, они также убили ее персонажа. Избиение находящегося без сознания сторонника Трампа сотрудником столичного департамента полиции округа Колумбия 6 января было признано «объективно разумным» после расследования, проведенного отделом внутренних дел департамента, как стало известно The Epoch Times. Я собираюсь заявить прямо здесь и сейчас для протокола: то, что произошло внутри и в непосредственной близости от здания Капитолия, было преднамеренным событием под ложным флагом / поджогом Рейхстага, организованным Демократической глобалистской осью.Эшли Бэббит, Розанна Бойланд и десятки других, которые последовали за сообщниками Антифа/БЛМ из ФБР в здание, были просто невольными обманщиками и пешками, виновными не более чем в мелком правонарушении в худшем случае. Последние до сих пор гниют в тюрьме больше года спустя, будь проклят habeas corpus, а первые мертвы. Между тем, подонков, изображающих из себя блюстителей порядка Майкла Берда и эту Лайлу Моррис, провозглашают героями. И все же, когда города и горожане сжигают, грабят и убивают, Даррен Уилсон, Дерек Шовен, Ким Поттер и другие являются «белыми сторонниками превосходства», представителями институционального, укоренившегося расизма с 1619 года, предназначенного для подавления чернокожих.Но я отвлекся. По бессмертным словам Кита и Мика «каждый полицейский — преступник, а все грешники — святые». Что касается полиции Капитолия, то они не более чем отряд головорезов в форме, выдающий себя за федеральное агентство при поддержке Палаты представителей и Сената. 6 января 2021 года Палатой представителей управляла Малиг-Нэнси Пелоси, но Сенатом руководил . . . Митч МакКоннелл: Лидер меньшинства в Сенате Митч МакКоннелл (республиканец от штата Кентукки) (1942 г.р.) во вторник напал на Республиканский национальный комитет за осуждение двух республиканцев в палате, Лиз Чейни (республиканец от штата Вайо.) и Адама Кинзингера (республиканец, штат Иллинойс) за сотрудничество с комитетом Палаты представителей по расследованию теракта 6 января. Проповедуй, брат Джей Виг. То, что МакКоннелл и все другие предатели, лакеи и предатели в Республиканской партии, на скамейке запасных и в других местах сделали с этой нацией и ее народом, потенциально обрекают их на ту же судьбу, что и Бэбита и Бойленда.На прошлой неделе у CBD и у меня были редакционные статьи о природе мести и справедливости, о которых мы говорили в последнем выпуске нашего подкаста. Хотя я не спорю о суровости наказания, КБР указывает на то, что идея о том, что у нас снова будет равное правосудие в соответствии со справедливым и стабильным законом, прямо из окна. Нам снова и снова повторяли это в лицо, и в объявлении о смерти Розанны Бойленд от рук этого грязного штурмовика со значком, который, я уверен, всеми любимая фейри-мошенница Линдси Грэм (которая хотела, чтобы полицейские округа Колумбия открыли огонь по безоружным протестующие) фантазирует о том, как она наденет на него страпон, пока смотрит видеозапись, на которой Розанна Бойленд делает последний вздох, нельзя отрицать этого. Дело не в том, что в Америке две системы правосудия. В Америке есть NO система правосудия. Те, кто наверху, стремятся подчинить себе граждан либо с помощью незаконных бюрократических указов, либо с помощью неконституционных законов, получивших Знак одобрения Доброго Мауса от хакеров в черном SCOTUS, либо с помощью мошенничества с ловушкой, придуманного местными грабителями яблок на всем пути. к профессионалам в ФБР. В противном случае они легализовали насильственные преступления на улицах, чтобы заставить вас плакать, дядя.Дядя Джо, значит. Байден или Сталин, в любом случае. Говоря о ФБР и злобных тиранах со стеклянными глазами, опьяневших от собственной власти, реальная журналистка Джули Келли сообщила об этом обновление: Губернатор Мичигана Гретхен Уитмер в 2020 году подготовила одни из самых подробных и разоблачающих отчетов, подтверждающих факт провокации ФБР. В прошлом году адвокаты защиты обнаружили, что по крайней мере дюжина агентов и информаторов ФБР были непосредственно вовлечены в заговор с похищением, который завершился драматическим завершением в октябре 2020 года, когда мужчины были арестованы после того, как информатор ФБР отвез их на встречу с агентом ФБР под прикрытием для покупки материалов. для взрывчатых веществ. До суда осталось всего несколько недель, а дело Министерства юстиции разваливается на фоне многочисленных скандалов. Время не могло быть хуже для правительства, особенно для ФБР, которое сейчас находится под пристальным вниманием в связи с его предполагаемой ролью в подстрекательстве к взлому Капитолия 6 января 2021 года. В конце концов, у этих двух событий много общего, включая планы «штурмовать «Здание Капитолия штата Мичиган, использование групп ополченцев, которые, как сообщается, лояльны Дональду Трампу, и официальные обозначения, которые представляют собой атаки «внутреннего террора». Таким образом, публичное судебное разбирательство, демонстрирующее должностные преступления ФБР, в то время как бюро избегает вопросов о 6 января, не будет обнадеживающим зрелищем. Например, официальные лица ФБР не будут раскрывать количество «активов», связанных с протестом Капитолия, или причастны ли какие-либо агенты или информаторы ФБР к насильственным действиям в тот день. Провокаторы, в том числе Рэй Эппс, несколько раз замеченные на видео, призывающие людей войти в здание, остаются безнаказанными. Однако ФБР отказывается объяснять, почему. Ах да, Гретхен «Несчастный» Уитмер. Имельда Маркос без коллекции обуви. И поскольку мы, Псаки-Псиркл, возвращаемся к вершине, посмотрите, чего она сейчас жаждет: Мэр Виндзора, Онтарио, Дрю Дилкенс, сказал на пресс-конференции в четверг, что Демократический губернатор Мичигана Гретхен Уитмер предложила помочь снять блокировку протестующих. Амбассадорский мост в течение последних нескольких дней. Я бы посмеялся до упаду, если бы операторы тяжелой техники заявили о солидарности с дальнобойщиками. ГУДОК! ХОНК! И хороших выходных. Конец Америки: 100 дней, которые потрясли мир доступны здесь.
ПРИМЕЧАНИЕ. |




 4 С)
4 С)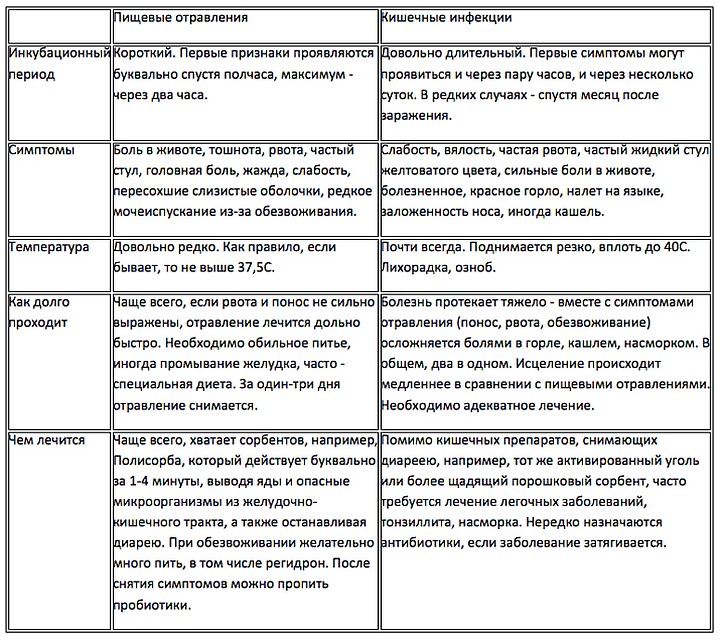 Microbiol Rev. 1989;53(4):410–49. пмид:2556635
Microbiol Rev. 1989;53(4):410–49. пмид:2556635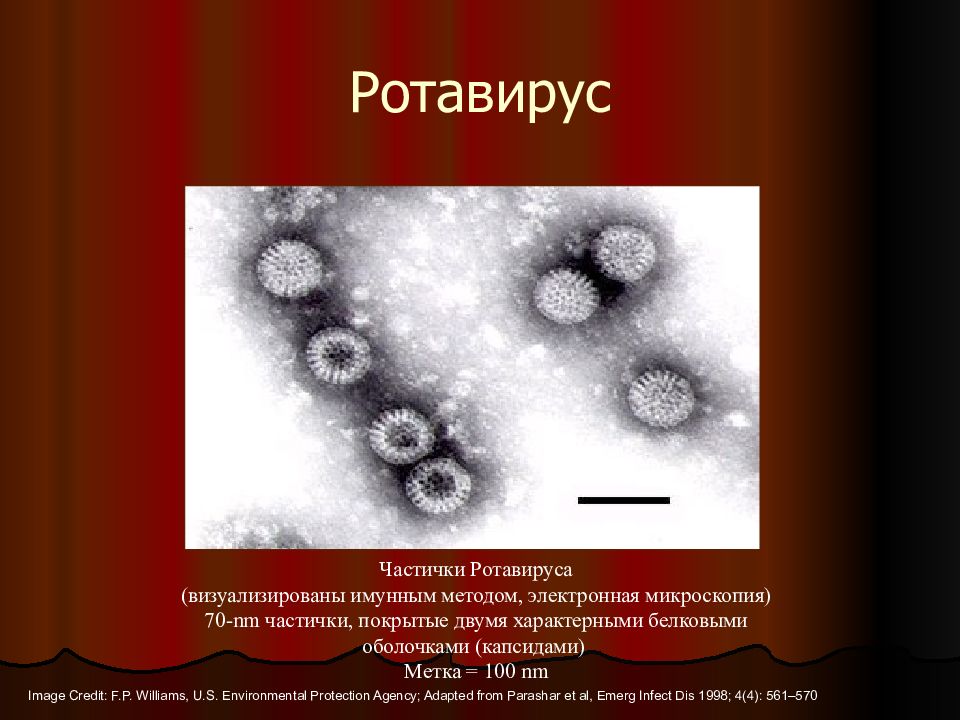 СпрингерПлюс. 2013;2(1):569. пмид:24255863
СпрингерПлюс. 2013;2(1):569. пмид:24255863 Гастанадуй П.А., Курнс А.Т., Парашар У.Д., Лопман Б.А.Госпитализации по поводу гастроэнтерита у детей старшего возраста и взрослых в США до и после вакцинации младенцев против ротавирусной инфекции. ДЖАМА. 2013;310(8):851–3. пмид:23982372
Гастанадуй П.А., Курнс А.Т., Парашар У.Д., Лопман Б.А.Госпитализации по поводу гастроэнтерита у детей старшего возраста и взрослых в США до и после вакцинации младенцев против ротавирусной инфекции. ДЖАМА. 2013;310(8):851–3. пмид:23982372 : Филодинамика совместно циркулирующих генотипов. вакцина. 2019;37(45):6842–56.пмид:31543416
: Филодинамика совместно циркулирующих генотипов. вакцина. 2019;37(45):6842–56.пмид:31543416 Зуридах Х., Кирквуд К.Д., Епископ РФ, Богданович-Сакран Н., Яп К.Л.Молекулярная характеристика и эпидемиология изолятов ротавируса, полученных от детей с диареей в Малайзии. Med J Малайзия. 2009;64(3):193–6. пмид:20527266
Зуридах Х., Кирквуд К.Д., Епископ РФ, Богданович-Сакран Н., Яп К.Л.Молекулярная характеристика и эпидемиология изолятов ротавируса, полученных от детей с диареей в Малайзии. Med J Малайзия. 2009;64(3):193–6. пмид:20527266 J Med Virol. 2008;80(4):733–40. пмид:18297696
J Med Virol. 2008;80(4):733–40. пмид:18297696 Микробиол Иммунол. 2000;44(6):499–510. пмид:10941933
Микробиол Иммунол. 2000;44(6):499–510. пмид:10941933 пмид:19921392
пмид:19921392 Заразить Генет Эвол. 2018; 63: 158–74. пмид:29842980
Заразить Генет Эвол. 2018; 63: 158–74. пмид:29842980 С., Джуниор Э.Т., Джуниор Э.К., Безерра Д.А. и др. Обнаружение нового ротавируса G3, подобного лошадям, связанного с острым гастроэнтеритом в Бразилии. Джей Ген Вирол. 2016 97(12):3131–8.пмид:276
С., Джуниор Э.Т., Джуниор Э.К., Безерра Д.А. и др. Обнаружение нового ротавируса G3, подобного лошадям, связанного с острым гастроэнтеритом в Бразилии. Джей Ген Вирол. 2016 97(12):3131–8.пмид:276 В., Холмс И.Х. Расположение основных антигенных сайтов, участвующих в нейтрализации серотипа ротавируса. Proc Natl Acad Sci USA. 1986; 83 (10): 3465–8. пмид:2422651
В., Холмс И.Х. Расположение основных антигенных сайтов, участвующих в нейтрализации серотипа ротавируса. Proc Natl Acad Sci USA. 1986; 83 (10): 3465–8. пмид:2422651 J Med Virol. 2020;92(8):1110–23. пмид:31774174
J Med Virol. 2020;92(8):1110–23. пмид:31774174 Дж., Герреро Л., Масс Д. А., Гласс Р. И., Пикеринг Л. К. и др. Когортное исследование моделей серотипов ротавируса при симптоматических и бессимптомных инфекциях у мексиканских детей. Pediatr Infect Dis J. 1993;12(1):54–61. пмид:8380235
Дж., Герреро Л., Масс Д. А., Гласс Р. И., Пикеринг Л. К. и др. Когортное исследование моделей серотипов ротавируса при симптоматических и бессимптомных инфекциях у мексиканских детей. Pediatr Infect Dis J. 1993;12(1):54–61. пмид:8380235 О., Банда Дж.М. Заболеваемость ротавирусной инфекцией у детей с гастроэнтеритом, посещающих учебную больницу при университете Джос, Нигерия. Вирол Дж. 20118(1):233. пмид: 21575246
О., Банда Дж.М. Заболеваемость ротавирусной инфекцией у детей с гастроэнтеритом, посещающих учебную больницу при университете Джос, Нигерия. Вирол Дж. 20118(1):233. пмид: 21575246 Папп Х., Ласло Б., Якаб Ф., Ганеш Б., Де Грация С., Маттейнссенс Дж. и др. Обзор штаммов ротавируса группы А, обнаруженных у свиней и крупного рогатого скота. Вет микробиол. 2013;165(3–4):190–9. пмид:23642647
Папп Х., Ласло Б., Якаб Ф., Ганеш Б., Де Грация С., Маттейнссенс Дж. и др. Обзор штаммов ротавируса группы А, обнаруженных у свиней и крупного рогатого скота. Вет микробиол. 2013;165(3–4):190–9. пмид:23642647 , Маллик С., Деб А.К., Панда С., Чавла-Саркар М. Первое сообщение о ротавирусном гастроэнтерите G8P [4] человека в Индии: свидетельство зоонозной передачи от жвачных животных человеку.J Med Virol. 2013;85(3):537–45. пмид:23280762
, Маллик С., Деб А.К., Панда С., Чавла-Саркар М. Первое сообщение о ротавирусном гастроэнтерите G8P [4] человека в Индии: свидетельство зоонозной передачи от жвачных животных человеку.J Med Virol. 2013;85(3):537–45. пмид:23280762 , Прести А.Л., Руджери Ф.М., Целла Э., Джованетти М., Чиккоцци М. и др. Полногеномная характеристика ротавируса G8P [8], появившегося среди детей с диареей в Хорватии в 2006 г. J Clin Microbiol.2013;51(5):1583–1588. пмид:23426928
, Прести А.Л., Руджери Ф.М., Целла Э., Джованетти М., Чиккоцци М. и др. Полногеномная характеристика ротавируса G8P [8], появившегося среди детей с диареей в Хорватии в 2006 г. J Clin Microbiol.2013;51(5):1583–1588. пмид:23426928 Заразить Генет Эвол. 2015; 35: 184–93. пмид:26275468
Заразить Генет Эвол. 2015; 35: 184–93. пмид:26275468