Как действуют антидепрессанты на нервную систему: Депрессия. Как «ломается» мозг, бояться ли психушки и что такое антидепрессанты?
Депрессия. Как «ломается» мозг, бояться ли психушки и что такое антидепрессанты?
С депрессией связано множество мифов и заблуждений, которые могут быть опасны для тех, кто потерял радость к жизни и действительно страдает от тяжелых мыслей. К врачам-психиатрам, которые специализируются на лечении этой болезни, обращаются мало, а если и приходят, то как правило далеко не в первую очередь.
О том, упрячут ли вас в психушку при депрессии, превратитесь ли вы в овоща после приема препаратов и что с вами сделают люди в белых халатах, «Лаба» решила разобраться вместе с Владиславом Чупеевым, врачом-психиатром и психотерапевтом из Центра исследования расстройств пищевого поведения (ЦИРПП).
1. Депрессию все любят обсуждать, например, за выпивкой. Но что мы действительно о ней знаем?
По всему миру сегодня от депрессии страдает более 300 млн человек. Это одно их самых распространенных психических заболеваний и главная причина потери работоспособности в мире, по данным Всемирной организации здравоохранения (ВОЗ).
По этим данным, из-за депрессии ежегодно кончают жизнь самоубийством около 800 тыс человек, и это вторая ведущая причина смерти среди молодых людей от 15 до 29 лет. Кроме того, депрессивные состояния влияют на работоспособность и самое главное – на качество жизни.
2. Получается, это не просто плохое настроение?
Нет, это вполне реальное заболевание. Причем серьезное. Большинство научных теорий говорят о том, что депрессия возникает из-за нехватки нейромедиаторов – универсальных «веществ-посредников», – которые передают сигналы в мозге от одной нервной клетки к другой. Поэтому люди, страдающие депрессией, видят мир в темных тонах – причем буквально. Нейромедиаторы участвуют в работе органов зрения, слуха, формировании тактильных и температурных ощущений.
Без этих веществ информация, которая доходит до мозга, искажается, любимые занятия перестают радовать, музыка слышится иначе. Кроме того, снижается концентрация и функция памяти: в депрессивном состоянии становится труднее вспомнить что-то хорошее.

У теории связи депрессии и нейромедиаторов есть множество косвенных подтверждений, но пока у нее нет бесспорного доказательства. Все потому, что нейромедиаторы очень маленькие. Отследить их в организме и хорошенько исследовать – дорого и сложно.
3.Так что происходит при депрессии?
Депрессию составляет множество симптомов среди которых основные: апатия – стойкое снижение мотивации, ангедония – отсутствие удовольствия от того, что приносило его раньше, а также упадок сил (астения).
Еще один сигнал депрессии – это тревога. Это универсальный «флажок» организма, который дает понять: что-то идет не так. Каждый из этих симптомов – результат дисбаланса нейромедиаторов в клетках головного мозга, в первую очередь – серотонина. Если симптомы сохраняются 3-5 недель, точно пора обратиться к психиатру.
4. Может быть, надо просто отдохнуть и депрессия пройдет?
Нет. При слабой или умеренно выраженной депрессии лучшее средство лечения противоположное.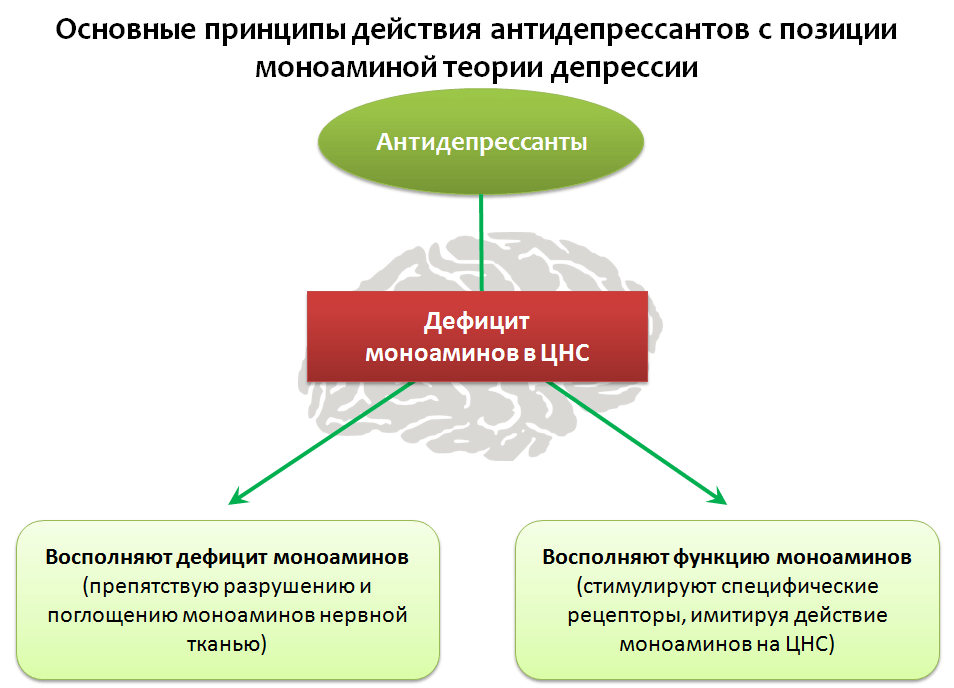
Для сильных эпизодов депрессии характерно развитие апатии. Иногда – это последний способ организма защититься от попытки суицида: сил нет вообще ни на что.
5. Звучит страшно! А как не доводить до такого состояния?
Перемены происходят постепенно, поэтому на них сложно обратить внимание. При депрессии характерно снижении концентрации внимания, слабая память, но за этими факторами наблюдать сложнее всего: в депрессивном состоянии трудно адекватно оценивать себя.
Важнее всего изменения качества жизни. К ним относятся расстройства сна (вы спите не так хорошо, как полгода назад), изменение аппетита в любую сторону, перемены в личной гигиене, отсутствие желания заботиться о себе, навязчивое чувство вины и грусти, равнодушие к любимому хобби, книгам, фильмам, музыке. Эти перемены – признак биохимической «поломки», той самой нехватки нейромедиаторов.
Если речь идет о чувстве беспомощности, отвращении к себе и желании нанести себе вред, обратиться к врачу нужно как можно скорее. Когда такие мысли сохраняются 2 недели – ждать больше нечего, дальше будет хуже.
6. Обращаться к врачу при депрессии? Вы смеетесь? Если пришел к психиатру, сразу упекут в психушку!
Нет, не сразу. В психиатрические больницы недобровольно могут госпитализировать только тех, кто представляет реальную опасность для себя или окружающих. Т.е. если вас сняли с окна при попытке суицида, или вы пытались порезать окружающих ножом, или довели себя до истощения (индекс массы тела менее 17), то основания для госпитализации существуют.
В любом другом случае окончательное решение остается за пациентом. Главное, чтобы тяжелые мысли не сформировались в конкретный и мрачный план, который человек готов выполнять уже сейчас. Если от таких мыслей удается отвлечься в течение суток, в больницу такого пациента класть не будут.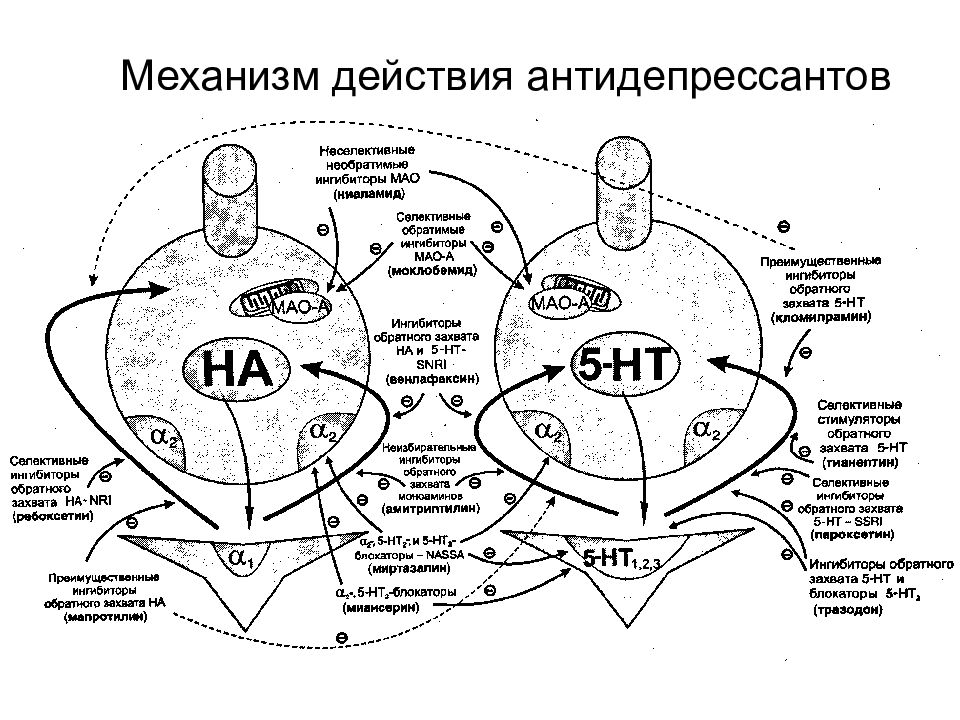
7. Не верю! В психушку легко попасть просто так!
В России любое попадание в больницу связано с ворохом бумаг, поэтому оказаться там «просто так» невозможно. Для госпитализации в психиатрический стационар существуют строгие критерии: риск для окружающих или для себя, или приведение к такому риску без оказания помощи. При депрессии к таким рискам относят навязчивые мысли о самоубийстве или попытки суицида в последние несколько месяцев.
Если пациент находится в таком состоянии, госпитализация в стационар – это выход. Там под наблюдением врачей человек за несколько недель сможет справиться с тяжелым состоянием.
Иногда врачи действительно могут недобровольно госпитализировать пациента – если он входит в группы высокого риска. Например, недавно пытался покончить с собой и не демонстрирует положительной динамики, то есть его состояние ухудшается.
Но даже в таком случае пациенту предоставлен выбор: он может отказаться от госпитализации.
Без письменного согласия отвезти человека в больницу можно только на 72 часа, затем собирается врачебная комиссия и ее решение уходит в суд.
Такая процедура требует от врачей больших трудозатрат, поэтому к ней прибегают только в случае реальной угрозы жизни.
Конечно, психиатрическая больница – не самое веселое место на планете, особенно для человека в тяжелой депрессии. Но, к счастью, реальность далека от фантазии голливудских сценаристов. Врачи не разгуливают по отделению с шокером или заготовленным шприцом.
Они стараются максимально снизить риски пациента, помогают справиться с кризисом и стабилизируют состояние так, что человек может постепенно вернуться в привычный ритм и снова радоваться жизни.
8. Вы говорите, что пациенты психиатрических больниц опасны?
Пациенты психиатрических больниц преимущественно представляют опасность только для себя. Местный персонал внимательно следит за их состоянием.
В среднем по популяции психиатрический диагноз имеет 1 человек из 100 – эта цифра не меняется в зависимости от пола, региона и национальности (исключение составляют пожилые мужчины – у них выше риск суицида).
9. Может, все-таки достаточно поговорить с психологом?
Безусловно, можно не обращаться в хирургию, если вы сломали ногу. Организм сам может заживить перелом. Но лучше все-таки наложить гипс. Вот и помощь психиатра нужна для того, чтобы справится с проблемой быстрее: так меньше рисков для здоровья и жизни.
Психиатр – специалист с медицинским образованием. Только он может поставить диагноз «депрессия» и назначить схему лечения. Психолог таким не занимается. При клинической депрессии проблему нужно решать системно, подключая к ней врача и психолога.
Кстати, в список назначений психиатра входят не только антидепрессанты, но и та же работа с психологом. При их совмещении достигаются лучшие результаты: антидепрессанты помогают набраться сил, а психотерапия – найти причину депрессии.
10. Хорошо, а как тогда выбрать адекватного психиатра?
Точно так же, как вы выбираете любого другого врача. Хорошую рекомендацию могут дать друзья, которые уже бывали у такого специалиста и вы видели, что им стало лучше.
Единственный четко очерченный критерий – готовность врача быть на связи и отвечать на вопросы. Важно, чтобы специалист мог поддержать, если проявятся побочные эффекты лекарства. В них нет угрозы, но внезапное головокружение, сонливость, тошнота действительно могут напугать.
К тому же, не всегда удается подобрать антидепрессант, который подойдет именно вам, с первого раза. В критический момент специалист сможет предпринять необходимые меры: успокоить, изменить лекарственную терапию, объяснить, что происходит.
11. Расскажите тогда про таблетки. Если психиатр назначит лекарства, я стану «овощем»?
Прием лекарственного средства никогда не приводит к переходу из царства животных в царство растений. Миф об «овоще» отчасти происходит от побочных эффектов нейролептиков, разработанных почти полвека назад. Но в гораздо большей степени это состояние вызвано течением шизофрении, оставленной без лечения. То есть речь в этом контексте вовсе не о депрессии.
Ряд тяжелых психических болезней, если их не лечить, год за годом забирают уникальные черты личности человека, оставляя глубокий след на психике.
12. Тогда объясните, как работают антидепрессанты!
Работа нервной системы осуществляется передачей нервных импульсов от одной клетки головного или спинного мозга (нейрона) другой при помощи нейромедиаторов. Эти вещества-посредники выбрасываются в пространство между нейронами, что запускает каскад передачи сигнала следующим клеткам. Затем нейромедиаторы захватываются обратно, разрушаются на составные блоки и собираются вновь для повторной передачи импульсов.
Передача нервного импульса при депрессии меняется, так как количество нейромедиаторов снижено. Это препятствует созданию законченного нервного импульса. Отсюда возникает тревога. Восстановить естественную работу нервной системы возможно с помощью антидепрессантов.
Лекарства от депрессии работают по-разному. Препараты предыдущих поколений, например, ингибиторы моноаминоксидазы (иМАО), блокируют разрушение нейромедиаторов в нервных клетках.
Сейчас их используют достаточно редко из-за выраженных побочных эффектов и высокой токсичности.
Им на смену пришли более современные лекарства – селективные ингибиторы обратного захвата серотонина (СИОЗС), то есть препараты, которые препятствуют захвату конкретного нейромедиатора.
СИОЗС помогают сформировать законченный нервный импульс. Постепенное увеличение дозировки помогает нервной системе вернуться на «докризисный уровень».
13. Все антидепрессанты – ужасные наркотики?
За время лечения депрессии человек привыкает разве что к хорошему настроению, нормальному сну и отсутствию тревоги. Так что не все психотропные препараты наркотики, хотя такое мнение чрезвычайно распространено.
Миф о зависимости связан с наличием у психиатрических лекарств синдрома отмены: набора побочных эффектов, возникающих при несвоевременном, чаще всего самовольном, прекращении курса лечения.
Многие считают, что если антидепрессанты нельзя сочетать с алкоголем , то от них можно безболезненно отказаться на время, но это не так. Все психиатрические препараты имеют накопительный эффект. После прекращения приема препарат остается в крови до нескольких недель, за которые может вступить в непредсказуемое взаимодействие с алкоголем. Тогда на симптомы опьянения накладывается синдром отмены препарата, что может может привести к угрожающим жизни состояниям.
Все психиатрические препараты имеют накопительный эффект. После прекращения приема препарат остается в крови до нескольких недель, за которые может вступить в непредсказуемое взаимодействие с алкоголем. Тогда на симптомы опьянения накладывается синдром отмены препарата, что может может привести к угрожающим жизни состояниям.
Но это не означает, что антидепрессанты придется пить до конца жизни. Первичная стабилизация состояния наступает примерно через месяц.
За это время дозировка лекарств наращивается до лечебной, она всегда выше. Небольшие дозы в первое время нужны для того, чтобы снизить количество побочных эффектов. Полный курс лекарственной терапии длится от полугода до 1,5 лет. В большинстве случаев лечение занимает от 7 до 10 месяцев.
14. А вот у меня есть подруга, которая пила антидепрессанты, но потом депрессия вернулась, и стало еще хуже. Такое же может произойти?
Так может быть по нескольким причинам. Самая распространенная – досрочное прекращение лечения без консультации с врачом. Важно пройти курс до конца: несвоевременный отказ от лекарств вызывают синдром отмены и приводят к повторному возникновению депрессии. Симптомы болезни в таком случае нередко бывают более тяжелыми, чем в самом начале.
Важно пройти курс до конца: несвоевременный отказ от лекарств вызывают синдром отмены и приводят к повторному возникновению депрессии. Симптомы болезни в таком случае нередко бывают более тяжелыми, чем в самом начале.
Однако стать хуже может и после полностью пройденного курса лечения антидепрессантами. Лекарства – не единственный компонент выздоровления. Они помогают справиться с текущим депрессивным состоянием, но никак не исключают возможности рецидива. Залогом стабильного эмоционального фона может быть только поведенческая психотерапия. На это нужно потратить время.
15. Что делать, если в помощи психиатра нуждается близкий человек?
Если вы чувствуете, что человек нуждается в помощи, но не считает возможным или нужным обратиться к специалисту, можно предложить собственную помощь и пойти к врачу вместе, буквально «взять за руку и отвести». Если вы встречаете сильное сопротивление – высока вероятность, что с вами говорит не человек, а его болезнь.
Людям в депрессии часто может быть страшно признаться самим себе, что ситуация выходит из-под контроля.

Лучший вариант – не вступать в противостояние, а задавать вопросы. Считает ли человек происходящее с ним здоровым? Можете ли вы чем-то помочь? Действительно, поход к специалисту может не решить всех проблем, но попытаться все же стоит.
Современная психиатрия, в отличие от того, чем она располагала 30 лет назад, обладает большим набором фармакологических инструментов даже для тяжелых заболеваний, таких как шизофрения или биполярное-аффективное расстройство.
Так что с помощью лекарственной терапии депрессию вполне можно побороть. Главное, не бояться идти к врачу и не бросать лечение на полпути.
16. Узнать больше
Если хотите проверить знания, пройдите наш тест про Веронику. Кроме того, заходите на наш курс «Депрессия: скрытая угроза» Там еще больше полезных советов от профессиональных врачей.
Не в голове, а в животе: как питаться, чтобы не впасть в депрессию
- Дэвид Робсон
- BBC Future
Автор фото, Getty Images
Сто лет назад несколько отдельных исследований обнаружили связь между диетой и психическим здоровьем. Теперь ученые подтверждают, что бактерии в нашем кишечнике могут влиять на работу мозга и психическое здоровье.
Теперь ученые подтверждают, что бактерии в нашем кишечнике могут влиять на работу мозга и психическое здоровье.
Кишечник пациента не кажется тем местом, где можно искать причины депрессии. Но именно на него обратил внимание Джордж Портер Филлипс в начале XX века.
Наблюдая за пациентами лондонской психиатрической больницы Bethlem Royal Hospital, Филлипс заметил, что депрессивные больные с меланхолией часто страдали от тяжелых запоров, а также других признаков «общего нарушения обменных процессов» — ломкие ногти, тусклые волосы, землистый цвет лица.
Можно было бы предположить, что эти физиологические проблемы являются результатом депрессии, но Филлипс подумал об обратной причинно-следственной связи. Он задумался, можно ли облегчить психическое состояние пациента, решив проблемы с кишечником?
Чтобы выяснить это, он перевел пациентов на специальную диету. Она не содержала мяса, только рыбу, а также кефир, кисломолочный напиток с лактобактериями, что, как известно, улучшает пищеварение.
Удивительно, но это сработало. Из 18 пациентов, состояние которых Филлипс проверил сам, 11 полностью выздоровели, а у других двоих наступило заметное улучшение. Этот эксперимент является одним из первых доказательств того, что бактерии в нашем кишечнике могут оказывать глубокое влияние на состояние нашей психики.
Сегодня о микробиоме и его роли в здоровье человека говорят много.
Впрочем, его связь с психикой объяснить сложнее.
Как эти микроскопические мусорщики, питающиеся отходами нашего пищеварения, могут влиять на мозг?
«Я ни в коей мере не подвергаю сомнению тот факт, что микробы влияют на психическое здоровье», — отмечает Джейн Эллисон Фостер, руководитель лаборатории в Университете МакMастерa в Канаде, чьи исследования занимают лидирующие позиции в этой области.
А это значит, что мы сможем лечить наш мозг через кишечник. «У этой области — большой потенциал для развития как новых терапевтических средств, так и индивидуальной медицины».
Впрочем, Фостер подчеркивает, что нездоровый кишечник является лишь одной из многих возможных причин психических расстройств. То есть только часть пациентов хорошо отреагирует на новое «психобиотическое» лечение.
Но для тех, кто страдает от дисбаланса микрофлоры кишечника, новые методы могут принести значительное облегчение.
Автор фото, Unsplash
Підпис до фото,Исследование, проведенное в начале XX века, выявило, что кефир позитивно влияет на пациентов с депрессией
Несмотря на выводы первых исследований, в частности эксперимента Филлипса, идея о влиянии состояния кишечника на психическое здоровье была непопулярной на протяжении почти всего ХХ века.
Серьезные доказательства этой идеи стали появляться только в последние два десятилетия.
Один из самых интересных современных экспериментов провели в Университете Кюсю в Японии в 2004 году.
Команда ученых впервые продемонстрировала, что у «стерильных» мышей, выращенных без контакта с микробами, были зафиксированы колебания уровня гормонов кортикостерона и АКТГ, отвечающих за стресс.
Ученые предположили, что кишечные бактерии здоровых мышей каким-то образом влияют на гормональный профиль.
После этого исследователи засеяли стерильных мышей лактобактериями, которые Филлипс также использовал в своем эксперименте.
Хотя стрессовая реакция у мышей оставалась выше нормы, она заметно снизилась по сравнению с животными, которые не имели бактерий в своем организме.
Существуют и некоторые признаки того, что депрессивное поведение может передаваться от вида к виду — от человека к мыши — через микробы в кишечнике.
Это удалось доказать китайским исследователям из города Чунцин, которые пересадили стерильным мышам часть микробиоты пациентов с глубоким депрессивным расстройством.
Конечно, это только эксперименты на животных, но их выводы подтверждаются эпидемиологическими исследованиями с участием большого количества людей (результаты последнего были обнародованы 4 февраля 2019 года).
Все эти исследования систематически подтверждают, что микрофлора кишечника влияет на психику человека, в частности, на развитие депрессии и тревожных состояний.
Автор фото, Getty Images
Підпис до фото,Только у двоих из 10 пациентов антидепрессанты вызывают улучшение
Ни один отдельный вид бактерий не может привести к такому эффекту. Все дело, как кажется, в общем соотношении разных семей микробов.
Микробиом кишечника у депрессивных и тревожных людей менее разнообразен, чем у людей с крепким психическим здоровьем.
Более того, в одной из последних публикаций на эту тему исследователи обнаружили связь между шизофренией и низким видовым разнообразием кишечника. Когда образцы бактерий пациентов пересадили стерильным мышам, в деятельности их мозга произошли сдвиги, характерные для этого психического расстройства.
Микробы и мозг
Эта связь может формироваться по-разному.
Некоторые виды бактерий защищают стенки кишечника, укрепляя его слизистую оболочку, которая препятствует попаданию содержимого в кровоток.
Без такого барьера человек может страдать от высвобождения цитокинов, которые вызывают воспалительные процессы. Эти белки увеличивают кровообращение вокруг источника инфекции и регулируют иммунную реакцию организма.
Эти белки увеличивают кровообращение вокруг источника инфекции и регулируют иммунную реакцию организма.
Эта реакция имеет важное значение в борьбе с инфекцией, но цитокины также способствуют формированию усталости. Именно поэтому мы часто чувствуем себя усталыми и подавленными, когда болеем. Но такое состояние в течение длительного времени может привести к депрессии.
Микрофлора кишечника влияет на то, как наш организм переваривает и метаболизирует предшественников синтеза важных нейромедиаторов, таких как серотонин и дофамин.
Бактерии кишечника напрямую влияют на мозг через блуждающий нерв, иннервирующий слизистую оболочку кишечника, что позволяет ему контролировать процесс пищеварения.
Таким образом кишечные микробы могут посылать сигналы, воздействующие через блуждающий нерв на активность мозга.
«Бактерии кишечника могут по-разному «общаться» с различными структурами организма, в том числе нервной системой, — говорит Фостер. — Это очень динамичное, интерактивное, сложное пространство».
— Это очень динамичное, интерактивное, сложное пространство».
Но это — не улица с односторонним движением, поэтому активность мозга также может влиять на состав микрофлоры кишечника. Стресс повышаает риск возникновения воспалительных реакций, влияющих на микрофлору кишечника.
Это своего рода замкнутый круг.
Новые способы лечения
Как отмечает Фостер, эта отрасль быстро развивается, исследования проводят как ученые из университетов, так и коммерческие компании.
Их цель — найти новые методы лечения депрессии.
Антидепрессанты меняют баланс химических веществ в мозге, например уровень серотонина, но помогают далеко не всем. На самом деле только у двоих из 10 пациентов антидепрессанты вызывают улучшение.
Хороший эффект имеет когнитивно-поведенческая психотерапия, но она также помогает далеко не всем.
В результате многие так и не получают эффективного лечения.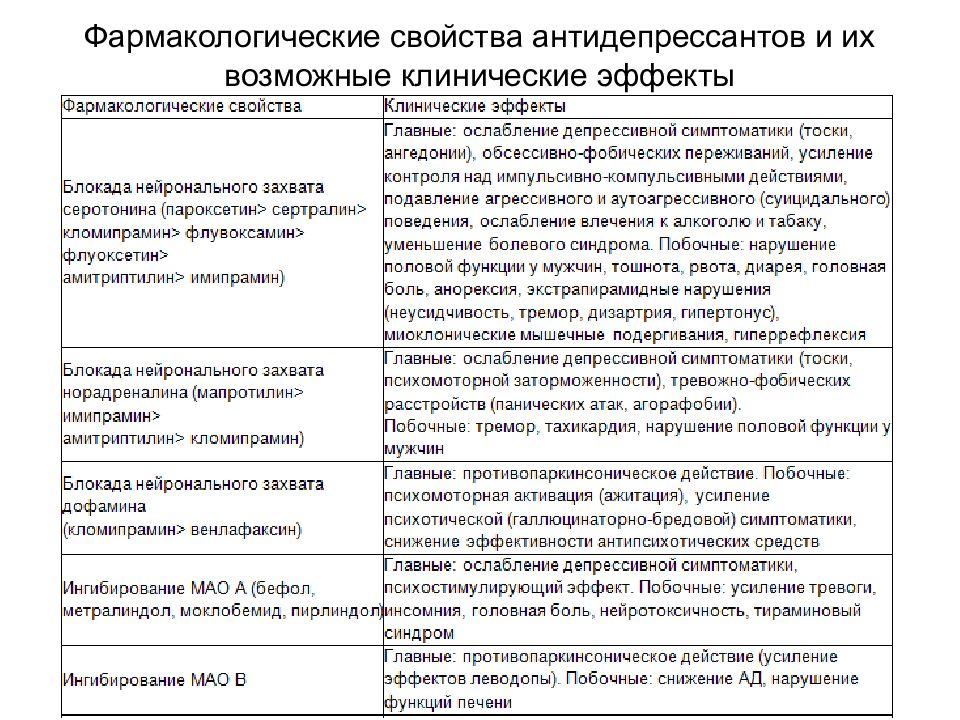 Поэтому связь между мозгом и кишечными бактериями может стать одним из самых перспективных направлений исследований.
Поэтому связь между мозгом и кишечными бактериями может стать одним из самых перспективных направлений исследований.
Автор фото, Getty Images
Підпис до фото,Когда стерильные мыши получали полезные лактобактерии, они значительно легче переносили стресс
К сожалению, многие исследования в этой области пока еще крайне немногочисленны, а их результаты неоднозначны. В ходе одних изменение диеты или добавление в нее пробиотиков снижали симптомы депрессии, тогда как в других исследованиях подобные меры оказывали действие, ничем не отличающееся от эффекта плацебо.
Фостер объясняет отрицательный результат тем, что эксперементы проводились на пациентах, у которых депрессия имела другие причины. Кишечные бактерии, беспорно, могут влиять на психическое состояние некоторых людей, однако во многих случаях триггер может быть совершенно другим. Таким пациентам кефир вряд ли поможет.
Еще больше усложняет ситуацию то, что микробиом каждого человека уникален, поэтому любая терапия, направленная на флору кишечника, должна учитывать эти различия.
Поэтому способ лечения должен быть сложным и индивидуальным, считает исследователь.
«Теория о связи между кишечником и мозгом прежде всего применима в точной медицине (которая учитывает индивидуальные особенности организма, а не общие для всех принципы)».
Задача, по словам Фостер, заключается в том, чтобы «определить биотип или группу лиц со сходным микробиомом, который может быть причиной их симптомов». Прежде чем начинать лечение, проверить, например, склонность пациента к воспалительным процессам.
Поскольку в отличие от антидепрессантов речь идет не о вмешательстве в работу мозга, возможные побочные эффекты такой терапии будут менее опасными.
Питайтесь как итальянцы
Теория о наличии связи между кишечником и мозгом является еще одним доказательством того, что здоровое, сбалансированное питание снижает риск развития многих болезней, в частности, депрессии.
Многие из этих исследований были посвящены так называемой «средиземноморской диете» — общее название рациона, богатого овощами, фруктами, орехами, морепродуктами, ненасыщенными жирами и растительными маслами, а также с низким содержанием рафинированного сахара, красного и обработанного мяса.
(Это, конечно, довольно грубое обобщение, поскольку существуют значительные различия в том, как питаются жители южной Европы.)
Однако одно испанское исследование показало, что у людей, которые придерживались традиционной средиземноморской диеты, риск развития депрессии был вдвое меньше.
Автор фото, Getty Images
Підпис до фото,Средиземноморская диета, богатая фруктами, овощами, здоровыми маслами, с низким содержанием переработанных продуктов, очень полезна для здоровья
Ученые доказали, что средиземноморская диета увеличивает разнообразие кишечных бактерий и снижает возможность других физиологических изменений, например хронических воспалений, которые также сопровождают депрессию.
Спустя более века после эксперимента Филлипса в больнице Bethlem Royal надежное средство лечения депрессии пока так и не найдено.
Но для некоторых людей здоровый кишечник может стать важным первым шагом к здоровой психике.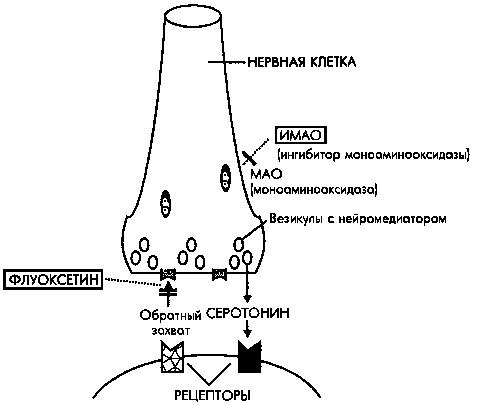
Прочитать оригинал этой статьи на английском языке вы можете на сайте BBC Future.
чувства под блокадой антидепрессантов — T&P
Психиатр Джуди Холланд рассказала The New York Times, как нормы поведения, навязываемые социумом и фармацевтической индустрией, заставляют женщин подавлять природную эмоциональность при помощи антидепрессантов. Эмоции — это нормально, а таблетки делают чувства синтетическими, утверждает Холланд. T&P перевели из ее речи самое главное.
Женщины чувствительны. В процессе эволюции они стали более чутко относиться к своему окружению, сильнее проявлять эмпатию к потребностям своих детей и интуицию по отношению к намерениям своих партнеров. Некоторые исследования предполагают, что женщины лучше справляются с артикуляцией своих чувств, потому что в ходе своего развития их мозг научился тратить больше усилий на речь, память и восприятие чужих эмоций.
Эти наблюдения основываются на биологии, а не на феминистической или противостоящей ей идеологиях, но имеют социальные причины. Женская чувствительность — это признак здоровья, а не болезни. Это источник силы. Но женщины находятся под постоянным давлением с призывом контролировать свои эмоции. Их учат извиняться за свои слезы, сдерживать гнев и бояться показаться истеричками.
Женская чувствительность — это признак здоровья, а не болезни. Это источник силы. Но женщины находятся под постоянным давлением с призывом контролировать свои эмоции. Их учат извиняться за свои слезы, сдерживать гнев и бояться показаться истеричками.
Женщинам почти в два раза чаще, чем мужчинам, ставятся диагнозы депрессия и тревожное расстройство. Многим из них помогают лекарства, но для других они оказывают медвежью услугу. Увеличение количества рецептов на психиатрические препараты, особенно выписываемые врачами из сторонних специальностей, формируют новую норму поведения, подталкивая женщин искать медикаментозной поддержки.
Химия мозга и тела должна находится в гармонии. Представим, что серотонин отвечает в мозгу за позитивное мышление. Слишком высокое содержание этого гормаона гарантирует беспечность, слишком низкое — заставляет видеть в каждой ситуации проблему.
Слезы не обязательно связаны с грустью. Когда мы испуганы, сбиты с толку, когда мы сталкиваемся с несправедливостью или оказываемся глубоко тронуты событиями вокруг, мы плачем.
Это не означает слабость или потерю контроля.
Большинство антидепрессантов, которые используются против тревожных состояний, повышают выработку серотонина. Кажется, что дела налаживаются, но далеко не всегда это приносит на пользу. Серотонин может не только отогнать страхи, но и вызвать эмоциональное и физическое оцепенение. Как правило, он подавляет негативные эмоции сильнее, чем позитивные, заставляет человека чувствовать себя более рациональным и бесстрастным. Но в некоторых случаях антидепрессанты заглушают многие другие человеческие чувства: эмпатию, раздражение, печаль, креативность, гнев, траур, тревогу, эротическое желание.
Слезы не обязательно связаны с грустью. Когда мы испуганы, сбиты с толку, когда мы сталкиваемся с несправедливостью или оказываемся глубоко тронуты событиями вокруг, мы плачем. Это не означает слабость или потерю контроля. При высоких дозах антидепрессантов заплакать становится очень сложно. В результате человек может оказаться во власти апатии и безразличия. Необходимость перемен проявляется через чувство дискомфорта и беспокойства из-за того, что что-то идет не так — мы понимаем, что правильно, только когда можем это почувствовать. Если лечение заключается в укреплении самодовольства, оно никому не сможет помочь.
Необходимость перемен проявляется через чувство дискомфорта и беспокойства из-за того, что что-то идет не так — мы понимаем, что правильно, только когда можем это почувствовать. Если лечение заключается в укреплении самодовольства, оно никому не сможет помочь.
От избытка медикаментов человеческие эмоции становятся синтетическими. Для персонального роста, счастливых отношений и более спокойного мира нам требуется больше эмпатии, сострадания, отзывчивости, эмоциональности и чувствительности, а не наоборот.
Подробнее о блокаде женской чувствительности от приема антидепрессантов можно узнать на сайте The New York Times.
Какие продукты лечат депрессию
Девять лет назад эпидемиолог Фелис Джака обнаружила, что женщины, потребляющие много сладкого, рафинированных углеводов и фастфуда, чаще страдают депрессией. После серии рандомизированных тестов стало ясно, что пища, которую мы регулярно едим, влияет на мозг и психику гораздо больше, чем считалось прежде, — причем вне зависимости от пола, возраста и страны проживания. Теперь Джака — президент Международного общества исследований в области пищевой психиатрии. Эта дисциплина — один из главных трендов в лечении психических расстройств. О ней много пишут, ее активно изучают, широко практикуют и даже преподают на психиатрическом отделении Колумбийского университета. О практическом применении пищевой психиатрии рассказывают наши друзья из Reminder, нового медиа о здоровье и саморазвитии.
Теперь Джака — президент Международного общества исследований в области пищевой психиатрии. Эта дисциплина — один из главных трендов в лечении психических расстройств. О ней много пишут, ее активно изучают, широко практикуют и даже преподают на психиатрическом отделении Колумбийского университета. О практическом применении пищевой психиатрии рассказывают наши друзья из Reminder, нового медиа о здоровье и саморазвитии.
Что конкретно представляет собой эта диета для мозга «на стероидах»?
Это хорошо видно по списку «пищевых антидепрессантов», рекомендованному еще одним ведущим экспертом, создателем клиники здорового питания для мозга и экофермером Дрю Рамси.
- Пищевые антидепрессанты. Растительные продукты: зелень одуванчика, шпинат, капуста, кинза, горчица, базилик, краснокочанная капуста, грейпфрут, свекольная ботва, латук, свекла, барбадосская вишня, репа, брюссельская капуста, тыква, папайя, болгарский перец, петрушка, брокколи, водяной кресс, кольраби, цветная капуста, мускатная тыква, салатный цикорий.
 Продукты животного происхождения: сайда, лосось, зубатка, омары, семга, субпродукты, краб, золотистый окунь, устрицы, моллюски, улитки, тунец, макрель, сельдь, радужная форель, осьминог, козлятина, печень, птичьи потроха, рыбная икра, мидии, эму. (Источник)
Продукты животного происхождения: сайда, лосось, зубатка, омары, семга, субпродукты, краб, золотистый окунь, устрицы, моллюски, улитки, тунец, макрель, сельдь, радужная форель, осьминог, козлятина, печень, птичьи потроха, рыбная икра, мидии, эму. (Источник)
В топ пищевых антидепрессантов Дрю Рамси входит все то, что обычно называют «средиземноморской диетой». Вопрос, почему свекольная ботва или устрицы могут на 33% снизить риск депрессии? Потому что их любят «хорошие» бактерии кишечника.
При чем тут кишечник?
Может, кишечник — это и не «второй мозг», как его иногда называют. Но живущие в нем бактерии точно могут претендовать на звание отдельного органа. Их 50 триллионов, примерно в 1,3 раза больше, чем всех клеток в организме. 360 микробных генов на каждый наш. Три килограмма живого веса. Около 500 видов, объединенных в сложную экосистему — микробиом. И как бывает с любой природной экосистемой, ее нарушение влияет на состояние других систем, с которыми она связана. С чем связан кишечник?
С чем связан кишечник?
Мы знаем, что 100 миллионов нейронов кишечника имеют прямую сверхскоростную связь с мозгом. Что кишечная микробиота регулирует иммунитет и обменные процессы. Что она участвует в производстве витаминов, гормонов, ферментов и нейромедиаторов. И что все это действует на мозг. Микробиом кишечника — такая большая тема, что об этом стоит писать и читать книги. Например, эту или эту. А пока вырвем из контекста три факта, которые важны для пищевой психиатрии.
Изменение микробиоты при тяжелой депрессии (The Microbiota-Inflammasome Hypothesis of Major Depression).1. Микробиота кишечника состоит из нескольких больших групп бактерий. Каждая группа выполняет свои функции и отвечает за производство особых ферментов.
2. Еда, которую мы потребляем, питает не только нас, но и бактерии в кишечнике. Каждая группа бактерий имеет свои «пищевые предпочтения». Перекосы в питании меняют их соотношение, оставляя без еды одни бактерии и перекармливая другие, что вызывает их бурный рост.
3. У страдающих депрессией обнаружены серьезные изменения в микробиоме кишечника: рост «воспалительной» микробиоты и сокращение количества бактерий, связанных с производством «гормона счастья» — серотонина.
Кто виноват?
Обвиняемый — сахар. Пострадавший — серотонин. Этот нейромедиатор — главный трагический герой моноаминовой теории. Она объясняет депрессивные и некоторые другие расстройства нарушением химического баланса мозга, которое приводит к серотониновому голоду.
Чем его утолить? Сладким, скажет вам любой. Приход от куска торта наступает минут через двадцать. Глюкоза через ряд посредников стимулирует выработку серотонина. Серотонин подавляет центры отрицательных эмоций в заднем гипоталамусе. И жизнь опять в розовом цвете. Почему же сладкое и жирное, которым любят заедать стресс, становится депрессантом?
Почему же сладкое и жирное, которым любят заедать стресс, становится депрессантом?
Проблема в триптофане, из которого синтезируется серотонин. Эта аминокислота не вырабатывается организмом. Получить триптофан можно только с пищей. В основном белковой — растительной или животной. По идее глюкоза в сладостях вызывает рост уровня инсулина, который помогает триптофану добраться до мозга. Но переработанная сладкая и жирная пища слишком бедна ферментами, необходимыми для усвоения триптофана. Она подавляет бифидобактерии, которые участвуют в его превращении в серотонин. И одновременно вызывает рост другой микробиоты, которая разлагает даже тот минимум триптофана, который мог бы стать серотонином.
Но это не все. Кроме глюкозы, сахар расщепляется на фруктозу. А это любимая пища патогенных бактерий, в состав которых входят липосахариды. Эти воспалительные молекулы могут повышать проницаемость стенок кишечника. В результате в кровоток попадают бактерии и эндотоксины. В ответ иммунная система выделяет противовоспалительные белки цитокины. Они могут проникнуть в мозг и стимулировать уже там выработку воспалительных молекул, атакующих его нейроны. Ученые все больше убеждаются, что воспаление — один из ключевых факторов таких дегенеративных заболеваний мозга, как болезнь Альцгеймера. Научно подтверждено: депрессия тоже развивается на фоне воспалительных процессов и может быть реакцией мозга на цитокины. Есть даже предположения, что особо прожорливые бактерии кишечника могут хакнуть мозг и не хуже некоторых паразитов манипулировать нашим пищевым поведением в своих интересах. Звучит, как сценарий приквела «Нечто». Но опыты на мышах показывают, что жирная и сладкая пища вызывает изменения в митохондриях клеток гипоталамуса, настраивая мозг на усиленное потребление еды такого типа. Есть и еще одна категория веществ, которые меняют микробиоту, чтобы воздействовать на мозг. Это антидепрессанты.
В ответ иммунная система выделяет противовоспалительные белки цитокины. Они могут проникнуть в мозг и стимулировать уже там выработку воспалительных молекул, атакующих его нейроны. Ученые все больше убеждаются, что воспаление — один из ключевых факторов таких дегенеративных заболеваний мозга, как болезнь Альцгеймера. Научно подтверждено: депрессия тоже развивается на фоне воспалительных процессов и может быть реакцией мозга на цитокины. Есть даже предположения, что особо прожорливые бактерии кишечника могут хакнуть мозг и не хуже некоторых паразитов манипулировать нашим пищевым поведением в своих интересах. Звучит, как сценарий приквела «Нечто». Но опыты на мышах показывают, что жирная и сладкая пища вызывает изменения в митохондриях клеток гипоталамуса, настраивая мозг на усиленное потребление еды такого типа. Есть и еще одна категория веществ, которые меняют микробиоту, чтобы воздействовать на мозг. Это антидепрессанты.
При чем тут антидепрессанты?
Как показывают недавние исследования, психоактивные препараты, которые назначают для лечения депрессии и тревожных расстройств, подавляют отдельные бактерии, участвующие в выработке серотонина. И что совсем неожиданно, для них это не побочный эффект, а условие эффективности.
И что совсем неожиданно, для них это не побочный эффект, а условие эффективности.
Конечно, современные антидепрессанты не обязаны стимулировать выработку серотонина. Их задача в том, чтобы не дать нейронам, выделяющим серотонин, поглотить его обратно. Благодаря этому количество молекул серотонина между нервными клетками растет. И нормальный обмен сигналами в системах мозга, отвечающих за настроение, восстанавливается.
Так все выглядит в теории. Но насколько они эффективны на практике? Оценки варьируются от «вполне» или «частично» до «чуть более» или «чуть менее», чем плацебо. Почему такой разброс? Если бы они не действовали вообще, это означало бы одно из двух: либо депрессия не связана с дисбалансом серотонина (так и считают некоторые специалисты), либо они не работают. Но они действуют. Просто не всегда, не на всех и не одинаково. Могут внезапно перестать. Почти гарантированно перестают через какое-то время. И рано или поздно нуждаются в замене или комбинации с другими препаратами.
Возможно, вызванные антидепрессантами изменения микробиоты кишечника и есть разгадка их пресловутой «капризности». А заодно ответ на вопрос, почему, несмотря на рост их потребления, уровень заболеваемости депрессией и другими психическими расстройствами и не думает снижаться.
Что делать?
Вредные и полезные микробы одинаково зависят от того, что мы едим. Поэтому мы можем сделать так, чтобы они перестали паразитировать на наших слабостях и превратились в инструмент самоконтроля. Благодаря исследованиям состава микробиоты, мы знаем, как меняется соотношение бактерий при самых распространенных психических расстройствах. Пищевая психиатрия предлагает три стратегии с использованием так называемых психобиотиков — биологических психомодуляторов.
1. Урезать рацион потенциально вредных микробов и накормить потенциально полезных той едой, которую они сами выбрали для себя в ходе эволюции.
2. Попытаться добавить в кишечник потенциально полезные бактерии.
3. Сделать и то и другое. Потому что всегда лучше подстраховаться.
Начнем со второго пункта. Он интереснее.
Один тип психобиотиков – это потенциально полезные бактерии или пробиотики. По идее эти живые микроорганизмы должны восстановить правильный баланс микробиоты, пополнив ряды «хороших» бактерий в кишечнике и вытеснив из него «плохие». Исследования с использованием пробиотиков (конкретнее Lactobacillus helveticus R0052 и Bifidobacterium longum R0175) показали, что пробиотики действительно могут улучшать психологическое состояние. Но для этого им нужно сначала добраться до кишечника. Считается, что пробиотические продукты типа йогурта, кефира, мягкого сыра, мисо или квашеной капусты — хоть и медленный, но более надежный (и точно более аппетитный) способ их доставки, чем пищевые добавки. 5 миллиардов пробиотических культур и 15 штаммов полезных бактерий в одной капсуле смотрятся эффектно на этикетке. Но после попадания в кислую среду желудка могут сократиться до единичных клеток. По крайней мере в случае бифидобактерий. Производители, конечно, прилагают все усилия для решения этой проблемы. Особенно в рекламе.
5 миллиардов пробиотических культур и 15 штаммов полезных бактерий в одной капсуле смотрятся эффектно на этикетке. Но после попадания в кислую среду желудка могут сократиться до единичных клеток. По крайней мере в случае бифидобактерий. Производители, конечно, прилагают все усилия для решения этой проблемы. Особенно в рекламе.
Второй тип психобиотиков – это пребиотики. Сложные углеводы или просто пищевые волокна, которые содержатся в растительных продуктах типа спаржи, отрубей или цикория. И выпускаются в форме добавок. Это пища для пробиотиков и «хороших» бактерий. По оценке ведущего Human Food Project Джеффа Лича, доза для достижения бифидогенного эффекта: 4–8 г в день. Пребиотики — крепкий орешек. Они не перевариваются в желудке, а доходят до толстого кишечника, где на них накидываются изголодавшиеся бактерии. Вообще хороший пребиотик действует избирательно, но с далекоидущими последствиями. Он не станет стимулировать рост каких-нибудь бесполезных клостридий. Например, инулин (в корне цикория или порошке) питает молочнокислые бактерии, которые подавляют активность патогенных микробов и снижают проницаемость кишечника. И судя по тестам, контролирует гормоны стресса и облегчает психологическую переработку эмоций. А еще помогает усваивать микроэлементы. Кстати, что насчет них? Это отдельная тема.
Например, инулин (в корне цикория или порошке) питает молочнокислые бактерии, которые подавляют активность патогенных микробов и снижают проницаемость кишечника. И судя по тестам, контролирует гормоны стресса и облегчает психологическую переработку эмоций. А еще помогает усваивать микроэлементы. Кстати, что насчет них? Это отдельная тема.
Помогают ли нутрицевтики?
БАДы или нутрицевтики — это целое направление в пищевой психиатрии. При психическом расстройствах организм недополучает питательные вещества и витамины. Возьмем к примеру гамма-аминомасляную кислоту (ГАМК). Это важный тормозящий нейротрансмиттер, который помогает справляться со стрессом и регулировать страх и тревогу. С помощью магнитно-резонансной спектроскопии, которая позволяет исследовать мозг на содержание химических элементов в режиме реального времени, установлено: у детей с СДВГ ее уровень сильно снижен. ГАМК производится особыми кишечными бактериями с использованием цинка и витамина B6. И то и другое поступает в организм с пищей. БАДы могут компенсировать их недостаток.
И то и другое поступает в организм с пищей. БАДы могут компенсировать их недостаток.
Какие пищевые добавки помогают при депрессии? Вот список самых эффективных по данным метаанализа клинических испытаний:
Есть и курьезные примеры. Например, ацетилцистеин, из которого делают АЦЦ, умеет смягчать симптомы шифозрении. Но в целом результаты пока нестабильны. Высокие показатели эффективности омеги-3 — скорее исключение. А исключения только подтверждают… Ну, вы поняли.
В чем причина? Возможно, в количестве и дозировке.
Микроэлементы в макродозах
По 12 пилюль три раза в день. 13 витаминов, 17 минералов и четыре аминокислоты. Точный состав смотрите на этикетке.
Специалистка по клинической психологии, профессор Джулия Раклидж из Новой Зеландии сравнивает свой подход к пищевой психиатрии с выстрелом из дробовика. Хороший способ попасть, когда точно не знаешь во что. Нет смысла исправлять «один крошечный сбой в биохимии», говорит она. Тем более мы пока не можем его определить. Но мы знаем, какие биохимические процессы задействованы в производстве серотонина и какие вещества нужны для этих процессов. «Вместо того чтобы делать ставку на одно из таких веществ, логичнее обеспечить ими в комплексе, чтобы создать синергический эффект». Для контроля за усвоением нутриентов она использует такие маркеры, как уровень витамина B12 в крови.
Хороший способ попасть, когда точно не знаешь во что. Нет смысла исправлять «один крошечный сбой в биохимии», говорит она. Тем более мы пока не можем его определить. Но мы знаем, какие биохимические процессы задействованы в производстве серотонина и какие вещества нужны для этих процессов. «Вместо того чтобы делать ставку на одно из таких веществ, логичнее обеспечить ими в комплексе, чтобы создать синергический эффект». Для контроля за усвоением нутриентов она использует такие маркеры, как уровень витамина B12 в крови.
На самом деле Раклидж не просто палит из пушки по воробьям. Она рассчитывает на то, что «нутриенты действуют на разных уровнях».
- «Микроэлементы могут повысить эффективность работы митохондрий — энергетических станций наших клеток».
- «А еще могут снизить уровень воспаления и оксидативного стресса, при котором опасные молекулы повреждают клетки».
- «Или просто обеспечить организм всем необходимым для нормальной жизнедеятельности».

Ее подход метит сразу в несколько целей. И судя по результатам, попадает как минимум в некоторые. Эффективность терапии макродозами БАДов — 64% при СДВГ, до 53% при симптомах депрессии, до 70% при тревожности и до 59% снижения уровня стресса при ПТСР. Неплохой результат. Лучше, чем у антидепрессантов, которые, по некоторым данным, могут даже повышать риск суицида. Хотя это пока бета-версия, в отличие от какого-нибудь флуоксетина, который выписывали миллионами еще в те времена, когда синонимом мобильного телефона была «моторола».
Правда, и к методу Раклидж есть вопросы. Больше всего сомнений вызывают ее слова о полном отсутствии побочных эффектов, что вряд ли возможно при таком массированном приеме витаминов. К тому же правильно подобранная «живая» пища, как показывают исследования, эффективнее пищевых добавок. Не зря и сама Раклидж в лекции на TED, набравшей больше миллиона просмотров, напоминает про историю с цингой: когда-то она считалась неизлечимым инфекционным заболеванием, пока одному врачу не пришло в голову лечить от нее лимоном.
Понравился материал? Подпишитесь на еженедельную email-рассылку Reminder!
Учебник по нейропластичности как конечному посреднику эффективности антидепрессантов
Abstract
Депрессия традиционно рассматривается как состояние химического дисбаланса, и предполагается, что антидепрессанты действуют посредством усиления моноаминергической нейротрансмиссии. Эти взгляды в настоящее время считаются упрощенными. В этой статье рассматривается литература о животных и людях, посвященная нейрогистологическим механизмам, лежащим в основе стресса, депрессии и лечения антидепрессантами. Патологический стресс и депрессия связаны с такими изменениями, как потеря дендритных шипов, сокращение дендритного дерева и потеря синапсов в гиппокампе и префронтальной коре.Также наблюдается снижение глии. Апоптоз может происходить при экстремальных обстоятельствах. Напротив, в миндалевидном теле наблюдается усиленное разветвление дендритов и синаптогенез. Лечение антидепрессантами защищает от некоторых, но не от всех, нейрогистологических изменений, вызванных стрессом, и даже обращает их вспять. Патологический стресс приводит к аберрантной реакции нейропластичности, характеризующейся аномально повышенной активностью миндалевидного тела и нарушением функционирования гиппокампа, префронтальной коры и нижестоящих структур.Эта аберрантная реакция нейропластичности напрямую объясняет большинство клинических симптомов депрессии. Лечение антидепрессантами защищает от вызванных стрессом патопластических нейрогистологических и нейрокогнитивных изменений. Лечение антидепрессантами также восстанавливает функциональную нейропластичность стрессированных организмов и, таким образом, предположительно облегчает реадаптацию посредством механизмов обучения и памяти. Таким образом, стресс-депрессивный синдром и терапевтическую и профилактическую эффективность лечения антидепрессантами можно объяснить с помощью жесткой аналогии.В этом контексте глутамат является важным нейротрансмиттером.
Лечение антидепрессантами защищает от некоторых, но не от всех, нейрогистологических изменений, вызванных стрессом, и даже обращает их вспять. Патологический стресс приводит к аберрантной реакции нейропластичности, характеризующейся аномально повышенной активностью миндалевидного тела и нарушением функционирования гиппокампа, префронтальной коры и нижестоящих структур.Эта аберрантная реакция нейропластичности напрямую объясняет большинство клинических симптомов депрессии. Лечение антидепрессантами защищает от вызванных стрессом патопластических нейрогистологических и нейрокогнитивных изменений. Лечение антидепрессантами также восстанавливает функциональную нейропластичность стрессированных организмов и, таким образом, предположительно облегчает реадаптацию посредством механизмов обучения и памяти. Таким образом, стресс-депрессивный синдром и терапевтическую и профилактическую эффективность лечения антидепрессантами можно объяснить с помощью жесткой аналогии.В этом контексте глутамат является важным нейротрансмиттером.
Ключевые слова: Депрессия, стресс, антидепрессанты, электрошоковая терапия, гиппокамп, миндалевидное тело, префронтальная кора, нейропластичность, механизм действия
ВВЕДЕНИЕ
лечение действует, вызывая нейропластические изменения в головном мозге. В этой статье дается простое (и очень упрощенное!) объяснение гипотезы нейропластичности действия антидепрессантов.
Как действуют антидепрессанты?
Обычные ответы в основном основаны на таких предпосылках, как «депрессия — это недостаточность нейротрансмиттеров» и «депрессия — это состояние химического дисбаланса в мозгу»; антидепрессанты действуют, «пополняя нейротрансмиттеры» или «исправляя химический дисбаланс». Такие ответы неполны и, в свете современных знаний, возможно, даже устарели.
Традиционные объяснения
Традиционные объяснения механизмов действия антидепрессантов просто описывают проксимальное действие антидепрессантов; Вот несколько примеров: [1]
Антидепрессанты ингибируют обратный захват моноаминов (таких как серотонин, норадреналин и дофамин) в пресинаптических нейронах; сохранение этих моноаминов в синаптической щели приводит к усилению стимуляции постсинаптических рецепторов и, следовательно, к усилению постсинаптической нейротрансмиссии.
 Этот эффект, по-видимому, корректирует или компенсирует нейрофизиологический дефицит, лежащий в основе депрессии. Примерами препаратов, ингибирующих обратный захват моноаминов, являются трициклические антидепрессанты (ТЦА), селективные ингибиторы обратного захвата серотонина (СИОЗС), ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) и другие.
Этот эффект, по-видимому, корректирует или компенсирует нейрофизиологический дефицит, лежащий в основе депрессии. Примерами препаратов, ингибирующих обратный захват моноаминов, являются трициклические антидепрессанты (ТЦА), селективные ингибиторы обратного захвата серотонина (СИОЗС), ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) и другие.Антидепрессанты ингибируют расщепление моноаминов (таких как серотонин, норадреналин и дофамин) в везикулах хранения пресинаптических нейронов.Сохранение этих моноаминов предположительно улучшает эффективность синаптической нейротрансмиссии. Это может скорректировать или компенсировать нейрофизиологические нарушения, лежащие в основе депрессии. Препараты, подавляющие расщепление моноаминов, представляют собой ингибиторы моноаминоксидазы (ИМАО).
Антидепрессанты увеличивают обратный захват серотонина (тианептин), увеличивают высвобождение серотонина и норадреналина (миртазапин), действуют непосредственно на рецепторы серотонина и мелатонина (агомелатин) или иным образом влияют на синаптическую нейротрансмиссию.
 За исключением агомелатина, в центре внимания объяснительных механизмов находится большой триумвират: серотонин, норадреналин и дофамин.
За исключением агомелатина, в центре внимания объяснительных механизмов находится большой триумвират: серотонин, норадреналин и дофамин.
Механизмы также были предложены для соматического лечения с антидепрессивным действием. Эти методы лечения включают электросудорожную терапию (ЭСТ), повторяющуюся транскраниальную магнитную стимуляцию (rTMS), стимуляцию блуждающего нерва (VNS), транскраниальную стимуляцию постоянным током (tDCS), светотерапию, терапию депривации сна и другие. В центре внимания настоящей статьи находятся фармакологические, а не соматические методы лечения.
Ограничения синаптических объяснений действия антидепрессантов
Фундаментальная проблема описанных выше синаптических объяснений состоит в том, что, хотя они и являются немедленными, ответ антидепрессанта задерживается. Например, ТЦА ингибируют обратный захват моноаминов, как только они всасываются в организм и транспортируются через гематоэнцефалический барьер, т. е. в течение нескольких часов после введения. Однако для развития и завершения антидепрессивного ответа требуются недели или больше, и, следовательно, для наступления ответа и ремиссии.Следовательно, сказать, что ТЦА действуют, увеличивая присутствие нейротрансмиттеров в синапсах, почти так же полно, как сказать, что автомобили работают из-за повышенного количества топлива в баке. Ясно, что точно так же, как механизмы, расположенные ниже по течению от наличия топлива в баке, позволяют автомобилю двигаться, так же должно быть что-то ниже по течению, чтобы увеличить синаптическую доступность моноаминов, чтобы полностью объяснить антидепрессивные механизмы.
Однако для развития и завершения антидепрессивного ответа требуются недели или больше, и, следовательно, для наступления ответа и ремиссии.Следовательно, сказать, что ТЦА действуют, увеличивая присутствие нейротрансмиттеров в синапсах, почти так же полно, как сказать, что автомобили работают из-за повышенного количества топлива в баке. Ясно, что точно так же, как механизмы, расположенные ниже по течению от наличия топлива в баке, позволяют автомобилю двигаться, так же должно быть что-то ниже по течению, чтобы увеличить синаптическую доступность моноаминов, чтобы полностью объяснить антидепрессивные механизмы.
Расширенные пояснения
Предложены расширенные пояснения.[1,2] Например, предполагается, что большая доступность нейротрансмиттеров в синапсе приводит к компенсаторному подавлению моноаминовых рецепторов. Подавление (облегчающих) постсинаптических рецепторов снижает активность постсинаптических нейронов. Снижение активности (тормозных) пресинаптических рецепторов увеличивает активность пресинаптических нейронов. Эти изменения развиваются от нескольких дней до недель, предположительно восстанавливают баланс активности нейронов и, предположительно, объясняют задержку начала действия антидепрессантов.Примеры таких расширенных объяснений:
Эти изменения развиваются от нескольких дней до недель, предположительно восстанавливают баланс активности нейронов и, предположительно, объясняют задержку начала действия антидепрессантов.Примеры таких расширенных объяснений:
ТЦА подавляют пресинаптические альфа-2-адренорецепторы и постсинаптические бета-адренорецепторы.
СИОЗС подавляют пресинаптические 5-НТ1а-серотонинергические рецепторы и постсинаптические 5-НТ2-серотонинергические рецепторы.
Такие расширенные объяснения все еще неполны. Все, что они добавляют к исходной модели, используя метафору автомобиля, — это вызов действия акселератора и тормоза.Нам все еще нужно знать, что происходит под капотом, то есть как работает двигатель. Вот тут-то и вступает в дело нейропластичность. . Другими словами, депрессия — это нарушение аппаратной части мозга, а не состояние химического дисбаланса.Антидепрессанты действуют, защищая и обращая по крайней мере некоторые из этих нейрогистологических изменений. [3] Эти изменения более подробно обсуждаются в последующих разделах.
[3] Эти изменения более подробно обсуждаются в последующих разделах.
ФУНДАМЕНТАЛЬНЫЕ ПРЕДПОЛОЖЕНИЯ ГИПОТЕЗЫ НЕЙРОПЛАСТИЧНОСТИ
1. Нейробиологию депрессии можно понять из последствий стресса
Давно известно, что стресс вызывает и поддерживает состояние депрессии. Обучение тому, как лучше справляться со стрессом, оказывает как терапевтическое, так и профилактическое антидепрессивное действие, о чем свидетельствуют исследования по когнитивно-поведенческой терапии (КПТ).Следовательно, то, что стресс делает с мозгом, может объяснить, почему развивается депрессия. Другими словами, нейрохимические, нейроэндокринные, нейрофизиологические и нейрогистологические эффекты стресса на мозг могут быть биологическими медиаторами депрессии у людей, предрасположенных к этому расстройству.
2. Модели стресса и депрессии на животных являются надежными моделями для понимания нейробиологии стресса, депрессии и действия антидепрессантов у человека
Имеется большое количество литературы о влиянии различных форм стресса на биологию и поведение животных и человека. Интересно, что изменения в регуляции эндокринной системы, изменения в обучении и памяти, изменения в гистологии некоторых отделов мозга, изменения в поведении и другие изменения обнаруживают сильное сходство между животными, находящимися в состоянии стресса, и людьми, находящимися в депрессии. Это, по-видимому, подтверждает использование животных моделей для объяснения механизмов стресса и антидепрессантов у людей. Таким образом, изменения мозга, вызванные стрессом, в моделях депрессии на животных могут достоверно отражать изменения мозга у людей с депрессией, а изменения, вызванные антидепрессантами, в моделях на животных могут достоверно отражать антидепрессивные механизмы у людей с депрессией.[4]
Интересно, что изменения в регуляции эндокринной системы, изменения в обучении и памяти, изменения в гистологии некоторых отделов мозга, изменения в поведении и другие изменения обнаруживают сильное сходство между животными, находящимися в состоянии стресса, и людьми, находящимися в депрессии. Это, по-видимому, подтверждает использование животных моделей для объяснения механизмов стресса и антидепрессантов у людей. Таким образом, изменения мозга, вызванные стрессом, в моделях депрессии на животных могут достоверно отражать изменения мозга у людей с депрессией, а изменения, вызванные антидепрессантами, в моделях на животных могут достоверно отражать антидепрессивные механизмы у людей с депрессией.[4]
3. Нейрогистологические изменения, вызванные стрессом, имеют фундаментальное значение для депрессии
Среди различных изменений головного мозга, вызванных стрессом, нейрогистологические изменения могут быть наиболее фундаментальными в качестве объясняющей модели депрессии. Это связано с тем, что изменения в нейронной архитектуре и связи, вероятно, вызовут фундаментальные и стойкие нарушения в функционировании пораженных нейронных территорий. Таким образом, когнитивные, аффективные и поведенческие нарушения при депрессии могут быть результатом нейрогистологических изменений (выявленных на животных моделях стресса и депрессии), которые развиваются в областях мозга, которые выполняют эти функции.
Таким образом, когнитивные, аффективные и поведенческие нарушения при депрессии могут быть результатом нейрогистологических изменений (выявленных на животных моделях стресса и депрессии), которые развиваются в областях мозга, которые выполняют эти функции.
4. Если антидепрессанты вызывают нейрогистологические изменения, противоположные тем, которые возникают в результате стресса, то такие изменения могут объяснить антидепрессивную активность
В моделях на животных стресс нарушает нейропластичность в определенных частях мозга и вызывает нейропластичность в других частях мозга; что это за изменения и как они могут нарушать когнитивные функции, аффекты и волевые реакции, обсуждаются в последующих разделах. В моделях на животных антидепрессанты обращали вспять многие поведенческие и другие эффекты стресса.Кроме того, в моделях на животных антидепрессанты обращают вспять некоторые нейрогистологические изменения, вызванные стрессом, с временным ходом, который параллелен временному ходу действия антидепрессантов у людей. Поэтому разумно предположить, что антидепрессанты обращают вспять депрессию у людей, обращая вспять нейрогистологические эффекты стресса.
Поэтому разумно предположить, что антидепрессанты обращают вспять депрессию у людей, обращая вспять нейрогистологические эффекты стресса.
Кортизол как злодей произведения
Легкий стресс обычно связан с успешной адаптацией к окружающей среде. На нейрогистологическом уровне легкий стресс также связан с благоприятными изменениями нейропластичности, которые описаны далее в этой статье.Таким образом, эти нейрогистологические изменения могут представлять собой биологические корреляты обучения, ответственного за адаптацию к стрессу.
Глюкокортикоидные рецепторы в большом количестве экспрессируются на нейронах гиппокампа и других участках головного мозга.[5] Таким образом, легкий стресс может действовать посредством физиологических сигналов глюкокортикоидов. Безусловно, на физиологическом уровне гормон стресса кортизол стимулирует нейроны гиппокампа и способствует обучению и памяти. Однако на патологических уровнях кортизол чрезмерно стимулирует нейроны гиппокампа и вызывает атрофию дендритов и потерю синапсов; в то время как эти структурные изменения, как правило, обратимы, в экстремальных ситуациях патологическая чрезмерная стимуляция кортизолом также может привести к апоптозу нейронов. [5,6] Агонизм глюкокортикоидов в медиальной префронтальной коре также влияет на обучение и память: консолидация памяти облегчается, но рабочая память ухудшается.[7]
[5,6] Агонизм глюкокортикоидов в медиальной префронтальной коре также влияет на обучение и память: консолидация памяти облегчается, но рабочая память ухудшается.[7]
Эти нейрогистологические эффекты гиперкортизолемии наблюдаются как у животных, так и у людей. На животных моделях нейрогистологические изменения развиваются в моделях стресса и депрессии, а также после хронического введения кортикостероидов нестрессовым животным. У человека когнитивные нарушения и уменьшение объема гиппокампа описаны при депрессии (при которой известно расстройство гиперкортизолемии), при синдроме Кушинга, а также после длительного приема глюкокортикоидов по медицинским показаниям.[8]
Интересно, что антагонист глюкокортикоидных рецепторов мифепристон был предложен для лечения психотической депрессии.[9] Он также может ослаблять когнитивные нарушения, связанные с депрессией.[10]
КЛЮЧЕВЫЕ СТРУКТУРЫ МОЗГА, ПОДВЕРГАЕМЫЕ СТРЕССУ
В моделях на животных существует по крайней мере три важных участка мозга, в которых стресс вызывает значительные нейрогистологические изменения. Это гиппокамп, префронтальная кора и миндалевидное тело.
Это гиппокамп, префронтальная кора и миндалевидное тело.
1.Стресс и гиппокамп
На животных моделях вызванные стрессом гистологические изменения в гиппокампе включают следующее:
Потеря синапсов
Потеря GLIA
Обездание нейрогенеза
Возможно, апоптоз (в экстремальных условиях)
, следовательно, существует снижение объема гиппокампа; такое снижение наблюдалось посмертно в животных моделях стресса и депрессии [3,11], а также в исследованиях людей с депрессией с помощью магнитно-резонансной томографии (МРТ).[16]
Почему важны эти гистологические изменения? Вот простое объяснение. В человеческом мозгу около ста миллиардов нейронов. Каждый нейрон образует синапсы в среднем примерно с тысячей других нейронов, образуя около ста триллионов синапсов в мозгу.[17] Как социальная поддержка, социальная значимость и социальная эффективность человека зависят от его социальных сетей, так и функциональные возможности нейрона зависят от его синаптических сетей и связности. Когда дендриты и синапсы утрачены, эта связность уменьшается, и пораженные нейроны становятся менее эффективными в цепях, в которых они лежат. Потеря глии (которая также играет важную роль в нейротрансмиссии), снижение нейрогенеза и апоптоза усугубляют нарушение.
Когда дендриты и синапсы утрачены, эта связность уменьшается, и пораженные нейроны становятся менее эффективными в цепях, в которых они лежат. Потеря глии (которая также играет важную роль в нейротрансмиссии), снижение нейрогенеза и апоптоза усугубляют нарушение.
Гиппокамп имеет проекции на дорсолатеральную префронтальную кору, вентральную область покрышки и гипоталамус. Таким образом, вызванные стрессом гистологические изменения в гиппокампе могут нарушать не только функционирование гиппокампа, но и функционирование в этих нижестоящих областях.[3]
Гиппокамп является ключевой структурой, участвующей в процессах обучения и памяти, особенно эксплицитной (сознательно приобретаемой) памяти. Возможно, в результате нарушения гиппокампа у животных, находящихся в состоянии стресса, и у людей, страдающих депрессией, наблюдается ухудшение обучения и памяти. [8,18] Поскольку преодоление трудностей требует неповрежденных механизмов обучения, нарушение гиппокампа также может объяснить нарушение поведения при преодолении депрессии, наблюдаемое при депрессии.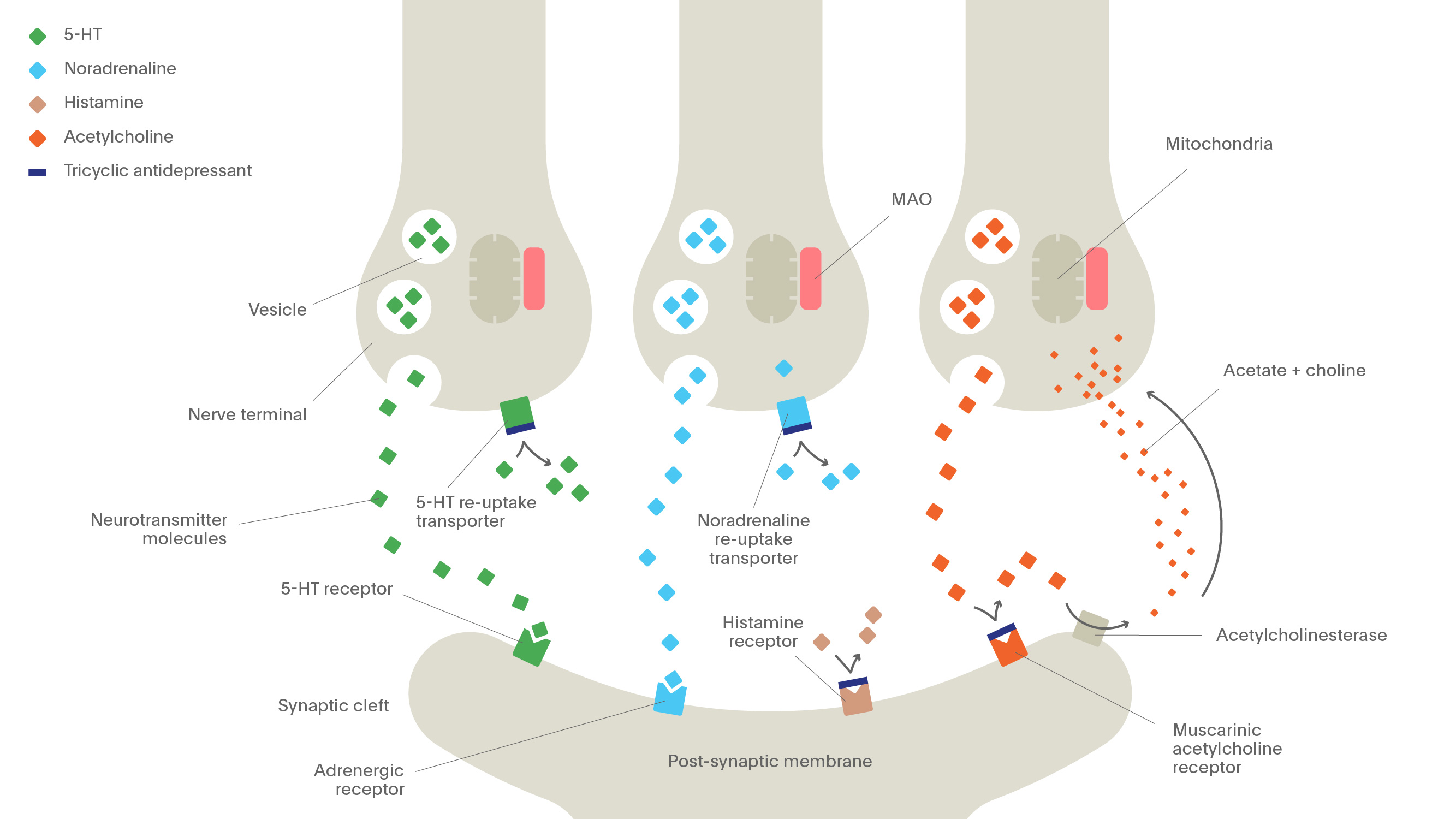
Дорсолатеральная префронтальная кора координирует свои действия с гиппокампом в регуляции эксплицитной памяти.Он также поддерживает другие важные когнитивные функции, такие как внимание и концентрация. Эти когнитивные функции также нарушаются при депрессии, возможно, как следствие нарушения гиппокампа.[3]
Вентральная область покрышки проецируется на прилежащее ядро. Мезолимбическая схема регулирует реакцию на новизну и опыт вознаграждения. Стрессовые животные плохо реагируют на новизну. Параллелью у депрессивных людей может быть ангедония. Таким образом, нарушение гиппокампа может объяснить ангедонию как последующий эффект.[3]
Гипоталамус регулирует вегетативную нервную систему и нейроэндокринную систему. Нарушение входных сигналов гипоталамуса, возможно, связанное с нарушением нижестоящего гиппокампа, может объяснить некоторые нарушения нейроэндокринной и вегетативной нервной системы, характерные для депрессии.[3]
2. Стресс и префронтальная кора
На животных моделях вызванные стрессом гистологические изменения в префронтальной коре включают следующее: [3,11,13,15] , уменьшение размера и количества глии и уменьшение общей толщины коры. [11]
[11]
Префронтальная кора регулирует когнитивные функции, такие как внимание, концентрация, обучение и память. Префронтальная кора также регулирует высшие психические функции, такие как мотивация и суждение. Все эти функции нарушаются при депрессии, возможно, в результате нейрогистологических префронтальных изменений, связанных со стрессом и депрессией.
3. Стресс и миндалевидное тело
На животных моделях вызванные стрессом гистологические изменения в миндалевидном теле разительно отличаются от таковых в гиппокампе и префронтальной коре.Описанные изменения включают следующее: [3,15]
Результирующее увеличение объема миндалевидного тела было описано как у стрессированных животных, так и у депрессивных людей. Увеличение не просто структурное; он также функционален. Однако недавний метаанализ 13 МРТ-исследований миндалины при униполярной депрессии показал, что увеличение объема миндалины было функцией лечения антидепрессантами.[19] Возможным объяснением этого противоречивого результата является различное определение границ миндалины в разных исследованиях, поскольку миндалина не является четко очерченной структурой.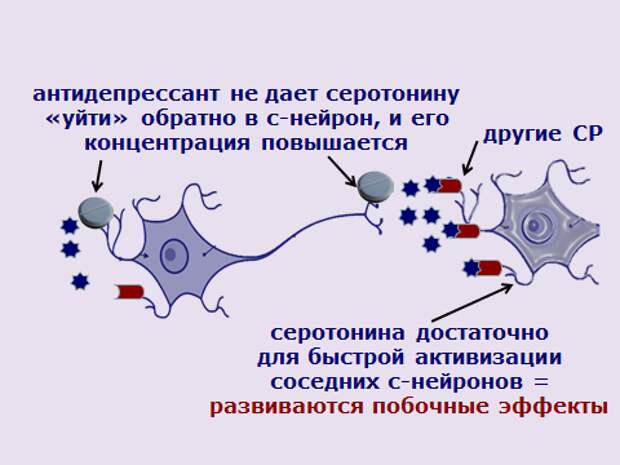 [12]
[12]
Миндалевидное тело участвует в социальном и эмоциональном обучении и, особенно, в таких эмоциях, как тревога и страх.[12] Обучение страху усиливается у стрессированных животных, т. е. они демонстрируют преувеличенную, постоянную и более генерализованную реакцию страха на анксиогенные и вредные стимулы. Параллельно с этим депрессивные люди часто беспокоятся и боятся и проявляют усиленную реакцию тревоги на незначительные провокации.
Интересно, что исследования на животных показывают, что в то время как вызванные стрессом изменения в гиппокампе постепенно обращаются вспять после устранения стресса, вызванные стрессом изменения в миндалевидном теле не обращаются вспять в течение нескольких недель или дольше.[3] На самом деле, сохранение изменений миндалевидного тела может объяснить, почему депрессивные люди чрезмерно реагируют на стресс в зависимости от черт характера, почему текущая депрессия порождает будущую депрессию, почему жизненные события имеют кумулятивный эффект в предрасположенности к депрессии и даже почему физические и сексуальное насилие над детьми предрасполагает к депрессии во взрослой жизни.
Какие нейрогистологические изменения объясняют симптом депрессии?
Предшествующее обсуждение объясняет, почему тревога, страх, ангедония, нарушение мотивации, когнитивный дефицит, нейроэндокринные изменения и дисфункция вегетативной нервной системы могут возникать в контексте нейрогистологических изменений, вызванных стрессом.Он не объясняет, как и почему развивается депрессия как симптом.
Возможно, лучший способ решить эту проблему — принять во внимание, что ни один нейроанатомический очаг не объясняет депрессию, а лишь один очаг в мозгу объясняет счастье или другие сложные эмоции. Другими словами, депрессия, как и шизофрения, может быть суммой нарушений в функционировании нескольких отделов мозга. То есть функциональные изменения в разных отделах головного мозга порождают нейроэндокринный, нейровегетативный, нейрокогнитивный, нейроповеденческий и другие дефициты, которые в совокупности формируют депрессивный синдром.В то время как депрессия как специфический симптом субъективна и не может быть отражена в животных моделях, она может быть выведена из поведения животных так же, как тревога и страх могут быть выведены из поведения животных; а нейроэндокринные, нейровегетативные, нейрокогнитивные, нейроповеденческие и другие нарушения, связанные с депрессией, могут быть индивидуально изучены на животных моделях, а также области мозга, участвующие в генезисе этих нарушений.
Почему естественный отбор благоприятствовал аберрантной нейрогистологической реакции на стресс?
Тревога и страх в результате гиперактивности миндалевидного тела, по-видимому, программируют организм на избежание будущих воздействий потенциальных стрессоров.Это может иметь значение для выживания организма и, следовательно, вида, и поэтому будет способствовать эволюционному отбору. В этом отношении может быть полезно подавление гиппокампального и префронтального ответа, потому что для выживания организму необходимо быстро реагировать, чтобы избежать стресса, а не думать о стрессе, анализировать его и демонстрировать обоснованный ответ.
Однако у современных людей, хотя реакция миндалевидного тела на стресс все еще может иметь значение, аберрантная реакция гиппокампа и префронтальной области может оказаться мертвым грузом эволюции.Аргументы в пользу эволюционного значения депрессии для выживания были высказаны в другом месте.[20]
Что делают антидепрессанты: гайки и болты нейропластичности.

Клиницисты знакомы с концепцией нейропластичности в той мере, в какой она объясняет, как одна часть мозга может взять на себя некоторые или большинство функций другой, обычно соседней, части, если эта часть повреждена по таким причинам, как травма или ишемия. Нейропластичность теперь более широко понимается как способность элементов мозга демонстрировать структурные и функциональные изменения в ответ на внешние или внутренние возмущения.
На уровне нейронов нейропластичность как следствие хронического лечения антидепрессантами более конкретно относится к каскаду нейрофизиологических, нейрохимических и нейрогистологических изменений, которые приводят к усилению синапсов, росту и разветвлению дендритов и образованию новых синапсов. Важно отметить, что также были описаны нейрогенез, глиогенез, усиление поддержки эндотелия сосудов и ингибирование механизмов апоптоза, особенно в контексте ЭСТ.В то время как большая часть литературы посвящена развитию этих изменений в гиппокампе, аналогичные изменения были описаны и в префронтальной коре. Однако нейрогенез как ответ на лечение антидепрессантами не происходит за пределами гиппокампа.
Однако нейрогенез как ответ на лечение антидепрессантами не происходит за пределами гиппокампа.
Изменения нейропластичности, классически описанные в гиппокампе в контексте обучения и памяти, такие же, как и при длительном лечении антидепрессантами [3]. Значение этого наблюдения будет обсуждаться позже.Ранние и поздние изменения нейропластичности обобщены в следующих разделах. Читатели могут заметить, что эти изменения являются общими для широкого спектра антидепрессантов и методов лечения, что также будет подчеркнуто в следующем разделе.
1. Нейропластичность – Ранние изменения
Нейропластичность инициируется возбуждающим нейротрансмиттером глутаматом. Глутамат связывается с постсинаптическим рецептором NMDA, который блокирует канал ионов кальция. Поступление кальция в постсинаптический нейрон вызывает ряд изменений; они включают молекулы нейромедиаторов и нейромодуляторов, такие как арахидоновая кислота, простаноиды, эндогенные каннабиноиды, фактор активации тромбоцитов и другие. Активация этих липидных сигнальных путей усиливается реверберирующими цепями положительной обратной связи, которые включают ретроградную нейротрансмиссию; регулируется ферментами, такими как ЦОГ-2; и он подавляется эндогенными химическими веществами, такими как кинуреновая кислота.[21]
Активация этих липидных сигнальных путей усиливается реверберирующими цепями положительной обратной связи, которые включают ретроградную нейротрансмиссию; регулируется ферментами, такими как ЦОГ-2; и он подавляется эндогенными химическими веществами, такими как кинуреновая кислота.[21]
Активация NMDA также приводит к активации кальций-кальмодулин-зависимой киназы II (CaMKII), увеличению количества AMPA-рецепторов (как и NMDA-рецептор, AMPA-рецептор также является ионотропным глутаматергическим рецептором) и к активации молчащие синапсы.[3]
Непосредственным конечным результатом глутаматергического каскада является долговременная потенциация (ДП). LTP — это усиление синапсов, которое представляет собой возникновение обучения и памяти. Также описана длительная депрессия (ДД); это синаптическое ослабление, которое предположительно представляет собой ослабление воспоминаний или разучивание. Здесь важно понимать, что обучение и память не обязательно должны относиться к явной цели; он также может касаться нейросхем, участвующих в здоровых или нездоровых познаниях, состояниях настроения и поведении. Читатели могут обратиться к Митчеллу и Бейкеру [22] за информацией о роли глутамата в депрессии.
Читатели могут обратиться к Митчеллу и Бейкеру [22] за информацией о роли глутамата в депрессии.
2. Нейропластичность – долгосрочные изменения
Нейропластичность – это больше, чем просто перепрограммирование синапсов в форме LTP и LTD. Это также связано с изменениями в нейронной проводке. Эти изменения опосредуются индукцией нейротрофических факторов, таких как мозговой нейротрофический фактор (BDNF), который действует на рецепторы тирозинкиназы (TrK) для активации внутриклеточных каскадов с участием цАМФ-зависимой протеинкиназы A (PKA), митоген-активируемой протеинкиназы (MAPK), CaMKII и другие.Эти химические вещества активируют факторы транскрипции, такие как белок, связывающий цАМФ-чувствительный элемент (CREB), который, в свою очередь, активирует синтез ферментов и белков, участвующих в структурном выражении нейропластичности. Примеры важных генов, которые индуцируются, включают BDNF, фактор роста эндотелия сосудов (VGEF) и другие. CREB и BDNF являются одними из наиболее важных участников исследований нейропластичности. [3,11]
[3,11]
Конечным результатом этих внутриклеточных сигнальных каскадов является стимуляция нейрогенеза в зубчатой извилине.Как в гиппокампе, так и в префронтальной коре также наблюдается увеличение количества глиальных клеток, увеличение богатства и сложности ветвления дендритов и увеличение образования новых синаптических связей. Динамика этих изменений нейропластичности параллельна динамике действия антидепрессантов, что позволяет сделать разумный вывод о том, что эти вызванные антидепрессантами нейрогистологические эффекты ответственны за начало клинического выздоровления.[3] Интересно, что доказательства структурных изменений мозга, вызванных антидепрессантами, могут быть обнаружены при МРТ-сканировании.Например, недавно Малыхин и соавт. [16] наблюдали увеличение объема гиппокампа у пациентов с большим депрессивным расстройством, получавших лекарства, по сравнению с пациентами, не получавшими медикаментозное лечение.
Почему индукция нейропластичности может предрасполагать к реакции на антидепрессанты? Разумной гипотезой является то, что он обращает вспять гистологические и, следовательно, когнитивные, поведенческие и другие нарушения, вызванные стрессом; эти нарушения были описаны в предыдущих разделах.
В то время как антидепрессанты устраняют структурные и функциональные последствия стресса в гиппокампе и префронтальной коре, они не обращают изменений, наблюдаемых в миндалевидном теле.[18] Таким образом, сохраняется уязвимость к стрессу, что обеспечивает биологическое объяснение наблюдаемой потребности в поддерживающей терапии антидепрессантами после успешного лечения депрессии лекарствами. Важно отметить, что лечение антидепрессантами предотвращает многие нейрогистологические изменения, вызванные стрессом [3,11], и это может объяснить, как и почему антидепрессанты защищают от вызванного стрессом рецидива депрессии.
Обучение, память и нейропластичность, вызванная антидепрессантами
Существует поразительное сходство в изменениях нейропластичности, вызванных антидепрессантами, и изменениях, лежащих в основе обучения и памяти.Поскольку эти нейрогистологические изменения противоположны изменениям, вызванным стрессом и депрессией, разумно предположить, что лечение антидепрессантами является терапевтическим за счет индукции механизмов обучения и памяти на нейрохимическом и нейрогистологическом уровнях.
Почему индукция механизмов обучения и памяти должна способствовать или способствовать выздоровлению от депрессии? Предположительно, нейропластичность может обеспечить необходимые условия для закрепления более здоровых когнитивных функций, аффективных реакций и поведенческих выражений посредством изучения более здоровых когнитивных стратегий и методов преодоления.Такому адаптивному обучению может способствовать психотерапия, или оно может возникнуть просто благодаря воздействию здоровой и благоприятной среды.
Нейропластичность как общий механизм действия антидепрессантов
Антидепрессанты — не единственные препараты, вызывающие нейропластичность. Существует обширная литература, которая показывает, что ЭСТ вызывает аналогичные изменения нейропластичности; [23–28] фактически ЭСТ может быть наиболее мощным индуктором нейропластичности в головном мозге. Физические упражнения, которые, как сообщается, обладают антидепрессивным эффектом, также вызывают изменения нейропластичности. [29–30] Предположительно, в той степени, в которой КПТ требует обучения и адаптации, можно сказать, что нейропластичность также лежит в основе КПТ. Наконец, данные также свидетельствуют о нейропластичности при применении других препаратов, оказывающих антидепрессивное действие, от кветиапина [31, 32] до tDCS [33]. Таким образом, нейропластичность представляется последним общим путем или великим объединяющим механизмом действия различных антидепрессантов.
[29–30] Предположительно, в той степени, в которой КПТ требует обучения и адаптации, можно сказать, что нейропластичность также лежит в основе КПТ. Наконец, данные также свидетельствуют о нейропластичности при применении других препаратов, оказывающих антидепрессивное действие, от кветиапина [31, 32] до tDCS [33]. Таким образом, нейропластичность представляется последним общим путем или великим объединяющим механизмом действия различных антидепрессантов.
Другие примечания
Нейрогистологические изменения при стрессе и ответе на антидепрессанты зависят от локализации.Например, как уже было сказано, стресс приводит к противоположным структурным и функциональным изменениям в миндалевидном теле по сравнению с гиппокампом и префронтальной корой. Затем, в то время как повышенная экспрессия CREB и BDNF в гиппокампе обращает вспять вызванные стрессом изменения в этой структуре, повышенная экспрессия CREB и BDNF в прилежащем ядре увеличивает выученную беспомощность и социальное поражение в моделях депрессии на животных [3].
Будущие методы лечения депрессии могут непосредственно пытаться индуцировать нейропластические изменения.Например, внутрижелудочковое введение BDNF оказывает антидепрессивное действие на животных моделях. Индукция каскада цАМФ-CREB под действием ролипрама обращает модели депрессии на животных, но, к сожалению, не дает впечатляющих результатов в клинических условиях [3].
ЗАКЛЮЧИТЕЛЬНЫЕ НАБЛЮДЕНИЯ И ПРЕДПОЛОЖЕНИЯ
Согласуется ли гипотеза о нейропластичности действия антидепрессантов с результатами, полученными в клинических или исследовательских условиях? Некоторые наблюдения кратко рассмотрены и даны спекулятивные примирительные ответы.Они могут стать основой для будущих исследований в этой области.
Наблюдения : Эпизоды депрессии могут возникать при кажущемся отсутствии стресса. Стресс не обязательно вызывает депрессивное состояние. Некоторые люди, кажется, процветают на стрессе. Стресс может привести к различным формам депрессии: горю, дистимии или большим депрессивным эпизодам. Стресс может привести к другим расстройствам, кроме депрессии.
Примирение : Нет такой вещи, как отсутствие стресса.Фактически, сами стрессы и напряжения повседневной жизни могут быть нейротоксичными для уязвимых людей, при этом уязвимость определяется генетическими и эпигенетическими механизмами. Кроме того, как показали исследования жизненных событий, эпизоды болезни могут быть спровоцированы даже положительными или желательными жизненными событиями. Генетические механизмы могут объяснить, почему стресс не оказывает вредного воздействия на одних людей, но вызывает депрессию у других. Генетические механизмы могут также объяснить, почему разные люди испытывают разные формы депрессии и почему одни люди страдают депрессией, тогда как у других развивается шизофрения или другие психические расстройства в ответ на стресс.Следует отметить, что нельзя ожидать, что нейропластичность с помощью антидепрессантов облегчит первичные симптомы шизофрении, потому что шизофрения гистологически сильно отличается от депрессии.
Наблюдение : Каждый эпизод депрессии увеличивает вероятность того, что последующие эпизоды будут более вероятными, более частыми, более тяжелыми, продолжительными и труднее поддающимися лечению.
Предположение : Нейропластичность, вызванная антидепрессантами, не может полностью устранить нейротоксические эффекты стресса.В результате долгосрочные структурные изменения в гиппокампе и префронтальной коре могут хронически ухудшать совладающее поведение. Кроме того, переобучение миндалевидного тела может предотвратить угасание нездоровых эмоциональных реакций на стрессовые ситуации, что может иметь дальнейшее негативное влияние на течение болезни. Ситуация может быть аналогична слабому колену; однажды поврежденный, он слаб на всю жизнь.
Наблюдение : Польза от комбинации антидепрессант-КПТ, как правило, больше, чем польза от лечения только антидепрессантами.
Предположение : КПТ может помочь запечатлеть здоровые познания и поведение на изменениях нейропластичности, вызванных лекарствами.
Наблюдение : Некоторые пациенты не реагируют на антидепрессанты.
Предположение : После начала терапии антидепрессантами может наступить критический период для закрепления здоровых мыслей и поведения. Если неблагоприятные условия окружающей среды не позволяют установить здоровую нервную систему в этот критический период, может возникнуть рефрактерность к антидепрессантам.Продолжение стресса может противодействовать действию антидепрессантов на нейрогистологическом уровне; это также может объяснить резистентность к антидепрессантам. Наконец, генетические и эпигенетические механизмы также могут играть роль в резистентности к лечению.
Наблюдение : Некоторые формы депрессии, такие как дистимия и реакция горя, менее чувствительны к антидепрессантам, чем большие депрессивные эпизоды.
Предположение : Дистимия характеризуется глубоко укоренившейся неспособностью адаптироваться к стрессам и напряжениям повседневной жизни.Простой индукции нейропластичности может быть недостаточно для лечения дистимии; может быть необходимо запечатлеть улучшенные механизмы выживания (с помощью соответствующей психотерапии) на вновь образованных нейроцепях. Что касается реакции горя, у пострадавших людей может не быть врожденной генетической уязвимости, которая требовала бы приема антидепрессантов для адаптации к стрессу. Здесь можно отметить, что все люди обладают врожденной нейропластической способностью, и некоторым людям, страдающим депрессией, может быть достаточно просто научиться адаптивному поведению, чтобы оправиться от депрессии; антидепрессанты не всегда могут быть необходимы.
Наблюдение : Антидепрессанты часто не лучше плацебо в клинических испытаниях, проведенных на детях и подростках с депрессией.
Предположение : Детям свойственна пластичность мозга, и они могут нуждаться в антидепрессантах не так сильно, как взрослые. С другой стороны, детям может не хватить зрелости, чтобы использовать нейропластические изменения для эмоционально и психосоциально адаптивного ответа.
Наблюдение : Различные антидепрессанты связаны с разной степенью эффективности у разных пациентов.
Предположение : Различные антидепрессанты по-разному влияют на пути, опосредующие реакцию нейропластичности, и разные пациенты имеют разные генетические и эпигенетические причины депрессии. Эти различия могут объяснить различия в эффективности антидепрессантов у разных пациентов.
Наблюдение : Антидепрессанты эффективны при расстройствах, отличных от депрессии.
Примирение : Эффективность антидепрессантов при различных психических расстройствах может потребовать индукции нейропластичности только в том случае, если эти расстройства также вызваны ошибочным обучением и могут быть исправлены путем разучения и повторного обучения.Антидепрессанты также могут действовать через механизмы, не связанные с нейропластичностью. Например, местного антихолинергического действия ТЦА может быть достаточно для лечения кислотно-пептической болезни или синдрома раздраженного кишечника.
РЕЗЮМЕ
Стресс и депрессия приводят к потере дендритных шипов, дендритной атрофии и потере синапсов в гиппокампе и префронтальной коре; глиальные клетки уменьшаются в количестве и размере. Как следствие, нарушается функционирование гиппокампа и префронтальной коры, а также функционирование нижестоящих структур, таких как прилежащее ядро и гипоталамус.Напротив, стресс также связан с усилением разветвления дендритов и образованием новых синапсов в миндалевидном теле; функционирование этой структуры может усиливаться. Нейрогистологические изменения в этих участках мозга могут объяснить, почему депрессию характеризуют ангедония, отсутствие мотивации, тревога, страх, когнитивный дефицит, нейроэндокринные изменения и изменения вегетативной нервной системы.
Антидепрессанты связаны с индукцией нейропластичности в таких структурах, как гиппокамп и префронтальная кора: происходит стимуляция нейрогенеза, глиогенеза, разветвления дендритов и образования новых синапсов.Эти изменения могут лежать в основе механизмов реакции на антидепрессанты, потому что их развитие во времени совпадает с течением действия антидепрессантов, потому что они обращают вспять нейрогистологические эффекты стресса и потому что они могут способствовать повторному обучению более здоровым познаниям, более здоровым эмоциональным реакциям и более здоровым поведенческим выражениям.
Гипотеза нейропластичности действия антидепрессантов никоим образом не является достоверной или полной. Например, это не объясняет, почему кетамин [34–35], скополамин [36–37] и ЭСТ [38] могут оказывать сильное антидепрессивное действие.Однако она гораздо более правдоподобна и полна, чем любая из более ранних гипотез действия антидепрессантов.
Рекомендуемая литература
Эта статья, как видно из названия, представляет собой учебник по стрессу, депрессии, лечению антидепрессантами и нейропластичности. За последнее десятилетие было опубликовано несколько прекрасных технических обзоров по этому вопросу, и читатель может обратиться к этим обзорам за подробностями по этому вопросу. [3,11,39] эффективность
Abstract
Депрессия традиционно рассматривается как состояние химического дисбаланса, и предполагается, что антидепрессанты действуют посредством усиления моноаминергической нейротрансмиссии.Эти взгляды в настоящее время считаются упрощенными. В этой статье рассматривается литература о животных и людях, посвященная нейрогистологическим механизмам, лежащим в основе стресса, депрессии и лечения антидепрессантами. Патологический стресс и депрессия связаны с такими изменениями, как потеря дендритных шипов, сокращение дендритного дерева и потеря синапсов в гиппокампе и префронтальной коре. Также наблюдается снижение глии. Апоптоз может происходить при экстремальных обстоятельствах. Напротив, в миндалевидном теле наблюдается усиленное разветвление дендритов и синаптогенез.Лечение антидепрессантами защищает от некоторых, но не от всех, нейрогистологических изменений, вызванных стрессом, и даже обращает их вспять. Патологический стресс приводит к аберрантной реакции нейропластичности, характеризующейся аномально повышенной активностью миндалевидного тела и нарушением функционирования гиппокампа, префронтальной коры и нижестоящих структур. Эта аберрантная реакция нейропластичности напрямую объясняет большинство клинических симптомов депрессии. Лечение антидепрессантами защищает от вызванных стрессом патопластических нейрогистологических и нейрокогнитивных изменений.Лечение антидепрессантами также восстанавливает функциональную нейропластичность стрессированных организмов и, таким образом, предположительно облегчает реадаптацию посредством механизмов обучения и памяти. Таким образом, стресс-депрессивный синдром и терапевтическую и профилактическую эффективность лечения антидепрессантами можно объяснить с помощью жесткой аналогии. В этом контексте глутамат является важным нейротрансмиттером.
Ключевые слова: Депрессия, стресс, антидепрессанты, электрошоковая терапия, гиппокамп, миндалевидное тело, префронтальная кора, нейропластичность, механизм действия
ВВЕДЕНИЕ
лечение действует, вызывая нейропластические изменения в головном мозге.В этой статье дается простое (и очень упрощенное!) объяснение гипотезы нейропластичности действия антидепрессантов.
Как действуют антидепрессанты?
Обычные ответы в основном основаны на таких предпосылках, как «депрессия — это недостаточность нейротрансмиттеров» и «депрессия — это состояние химического дисбаланса в мозгу»; антидепрессанты действуют, «пополняя нейротрансмиттеры» или «исправляя химический дисбаланс». Такие ответы неполны и, в свете современных знаний, возможно, даже устарели.
Традиционные объяснения
Традиционные объяснения механизмов действия антидепрессантов просто описывают проксимальное действие антидепрессантов; Вот несколько примеров: [1]
Антидепрессанты ингибируют обратный захват моноаминов (таких как серотонин, норадреналин и дофамин) в пресинаптических нейронах; сохранение этих моноаминов в синаптической щели приводит к усилению стимуляции постсинаптических рецепторов и, следовательно, к усилению постсинаптической нейротрансмиссии.Этот эффект, по-видимому, корректирует или компенсирует нейрофизиологический дефицит, лежащий в основе депрессии. Примерами препаратов, ингибирующих обратный захват моноаминов, являются трициклические антидепрессанты (ТЦА), селективные ингибиторы обратного захвата серотонина (СИОЗС), ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) и другие.
Антидепрессанты ингибируют расщепление моноаминов (таких как серотонин, норадреналин и дофамин) в везикулах хранения пресинаптических нейронов.Сохранение этих моноаминов предположительно улучшает эффективность синаптической нейротрансмиссии. Это может скорректировать или компенсировать нейрофизиологические нарушения, лежащие в основе депрессии. Препараты, подавляющие расщепление моноаминов, представляют собой ингибиторы моноаминоксидазы (ИМАО).
Антидепрессанты увеличивают обратный захват серотонина (тианептин), увеличивают высвобождение серотонина и норадреналина (миртазапин), действуют непосредственно на рецепторы серотонина и мелатонина (агомелатин) или иным образом влияют на синаптическую нейротрансмиссию.За исключением агомелатина, в центре внимания объяснительных механизмов находится большой триумвират: серотонин, норадреналин и дофамин.
Механизмы также были предложены для соматического лечения с антидепрессивным действием. Эти методы лечения включают электросудорожную терапию (ЭСТ), повторяющуюся транскраниальную магнитную стимуляцию (rTMS), стимуляцию блуждающего нерва (VNS), транскраниальную стимуляцию постоянным током (tDCS), светотерапию, терапию депривации сна и другие. В центре внимания настоящей статьи находятся фармакологические, а не соматические методы лечения.
Ограничения синаптических объяснений действия антидепрессантов
Фундаментальная проблема описанных выше синаптических объяснений состоит в том, что, хотя они и являются немедленными, ответ антидепрессанта задерживается. Например, ТЦА ингибируют обратный захват моноаминов, как только они всасываются в организм и транспортируются через гематоэнцефалический барьер, т. е. в течение нескольких часов после введения. Однако для развития и завершения антидепрессивного ответа требуются недели или больше, и, следовательно, для наступления ответа и ремиссии.Следовательно, сказать, что ТЦА действуют, увеличивая присутствие нейротрансмиттеров в синапсах, почти так же полно, как сказать, что автомобили работают из-за повышенного количества топлива в баке. Ясно, что точно так же, как механизмы, расположенные ниже по течению от наличия топлива в баке, позволяют автомобилю двигаться, так же должно быть что-то ниже по течению, чтобы увеличить синаптическую доступность моноаминов, чтобы полностью объяснить антидепрессивные механизмы.
Расширенные пояснения
Предложены расширенные пояснения.[1,2] Например, предполагается, что большая доступность нейротрансмиттеров в синапсе приводит к компенсаторному подавлению моноаминовых рецепторов. Подавление (облегчающих) постсинаптических рецепторов снижает активность постсинаптических нейронов. Снижение активности (тормозных) пресинаптических рецепторов увеличивает активность пресинаптических нейронов. Эти изменения развиваются от нескольких дней до недель, предположительно восстанавливают баланс активности нейронов и, предположительно, объясняют задержку начала действия антидепрессантов.Примеры таких расширенных объяснений:
ТЦА подавляют пресинаптические альфа-2-адренорецепторы и постсинаптические бета-адренорецепторы.
СИОЗС подавляют пресинаптические 5-НТ1а-серотонинергические рецепторы и постсинаптические 5-НТ2-серотонинергические рецепторы.
Такие расширенные объяснения все еще неполны. Все, что они добавляют к исходной модели, используя метафору автомобиля, — это вызов действия акселератора и тормоза.Нам все еще нужно знать, что происходит под капотом, то есть как работает двигатель. Вот тут-то и вступает в дело нейропластичность. . Другими словами, депрессия — это нарушение аппаратной части мозга, а не состояние химического дисбаланса.Антидепрессанты действуют, защищая и обращая по крайней мере некоторые из этих нейрогистологических изменений.[3] Эти изменения более подробно обсуждаются в последующих разделах.
ФУНДАМЕНТАЛЬНЫЕ ПРЕДПОЛОЖЕНИЯ ГИПОТЕЗЫ НЕЙРОПЛАСТИЧНОСТИ
1. Нейробиологию депрессии можно понять из последствий стресса
Давно известно, что стресс вызывает и поддерживает состояние депрессии. Обучение тому, как лучше справляться со стрессом, оказывает как терапевтическое, так и профилактическое антидепрессивное действие, о чем свидетельствуют исследования по когнитивно-поведенческой терапии (КПТ).Следовательно, то, что стресс делает с мозгом, может объяснить, почему развивается депрессия. Другими словами, нейрохимические, нейроэндокринные, нейрофизиологические и нейрогистологические эффекты стресса на мозг могут быть биологическими медиаторами депрессии у людей, предрасположенных к этому расстройству.
2. Модели стресса и депрессии на животных являются надежными моделями для понимания нейробиологии стресса, депрессии и действия антидепрессантов у человека
Имеется большое количество литературы о влиянии различных форм стресса на биологию и поведение животных и человека.Интересно, что изменения в регуляции эндокринной системы, изменения в обучении и памяти, изменения в гистологии некоторых отделов мозга, изменения в поведении и другие изменения обнаруживают сильное сходство между животными, находящимися в состоянии стресса, и людьми, находящимися в депрессии. Это, по-видимому, подтверждает использование животных моделей для объяснения механизмов стресса и антидепрессантов у людей. Таким образом, изменения мозга, вызванные стрессом, в моделях депрессии на животных могут достоверно отражать изменения мозга у людей с депрессией, а изменения, вызванные антидепрессантами, в моделях на животных могут достоверно отражать антидепрессивные механизмы у людей с депрессией.[4]
3. Нейрогистологические изменения, вызванные стрессом, имеют фундаментальное значение для депрессии
Среди различных изменений головного мозга, вызванных стрессом, нейрогистологические изменения могут быть наиболее фундаментальными в качестве объясняющей модели депрессии. Это связано с тем, что изменения в нейронной архитектуре и связи, вероятно, вызовут фундаментальные и стойкие нарушения в функционировании пораженных нейронных территорий. Таким образом, когнитивные, аффективные и поведенческие нарушения при депрессии могут быть результатом нейрогистологических изменений (выявленных на животных моделях стресса и депрессии), которые развиваются в областях мозга, которые выполняют эти функции.
4. Если антидепрессанты вызывают нейрогистологические изменения, противоположные тем, которые возникают в результате стресса, то такие изменения могут объяснить антидепрессивную активность
В моделях на животных стресс нарушает нейропластичность в определенных частях мозга и вызывает нейропластичность в других частях мозга; что это за изменения и как они могут нарушать когнитивные функции, аффекты и волевые реакции, обсуждаются в последующих разделах. В моделях на животных антидепрессанты обращали вспять многие поведенческие и другие эффекты стресса.Кроме того, в моделях на животных антидепрессанты обращают вспять некоторые нейрогистологические изменения, вызванные стрессом, с временным ходом, который параллелен временному ходу действия антидепрессантов у людей. Поэтому разумно предположить, что антидепрессанты обращают вспять депрессию у людей, обращая вспять нейрогистологические эффекты стресса.
Кортизол как злодей произведения
Легкий стресс обычно связан с успешной адаптацией к окружающей среде. На нейрогистологическом уровне легкий стресс также связан с благоприятными изменениями нейропластичности, которые описаны далее в этой статье.Таким образом, эти нейрогистологические изменения могут представлять собой биологические корреляты обучения, ответственного за адаптацию к стрессу.
Глюкокортикоидные рецепторы в большом количестве экспрессируются на нейронах гиппокампа и других участках головного мозга.[5] Таким образом, легкий стресс может действовать посредством физиологических сигналов глюкокортикоидов. Безусловно, на физиологическом уровне гормон стресса кортизол стимулирует нейроны гиппокампа и способствует обучению и памяти. Однако на патологических уровнях кортизол чрезмерно стимулирует нейроны гиппокампа и вызывает атрофию дендритов и потерю синапсов; в то время как эти структурные изменения, как правило, обратимы, в экстремальных ситуациях патологическая чрезмерная стимуляция кортизолом также может привести к апоптозу нейронов.[5,6] Агонизм глюкокортикоидов в медиальной префронтальной коре также влияет на обучение и память: консолидация памяти облегчается, но рабочая память ухудшается.[7]
Эти нейрогистологические эффекты гиперкортизолемии наблюдаются как у животных, так и у людей. На животных моделях нейрогистологические изменения развиваются в моделях стресса и депрессии, а также после хронического введения кортикостероидов нестрессовым животным. У человека когнитивные нарушения и уменьшение объема гиппокампа описаны при депрессии (при которой известно расстройство гиперкортизолемии), при синдроме Кушинга, а также после длительного приема глюкокортикоидов по медицинским показаниям.[8]
Интересно, что антагонист глюкокортикоидных рецепторов мифепристон был предложен для лечения психотической депрессии.[9] Он также может ослаблять когнитивные нарушения, связанные с депрессией.[10]
КЛЮЧЕВЫЕ СТРУКТУРЫ МОЗГА, ПОДВЕРГАЕМЫЕ СТРЕССУ
В моделях на животных существует по крайней мере три важных участка мозга, в которых стресс вызывает значительные нейрогистологические изменения. Это гиппокамп, префронтальная кора и миндалевидное тело.
1.Стресс и гиппокамп
На животных моделях вызванные стрессом гистологические изменения в гиппокампе включают следующее:
Потеря синапсов
Потеря GLIA
Обездание нейрогенеза
Возможно, апоптоз (в экстремальных условиях)
, следовательно, существует снижение объема гиппокампа; такое снижение наблюдалось посмертно в животных моделях стресса и депрессии [3,11], а также в исследованиях людей с депрессией с помощью магнитно-резонансной томографии (МРТ).[16]
Почему важны эти гистологические изменения? Вот простое объяснение. В человеческом мозгу около ста миллиардов нейронов. Каждый нейрон образует синапсы в среднем примерно с тысячей других нейронов, образуя около ста триллионов синапсов в мозгу.[17] Как социальная поддержка, социальная значимость и социальная эффективность человека зависят от его социальных сетей, так и функциональные возможности нейрона зависят от его синаптических сетей и связности.Когда дендриты и синапсы утрачены, эта связность уменьшается, и пораженные нейроны становятся менее эффективными в цепях, в которых они лежат. Потеря глии (которая также играет важную роль в нейротрансмиссии), снижение нейрогенеза и апоптоза усугубляют нарушение.
Гиппокамп имеет проекции на дорсолатеральную префронтальную кору, вентральную область покрышки и гипоталамус. Таким образом, вызванные стрессом гистологические изменения в гиппокампе могут нарушать не только функционирование гиппокампа, но и функционирование в этих нижестоящих областях.[3]
Гиппокамп является ключевой структурой, участвующей в процессах обучения и памяти, особенно эксплицитной (сознательно приобретаемой) памяти. Возможно, в результате нарушения гиппокампа у животных, находящихся в состоянии стресса, и у людей, страдающих депрессией, наблюдается ухудшение обучения и памяти. [8,18] Поскольку преодоление трудностей требует неповрежденных механизмов обучения, нарушение гиппокампа также может объяснить нарушение поведения при преодолении депрессии, наблюдаемое при депрессии.
Дорсолатеральная префронтальная кора координирует свои действия с гиппокампом в регуляции эксплицитной памяти.Он также поддерживает другие важные когнитивные функции, такие как внимание и концентрация. Эти когнитивные функции также нарушаются при депрессии, возможно, как следствие нарушения гиппокампа.[3]
Вентральная область покрышки проецируется на прилежащее ядро. Мезолимбическая схема регулирует реакцию на новизну и опыт вознаграждения. Стрессовые животные плохо реагируют на новизну. Параллелью у депрессивных людей может быть ангедония. Таким образом, нарушение гиппокампа может объяснить ангедонию как последующий эффект.[3]
Гипоталамус регулирует вегетативную нервную систему и нейроэндокринную систему. Нарушение входных сигналов гипоталамуса, возможно, связанное с нарушением нижестоящего гиппокампа, может объяснить некоторые нарушения нейроэндокринной и вегетативной нервной системы, характерные для депрессии.[3]
2. Стресс и префронтальная кора
На животных моделях вызванные стрессом гистологические изменения в префронтальной коре включают следующее: [3,11,13,15] , уменьшение размера и количества глии и уменьшение общей толщины коры.[11]
Префронтальная кора регулирует когнитивные функции, такие как внимание, концентрация, обучение и память. Префронтальная кора также регулирует высшие психические функции, такие как мотивация и суждение. Все эти функции нарушаются при депрессии, возможно, в результате нейрогистологических префронтальных изменений, связанных со стрессом и депрессией.
3. Стресс и миндалевидное тело
На животных моделях вызванные стрессом гистологические изменения в миндалевидном теле разительно отличаются от таковых в гиппокампе и префронтальной коре.Описанные изменения включают следующее: [3,15]
Результирующее увеличение объема миндалевидного тела было описано как у стрессированных животных, так и у депрессивных людей. Увеличение не просто структурное; он также функционален. Однако недавний метаанализ 13 МРТ-исследований миндалины при униполярной депрессии показал, что увеличение объема миндалины было функцией лечения антидепрессантами.[19] Возможным объяснением этого противоречивого результата является различное определение границ миндалины в разных исследованиях, поскольку миндалина не является четко очерченной структурой.[12]
Миндалевидное тело участвует в социальном и эмоциональном обучении и, особенно, в таких эмоциях, как тревога и страх.[12] Обучение страху усиливается у стрессированных животных, т. е. они демонстрируют преувеличенную, постоянную и более генерализованную реакцию страха на анксиогенные и вредные стимулы. Параллельно с этим депрессивные люди часто беспокоятся и боятся и проявляют усиленную реакцию тревоги на незначительные провокации.
Интересно, что исследования на животных показывают, что в то время как вызванные стрессом изменения в гиппокампе постепенно обращаются вспять после устранения стресса, вызванные стрессом изменения в миндалевидном теле не обращаются вспять в течение нескольких недель или дольше.[3] На самом деле, сохранение изменений миндалевидного тела может объяснить, почему депрессивные люди чрезмерно реагируют на стресс в зависимости от черт характера, почему текущая депрессия порождает будущую депрессию, почему жизненные события имеют кумулятивный эффект в предрасположенности к депрессии и даже почему физические и сексуальное насилие над детьми предрасполагает к депрессии во взрослой жизни.
Какие нейрогистологические изменения объясняют симптом депрессии?
Предшествующее обсуждение объясняет, почему тревога, страх, ангедония, нарушение мотивации, когнитивный дефицит, нейроэндокринные изменения и дисфункция вегетативной нервной системы могут возникать в контексте нейрогистологических изменений, вызванных стрессом.Он не объясняет, как и почему развивается депрессия как симптом.
Возможно, лучший способ решить эту проблему — принять во внимание, что ни один нейроанатомический очаг не объясняет депрессию, а лишь один очаг в мозгу объясняет счастье или другие сложные эмоции. Другими словами, депрессия, как и шизофрения, может быть суммой нарушений в функционировании нескольких отделов мозга. То есть функциональные изменения в разных отделах головного мозга порождают нейроэндокринный, нейровегетативный, нейрокогнитивный, нейроповеденческий и другие дефициты, которые в совокупности формируют депрессивный синдром.В то время как депрессия как специфический симптом субъективна и не может быть отражена в животных моделях, она может быть выведена из поведения животных так же, как тревога и страх могут быть выведены из поведения животных; а нейроэндокринные, нейровегетативные, нейрокогнитивные, нейроповеденческие и другие нарушения, связанные с депрессией, могут быть индивидуально изучены на животных моделях, а также области мозга, участвующие в генезисе этих нарушений.
Почему естественный отбор благоприятствовал аберрантной нейрогистологической реакции на стресс?
Тревога и страх в результате гиперактивности миндалевидного тела, по-видимому, программируют организм на избежание будущих воздействий потенциальных стрессоров.Это может иметь значение для выживания организма и, следовательно, вида, и поэтому будет способствовать эволюционному отбору. В этом отношении может быть полезно подавление гиппокампального и префронтального ответа, потому что для выживания организму необходимо быстро реагировать, чтобы избежать стресса, а не думать о стрессе, анализировать его и демонстрировать обоснованный ответ.
Однако у современных людей, хотя реакция миндалевидного тела на стресс все еще может иметь значение, аберрантная реакция гиппокампа и префронтальной области может оказаться мертвым грузом эволюции.Аргументы в пользу эволюционного значения депрессии для выживания были высказаны в другом месте.[20]
Что делают антидепрессанты: гайки и болты нейропластичности.
Клиницисты знакомы с концепцией нейропластичности в той мере, в какой она объясняет, как одна часть мозга может взять на себя некоторые или большинство функций другой, обычно соседней, части, если эта часть повреждена по таким причинам, как травма или ишемия. Нейропластичность теперь более широко понимается как способность элементов мозга демонстрировать структурные и функциональные изменения в ответ на внешние или внутренние возмущения.
На уровне нейронов нейропластичность как следствие хронического лечения антидепрессантами более конкретно относится к каскаду нейрофизиологических, нейрохимических и нейрогистологических изменений, которые приводят к усилению синапсов, росту и разветвлению дендритов и образованию новых синапсов. Важно отметить, что также были описаны нейрогенез, глиогенез, усиление поддержки эндотелия сосудов и ингибирование механизмов апоптоза, особенно в контексте ЭСТ.В то время как большая часть литературы посвящена развитию этих изменений в гиппокампе, аналогичные изменения были описаны и в префронтальной коре. Однако нейрогенез как ответ на лечение антидепрессантами не происходит за пределами гиппокампа.
Изменения нейропластичности, классически описанные в гиппокампе в контексте обучения и памяти, такие же, как и при длительном лечении антидепрессантами [3]. Значение этого наблюдения будет обсуждаться позже.Ранние и поздние изменения нейропластичности обобщены в следующих разделах. Читатели могут заметить, что эти изменения являются общими для широкого спектра антидепрессантов и методов лечения, что также будет подчеркнуто в следующем разделе.
1. Нейропластичность – Ранние изменения
Нейропластичность инициируется возбуждающим нейротрансмиттером глутаматом. Глутамат связывается с постсинаптическим рецептором NMDA, который блокирует канал ионов кальция. Поступление кальция в постсинаптический нейрон вызывает ряд изменений; они включают молекулы нейромедиаторов и нейромодуляторов, такие как арахидоновая кислота, простаноиды, эндогенные каннабиноиды, фактор активации тромбоцитов и другие.Активация этих липидных сигнальных путей усиливается реверберирующими цепями положительной обратной связи, которые включают ретроградную нейротрансмиссию; регулируется ферментами, такими как ЦОГ-2; и он подавляется эндогенными химическими веществами, такими как кинуреновая кислота.[21]
Активация NMDA также приводит к активации кальций-кальмодулин-зависимой киназы II (CaMKII), увеличению количества AMPA-рецепторов (как и NMDA-рецептор, AMPA-рецептор также является ионотропным глутаматергическим рецептором) и к активации молчащие синапсы.[3]
Непосредственным конечным результатом глутаматергического каскада является долговременная потенциация (ДП). LTP — это усиление синапсов, которое представляет собой возникновение обучения и памяти. Также описана длительная депрессия (ДД); это синаптическое ослабление, которое предположительно представляет собой ослабление воспоминаний или разучивание. Здесь важно понимать, что обучение и память не обязательно должны относиться к явной цели; он также может касаться нейросхем, участвующих в здоровых или нездоровых познаниях, состояниях настроения и поведении.Читатели могут обратиться к Митчеллу и Бейкеру [22] за информацией о роли глутамата в депрессии.
2. Нейропластичность – долгосрочные изменения
Нейропластичность – это больше, чем просто перепрограммирование синапсов в форме LTP и LTD. Это также связано с изменениями в нейронной проводке. Эти изменения опосредуются индукцией нейротрофических факторов, таких как мозговой нейротрофический фактор (BDNF), который действует на рецепторы тирозинкиназы (TrK) для активации внутриклеточных каскадов с участием цАМФ-зависимой протеинкиназы A (PKA), митоген-активируемой протеинкиназы (MAPK), CaMKII и другие.Эти химические вещества активируют факторы транскрипции, такие как белок, связывающий цАМФ-чувствительный элемент (CREB), который, в свою очередь, активирует синтез ферментов и белков, участвующих в структурном выражении нейропластичности. Примеры важных генов, которые индуцируются, включают BDNF, фактор роста эндотелия сосудов (VGEF) и другие. CREB и BDNF являются одними из наиболее важных участников исследований нейропластичности. [3,11]
Конечным результатом этих внутриклеточных сигнальных каскадов является стимуляция нейрогенеза в зубчатой извилине.Как в гиппокампе, так и в префронтальной коре также наблюдается увеличение количества глиальных клеток, увеличение богатства и сложности ветвления дендритов и увеличение образования новых синаптических связей. Динамика этих изменений нейропластичности параллельна динамике действия антидепрессантов, что позволяет сделать разумный вывод о том, что эти вызванные антидепрессантами нейрогистологические эффекты ответственны за начало клинического выздоровления.[3] Интересно, что доказательства структурных изменений мозга, вызванных антидепрессантами, могут быть обнаружены при МРТ-сканировании.Например, недавно Малыхин и соавт. [16] наблюдали увеличение объема гиппокампа у пациентов с большим депрессивным расстройством, получавших лекарства, по сравнению с пациентами, не получавшими медикаментозное лечение.
Почему индукция нейропластичности может предрасполагать к реакции на антидепрессанты? Разумной гипотезой является то, что он обращает вспять гистологические и, следовательно, когнитивные, поведенческие и другие нарушения, вызванные стрессом; эти нарушения были описаны в предыдущих разделах.
В то время как антидепрессанты устраняют структурные и функциональные последствия стресса в гиппокампе и префронтальной коре, они не обращают изменений, наблюдаемых в миндалевидном теле.[18] Таким образом, сохраняется уязвимость к стрессу, что обеспечивает биологическое объяснение наблюдаемой потребности в поддерживающей терапии антидепрессантами после успешного лечения депрессии лекарствами. Важно отметить, что лечение антидепрессантами предотвращает многие нейрогистологические изменения, вызванные стрессом [3,11], и это может объяснить, как и почему антидепрессанты защищают от вызванного стрессом рецидива депрессии.
Обучение, память и нейропластичность, вызванная антидепрессантами
Существует поразительное сходство в изменениях нейропластичности, вызванных антидепрессантами, и изменениях, лежащих в основе обучения и памяти.Поскольку эти нейрогистологические изменения противоположны изменениям, вызванным стрессом и депрессией, разумно предположить, что лечение антидепрессантами является терапевтическим за счет индукции механизмов обучения и памяти на нейрохимическом и нейрогистологическом уровнях.
Почему индукция механизмов обучения и памяти должна способствовать или способствовать выздоровлению от депрессии? Предположительно, нейропластичность может обеспечить необходимые условия для закрепления более здоровых когнитивных функций, аффективных реакций и поведенческих выражений посредством изучения более здоровых когнитивных стратегий и методов преодоления.Такому адаптивному обучению может способствовать психотерапия, или оно может возникнуть просто благодаря воздействию здоровой и благоприятной среды.
Нейропластичность как общий механизм действия антидепрессантов
Антидепрессанты — не единственные препараты, вызывающие нейропластичность. Существует обширная литература, которая показывает, что ЭСТ вызывает аналогичные изменения нейропластичности; [23–28] фактически ЭСТ может быть наиболее мощным индуктором нейропластичности в головном мозге. Физические упражнения, которые, как сообщается, обладают антидепрессивным эффектом, также вызывают изменения нейропластичности.[29–30] Предположительно, в той степени, в которой КПТ требует обучения и адаптации, можно сказать, что нейропластичность также лежит в основе КПТ. Наконец, данные также свидетельствуют о нейропластичности при применении других препаратов, оказывающих антидепрессивное действие, от кветиапина [31, 32] до tDCS [33]. Таким образом, нейропластичность представляется последним общим путем или великим объединяющим механизмом действия различных антидепрессантов.
Другие примечания
Нейрогистологические изменения при стрессе и ответе на антидепрессанты зависят от локализации.Например, как уже было сказано, стресс приводит к противоположным структурным и функциональным изменениям в миндалевидном теле по сравнению с гиппокампом и префронтальной корой. Затем, в то время как повышенная экспрессия CREB и BDNF в гиппокампе обращает вспять вызванные стрессом изменения в этой структуре, повышенная экспрессия CREB и BDNF в прилежащем ядре увеличивает выученную беспомощность и социальное поражение в моделях депрессии на животных [3].
Будущие методы лечения депрессии могут непосредственно пытаться индуцировать нейропластические изменения.Например, внутрижелудочковое введение BDNF оказывает антидепрессивное действие на животных моделях. Индукция каскада цАМФ-CREB под действием ролипрама обращает модели депрессии на животных, но, к сожалению, не дает впечатляющих результатов в клинических условиях [3].
ЗАКЛЮЧИТЕЛЬНЫЕ НАБЛЮДЕНИЯ И ПРЕДПОЛОЖЕНИЯ
Согласуется ли гипотеза о нейропластичности действия антидепрессантов с результатами, полученными в клинических или исследовательских условиях? Некоторые наблюдения кратко рассмотрены и даны спекулятивные примирительные ответы.Они могут стать основой для будущих исследований в этой области.
Наблюдения : Эпизоды депрессии могут возникать при кажущемся отсутствии стресса. Стресс не обязательно вызывает депрессивное состояние. Некоторые люди, кажется, процветают на стрессе. Стресс может привести к различным формам депрессии: горю, дистимии или большим депрессивным эпизодам. Стресс может привести к другим расстройствам, кроме депрессии.
Примирение : Нет такой вещи, как отсутствие стресса.Фактически, сами стрессы и напряжения повседневной жизни могут быть нейротоксичными для уязвимых людей, при этом уязвимость определяется генетическими и эпигенетическими механизмами. Кроме того, как показали исследования жизненных событий, эпизоды болезни могут быть спровоцированы даже положительными или желательными жизненными событиями. Генетические механизмы могут объяснить, почему стресс не оказывает вредного воздействия на одних людей, но вызывает депрессию у других. Генетические механизмы могут также объяснить, почему разные люди испытывают разные формы депрессии и почему одни люди страдают депрессией, тогда как у других развивается шизофрения или другие психические расстройства в ответ на стресс.Следует отметить, что нельзя ожидать, что нейропластичность с помощью антидепрессантов облегчит первичные симптомы шизофрении, потому что шизофрения гистологически сильно отличается от депрессии.
Наблюдение : Каждый эпизод депрессии увеличивает вероятность того, что последующие эпизоды будут более вероятными, более частыми, более тяжелыми, продолжительными и труднее поддающимися лечению.
Предположение : Нейропластичность, вызванная антидепрессантами, не может полностью устранить нейротоксические эффекты стресса.В результате долгосрочные структурные изменения в гиппокампе и префронтальной коре могут хронически ухудшать совладающее поведение. Кроме того, переобучение миндалевидного тела может предотвратить угасание нездоровых эмоциональных реакций на стрессовые ситуации, что может иметь дальнейшее негативное влияние на течение болезни. Ситуация может быть аналогична слабому колену; однажды поврежденный, он слаб на всю жизнь.
Наблюдение : Польза от комбинации антидепрессант-КПТ, как правило, больше, чем польза от лечения только антидепрессантами.
Предположение : КПТ может помочь запечатлеть здоровые познания и поведение на изменениях нейропластичности, вызванных лекарствами.
Наблюдение : Некоторые пациенты не реагируют на антидепрессанты.
Предположение : После начала терапии антидепрессантами может наступить критический период для закрепления здоровых мыслей и поведения. Если неблагоприятные условия окружающей среды не позволяют установить здоровую нервную систему в этот критический период, может возникнуть рефрактерность к антидепрессантам.Продолжение стресса может противодействовать действию антидепрессантов на нейрогистологическом уровне; это также может объяснить резистентность к антидепрессантам. Наконец, генетические и эпигенетические механизмы также могут играть роль в резистентности к лечению.
Наблюдение : Некоторые формы депрессии, такие как дистимия и реакция горя, менее чувствительны к антидепрессантам, чем большие депрессивные эпизоды.
Предположение : Дистимия характеризуется глубоко укоренившейся неспособностью адаптироваться к стрессам и напряжениям повседневной жизни.Простой индукции нейропластичности может быть недостаточно для лечения дистимии; может быть необходимо запечатлеть улучшенные механизмы выживания (с помощью соответствующей психотерапии) на вновь образованных нейроцепях. Что касается реакции горя, у пострадавших людей может не быть врожденной генетической уязвимости, которая требовала бы приема антидепрессантов для адаптации к стрессу. Здесь можно отметить, что все люди обладают врожденной нейропластической способностью, и некоторым людям, страдающим депрессией, может быть достаточно просто научиться адаптивному поведению, чтобы оправиться от депрессии; антидепрессанты не всегда могут быть необходимы.
Наблюдение : Антидепрессанты часто не лучше плацебо в клинических испытаниях, проведенных на детях и подростках с депрессией.
Предположение : Детям свойственна пластичность мозга, и они могут нуждаться в антидепрессантах не так сильно, как взрослые. С другой стороны, детям может не хватить зрелости, чтобы использовать нейропластические изменения для эмоционально и психосоциально адаптивного ответа.
Наблюдение : Различные антидепрессанты связаны с разной степенью эффективности у разных пациентов.
Предположение : Различные антидепрессанты по-разному влияют на пути, опосредующие реакцию нейропластичности, и разные пациенты имеют разные генетические и эпигенетические причины депрессии. Эти различия могут объяснить различия в эффективности антидепрессантов у разных пациентов.
Наблюдение : Антидепрессанты эффективны при расстройствах, отличных от депрессии.
Примирение : Эффективность антидепрессантов при различных психических расстройствах может потребовать индукции нейропластичности только в том случае, если эти расстройства также вызваны ошибочным обучением и могут быть исправлены путем разучения и повторного обучения.Антидепрессанты также могут действовать через механизмы, не связанные с нейропластичностью. Например, местного антихолинергического действия ТЦА может быть достаточно для лечения кислотно-пептической болезни или синдрома раздраженного кишечника.
РЕЗЮМЕ
Стресс и депрессия приводят к потере дендритных шипов, дендритной атрофии и потере синапсов в гиппокампе и префронтальной коре; глиальные клетки уменьшаются в количестве и размере. Как следствие, нарушается функционирование гиппокампа и префронтальной коры, а также функционирование нижестоящих структур, таких как прилежащее ядро и гипоталамус.Напротив, стресс также связан с усилением разветвления дендритов и образованием новых синапсов в миндалевидном теле; функционирование этой структуры может усиливаться. Нейрогистологические изменения в этих участках мозга могут объяснить, почему депрессию характеризуют ангедония, отсутствие мотивации, тревога, страх, когнитивный дефицит, нейроэндокринные изменения и изменения вегетативной нервной системы.
Антидепрессанты связаны с индукцией нейропластичности в таких структурах, как гиппокамп и префронтальная кора: происходит стимуляция нейрогенеза, глиогенеза, разветвления дендритов и образования новых синапсов.Эти изменения могут лежать в основе механизмов реакции на антидепрессанты, потому что их развитие во времени совпадает с течением действия антидепрессантов, потому что они обращают вспять нейрогистологические эффекты стресса и потому что они могут способствовать повторному обучению более здоровым познаниям, более здоровым эмоциональным реакциям и более здоровым поведенческим выражениям.
Гипотеза нейропластичности действия антидепрессантов никоим образом не является достоверной или полной. Например, это не объясняет, почему кетамин [34–35], скополамин [36–37] и ЭСТ [38] могут оказывать сильное антидепрессивное действие.Однако она гораздо более правдоподобна и полна, чем любая из более ранних гипотез действия антидепрессантов.
Рекомендуемая литература
Эта статья, как видно из названия, представляет собой учебник по стрессу, депрессии, лечению антидепрессантами и нейропластичности. За последнее десятилетие было опубликовано несколько прекрасных технических обзоров по этому вопросу, и читатель может обратиться к этим обзорам за подробностями по этому вопросу. [3,11,39] эффективность
Abstract
Депрессия традиционно рассматривается как состояние химического дисбаланса, и предполагается, что антидепрессанты действуют посредством усиления моноаминергической нейротрансмиссии.Эти взгляды в настоящее время считаются упрощенными. В этой статье рассматривается литература о животных и людях, посвященная нейрогистологическим механизмам, лежащим в основе стресса, депрессии и лечения антидепрессантами. Патологический стресс и депрессия связаны с такими изменениями, как потеря дендритных шипов, сокращение дендритного дерева и потеря синапсов в гиппокампе и префронтальной коре. Также наблюдается снижение глии. Апоптоз может происходить при экстремальных обстоятельствах. Напротив, в миндалевидном теле наблюдается усиленное разветвление дендритов и синаптогенез.Лечение антидепрессантами защищает от некоторых, но не от всех, нейрогистологических изменений, вызванных стрессом, и даже обращает их вспять. Патологический стресс приводит к аберрантной реакции нейропластичности, характеризующейся аномально повышенной активностью миндалевидного тела и нарушением функционирования гиппокампа, префронтальной коры и нижестоящих структур. Эта аберрантная реакция нейропластичности напрямую объясняет большинство клинических симптомов депрессии. Лечение антидепрессантами защищает от вызванных стрессом патопластических нейрогистологических и нейрокогнитивных изменений.Лечение антидепрессантами также восстанавливает функциональную нейропластичность стрессированных организмов и, таким образом, предположительно облегчает реадаптацию посредством механизмов обучения и памяти. Таким образом, стресс-депрессивный синдром и терапевтическую и профилактическую эффективность лечения антидепрессантами можно объяснить с помощью жесткой аналогии. В этом контексте глутамат является важным нейротрансмиттером.
Ключевые слова: Депрессия, стресс, антидепрессанты, электрошоковая терапия, гиппокамп, миндалевидное тело, префронтальная кора, нейропластичность, механизм действия
ВВЕДЕНИЕ
лечение действует, вызывая нейропластические изменения в головном мозге.В этой статье дается простое (и очень упрощенное!) объяснение гипотезы нейропластичности действия антидепрессантов.
Как действуют антидепрессанты?
Обычные ответы в основном основаны на таких предпосылках, как «депрессия — это недостаточность нейротрансмиттеров» и «депрессия — это состояние химического дисбаланса в мозгу»; антидепрессанты действуют, «пополняя нейротрансмиттеры» или «исправляя химический дисбаланс». Такие ответы неполны и, в свете современных знаний, возможно, даже устарели.
Традиционные объяснения
Традиционные объяснения механизмов действия антидепрессантов просто описывают проксимальное действие антидепрессантов; Вот несколько примеров: [1]
Антидепрессанты ингибируют обратный захват моноаминов (таких как серотонин, норадреналин и дофамин) в пресинаптических нейронах; сохранение этих моноаминов в синаптической щели приводит к усилению стимуляции постсинаптических рецепторов и, следовательно, к усилению постсинаптической нейротрансмиссии.Этот эффект, по-видимому, корректирует или компенсирует нейрофизиологический дефицит, лежащий в основе депрессии. Примерами препаратов, ингибирующих обратный захват моноаминов, являются трициклические антидепрессанты (ТЦА), селективные ингибиторы обратного захвата серотонина (СИОЗС), ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) и другие.
Антидепрессанты ингибируют расщепление моноаминов (таких как серотонин, норадреналин и дофамин) в везикулах хранения пресинаптических нейронов.Сохранение этих моноаминов предположительно улучшает эффективность синаптической нейротрансмиссии. Это может скорректировать или компенсировать нейрофизиологические нарушения, лежащие в основе депрессии. Препараты, подавляющие расщепление моноаминов, представляют собой ингибиторы моноаминоксидазы (ИМАО).
Антидепрессанты увеличивают обратный захват серотонина (тианептин), увеличивают высвобождение серотонина и норадреналина (миртазапин), действуют непосредственно на рецепторы серотонина и мелатонина (агомелатин) или иным образом влияют на синаптическую нейротрансмиссию.За исключением агомелатина, в центре внимания объяснительных механизмов находится большой триумвират: серотонин, норадреналин и дофамин.
Механизмы также были предложены для соматического лечения с антидепрессивным действием. Эти методы лечения включают электросудорожную терапию (ЭСТ), повторяющуюся транскраниальную магнитную стимуляцию (rTMS), стимуляцию блуждающего нерва (VNS), транскраниальную стимуляцию постоянным током (tDCS), светотерапию, терапию депривации сна и другие. В центре внимания настоящей статьи находятся фармакологические, а не соматические методы лечения.
Ограничения синаптических объяснений действия антидепрессантов
Фундаментальная проблема описанных выше синаптических объяснений состоит в том, что, хотя они и являются немедленными, ответ антидепрессанта задерживается. Например, ТЦА ингибируют обратный захват моноаминов, как только они всасываются в организм и транспортируются через гематоэнцефалический барьер, т. е. в течение нескольких часов после введения. Однако для развития и завершения антидепрессивного ответа требуются недели или больше, и, следовательно, для наступления ответа и ремиссии.Следовательно, сказать, что ТЦА действуют, увеличивая присутствие нейротрансмиттеров в синапсах, почти так же полно, как сказать, что автомобили работают из-за повышенного количества топлива в баке. Ясно, что точно так же, как механизмы, расположенные ниже по течению от наличия топлива в баке, позволяют автомобилю двигаться, так же должно быть что-то ниже по течению, чтобы увеличить синаптическую доступность моноаминов, чтобы полностью объяснить антидепрессивные механизмы.
Расширенные пояснения
Предложены расширенные пояснения.[1,2] Например, предполагается, что большая доступность нейротрансмиттеров в синапсе приводит к компенсаторному подавлению моноаминовых рецепторов. Подавление (облегчающих) постсинаптических рецепторов снижает активность постсинаптических нейронов. Снижение активности (тормозных) пресинаптических рецепторов увеличивает активность пресинаптических нейронов. Эти изменения развиваются от нескольких дней до недель, предположительно восстанавливают баланс активности нейронов и, предположительно, объясняют задержку начала действия антидепрессантов.Примеры таких расширенных объяснений:
ТЦА подавляют пресинаптические альфа-2-адренорецепторы и постсинаптические бета-адренорецепторы.
СИОЗС подавляют пресинаптические 5-НТ1а-серотонинергические рецепторы и постсинаптические 5-НТ2-серотонинергические рецепторы.
Такие расширенные объяснения все еще неполны. Все, что они добавляют к исходной модели, используя метафору автомобиля, — это вызов действия акселератора и тормоза.Нам все еще нужно знать, что происходит под капотом, то есть как работает двигатель. Вот тут-то и вступает в дело нейропластичность. . Другими словами, депрессия — это нарушение аппаратной части мозга, а не состояние химического дисбаланса.Антидепрессанты действуют, защищая и обращая по крайней мере некоторые из этих нейрогистологических изменений.[3] Эти изменения более подробно обсуждаются в последующих разделах.
ФУНДАМЕНТАЛЬНЫЕ ПРЕДПОЛОЖЕНИЯ ГИПОТЕЗЫ НЕЙРОПЛАСТИЧНОСТИ
1. Нейробиологию депрессии можно понять из последствий стресса
Давно известно, что стресс вызывает и поддерживает состояние депрессии. Обучение тому, как лучше справляться со стрессом, оказывает как терапевтическое, так и профилактическое антидепрессивное действие, о чем свидетельствуют исследования по когнитивно-поведенческой терапии (КПТ).Следовательно, то, что стресс делает с мозгом, может объяснить, почему развивается депрессия. Другими словами, нейрохимические, нейроэндокринные, нейрофизиологические и нейрогистологические эффекты стресса на мозг могут быть биологическими медиаторами депрессии у людей, предрасположенных к этому расстройству.
2. Модели стресса и депрессии на животных являются надежными моделями для понимания нейробиологии стресса, депрессии и действия антидепрессантов у человека
Имеется большое количество литературы о влиянии различных форм стресса на биологию и поведение животных и человека.Интересно, что изменения в регуляции эндокринной системы, изменения в обучении и памяти, изменения в гистологии некоторых отделов мозга, изменения в поведении и другие изменения обнаруживают сильное сходство между животными, находящимися в состоянии стресса, и людьми, находящимися в депрессии. Это, по-видимому, подтверждает использование животных моделей для объяснения механизмов стресса и антидепрессантов у людей. Таким образом, изменения мозга, вызванные стрессом, в моделях депрессии на животных могут достоверно отражать изменения мозга у людей с депрессией, а изменения, вызванные антидепрессантами, в моделях на животных могут достоверно отражать антидепрессивные механизмы у людей с депрессией.[4]
3. Нейрогистологические изменения, вызванные стрессом, имеют фундаментальное значение для депрессии
Среди различных изменений головного мозга, вызванных стрессом, нейрогистологические изменения могут быть наиболее фундаментальными в качестве объясняющей модели депрессии. Это связано с тем, что изменения в нейронной архитектуре и связи, вероятно, вызовут фундаментальные и стойкие нарушения в функционировании пораженных нейронных территорий. Таким образом, когнитивные, аффективные и поведенческие нарушения при депрессии могут быть результатом нейрогистологических изменений (выявленных на животных моделях стресса и депрессии), которые развиваются в областях мозга, которые выполняют эти функции.
4. Если антидепрессанты вызывают нейрогистологические изменения, противоположные тем, которые возникают в результате стресса, то такие изменения могут объяснить антидепрессивную активность
В моделях на животных стресс нарушает нейропластичность в определенных частях мозга и вызывает нейропластичность в других частях мозга; что это за изменения и как они могут нарушать когнитивные функции, аффекты и волевые реакции, обсуждаются в последующих разделах. В моделях на животных антидепрессанты обращали вспять многие поведенческие и другие эффекты стресса.Кроме того, в моделях на животных антидепрессанты обращают вспять некоторые нейрогистологические изменения, вызванные стрессом, с временным ходом, который параллелен временному ходу действия антидепрессантов у людей. Поэтому разумно предположить, что антидепрессанты обращают вспять депрессию у людей, обращая вспять нейрогистологические эффекты стресса.
Кортизол как злодей произведения
Легкий стресс обычно связан с успешной адаптацией к окружающей среде. На нейрогистологическом уровне легкий стресс также связан с благоприятными изменениями нейропластичности, которые описаны далее в этой статье.Таким образом, эти нейрогистологические изменения могут представлять собой биологические корреляты обучения, ответственного за адаптацию к стрессу.
Глюкокортикоидные рецепторы в большом количестве экспрессируются на нейронах гиппокампа и других участках головного мозга.[5] Таким образом, легкий стресс может действовать посредством физиологических сигналов глюкокортикоидов. Безусловно, на физиологическом уровне гормон стресса кортизол стимулирует нейроны гиппокампа и способствует обучению и памяти. Однако на патологических уровнях кортизол чрезмерно стимулирует нейроны гиппокампа и вызывает атрофию дендритов и потерю синапсов; в то время как эти структурные изменения, как правило, обратимы, в экстремальных ситуациях патологическая чрезмерная стимуляция кортизолом также может привести к апоптозу нейронов.[5,6] Агонизм глюкокортикоидов в медиальной префронтальной коре также влияет на обучение и память: консолидация памяти облегчается, но рабочая память ухудшается.[7]
Эти нейрогистологические эффекты гиперкортизолемии наблюдаются как у животных, так и у людей. На животных моделях нейрогистологические изменения развиваются в моделях стресса и депрессии, а также после хронического введения кортикостероидов нестрессовым животным. У человека когнитивные нарушения и уменьшение объема гиппокампа описаны при депрессии (при которой известно расстройство гиперкортизолемии), при синдроме Кушинга, а также после длительного приема глюкокортикоидов по медицинским показаниям.[8]
Интересно, что антагонист глюкокортикоидных рецепторов мифепристон был предложен для лечения психотической депрессии.[9] Он также может ослаблять когнитивные нарушения, связанные с депрессией.[10]
КЛЮЧЕВЫЕ СТРУКТУРЫ МОЗГА, ПОДВЕРГАЕМЫЕ СТРЕССУ
В моделях на животных существует по крайней мере три важных участка мозга, в которых стресс вызывает значительные нейрогистологические изменения. Это гиппокамп, префронтальная кора и миндалевидное тело.
1.Стресс и гиппокамп
На животных моделях вызванные стрессом гистологические изменения в гиппокампе включают следующее:
Потеря синапсов
Потеря GLIA
Обездание нейрогенеза
Возможно, апоптоз (в экстремальных условиях)
, следовательно, существует снижение объема гиппокампа; такое снижение наблюдалось посмертно в животных моделях стресса и депрессии [3,11], а также в исследованиях людей с депрессией с помощью магнитно-резонансной томографии (МРТ).[16]
Почему важны эти гистологические изменения? Вот простое объяснение. В человеческом мозгу около ста миллиардов нейронов. Каждый нейрон образует синапсы в среднем примерно с тысячей других нейронов, образуя около ста триллионов синапсов в мозгу.[17] Как социальная поддержка, социальная значимость и социальная эффективность человека зависят от его социальных сетей, так и функциональные возможности нейрона зависят от его синаптических сетей и связности.Когда дендриты и синапсы утрачены, эта связность уменьшается, и пораженные нейроны становятся менее эффективными в цепях, в которых они лежат. Потеря глии (которая также играет важную роль в нейротрансмиссии), снижение нейрогенеза и апоптоза усугубляют нарушение.
Гиппокамп имеет проекции на дорсолатеральную префронтальную кору, вентральную область покрышки и гипоталамус. Таким образом, вызванные стрессом гистологические изменения в гиппокампе могут нарушать не только функционирование гиппокампа, но и функционирование в этих нижестоящих областях.[3]
Гиппокамп является ключевой структурой, участвующей в процессах обучения и памяти, особенно эксплицитной (сознательно приобретаемой) памяти. Возможно, в результате нарушения гиппокампа у животных, находящихся в состоянии стресса, и у людей, страдающих депрессией, наблюдается ухудшение обучения и памяти. [8,18] Поскольку преодоление трудностей требует неповрежденных механизмов обучения, нарушение гиппокампа также может объяснить нарушение поведения при преодолении депрессии, наблюдаемое при депрессии.
Дорсолатеральная префронтальная кора координирует свои действия с гиппокампом в регуляции эксплицитной памяти.Он также поддерживает другие важные когнитивные функции, такие как внимание и концентрация. Эти когнитивные функции также нарушаются при депрессии, возможно, как следствие нарушения гиппокампа.[3]
Вентральная область покрышки проецируется на прилежащее ядро. Мезолимбическая схема регулирует реакцию на новизну и опыт вознаграждения. Стрессовые животные плохо реагируют на новизну. Параллелью у депрессивных людей может быть ангедония. Таким образом, нарушение гиппокампа может объяснить ангедонию как последующий эффект.[3]
Гипоталамус регулирует вегетативную нервную систему и нейроэндокринную систему. Нарушение входных сигналов гипоталамуса, возможно, связанное с нарушением нижестоящего гиппокампа, может объяснить некоторые нарушения нейроэндокринной и вегетативной нервной системы, характерные для депрессии.[3]
2. Стресс и префронтальная кора
На животных моделях вызванные стрессом гистологические изменения в префронтальной коре включают следующее: [3,11,13,15] , уменьшение размера и количества глии и уменьшение общей толщины коры.[11]
Префронтальная кора регулирует когнитивные функции, такие как внимание, концентрация, обучение и память. Префронтальная кора также регулирует высшие психические функции, такие как мотивация и суждение. Все эти функции нарушаются при депрессии, возможно, в результате нейрогистологических префронтальных изменений, связанных со стрессом и депрессией.
3. Стресс и миндалевидное тело
На животных моделях вызванные стрессом гистологические изменения в миндалевидном теле разительно отличаются от таковых в гиппокампе и префронтальной коре.Описанные изменения включают следующее: [3,15]
Результирующее увеличение объема миндалевидного тела было описано как у стрессированных животных, так и у депрессивных людей. Увеличение не просто структурное; он также функционален. Однако недавний метаанализ 13 МРТ-исследований миндалины при униполярной депрессии показал, что увеличение объема миндалины было функцией лечения антидепрессантами.[19] Возможным объяснением этого противоречивого результата является различное определение границ миндалины в разных исследованиях, поскольку миндалина не является четко очерченной структурой.[12]
Миндалевидное тело участвует в социальном и эмоциональном обучении и, особенно, в таких эмоциях, как тревога и страх.[12] Обучение страху усиливается у стрессированных животных, т. е. они демонстрируют преувеличенную, постоянную и более генерализованную реакцию страха на анксиогенные и вредные стимулы. Параллельно с этим депрессивные люди часто беспокоятся и боятся и проявляют усиленную реакцию тревоги на незначительные провокации.
Интересно, что исследования на животных показывают, что в то время как вызванные стрессом изменения в гиппокампе постепенно обращаются вспять после устранения стресса, вызванные стрессом изменения в миндалевидном теле не обращаются вспять в течение нескольких недель или дольше.[3] На самом деле, сохранение изменений миндалевидного тела может объяснить, почему депрессивные люди чрезмерно реагируют на стресс в зависимости от черт характера, почему текущая депрессия порождает будущую депрессию, почему жизненные события имеют кумулятивный эффект в предрасположенности к депрессии и даже почему физические и сексуальное насилие над детьми предрасполагает к депрессии во взрослой жизни.
Какие нейрогистологические изменения объясняют симптом депрессии?
Предшествующее обсуждение объясняет, почему тревога, страх, ангедония, нарушение мотивации, когнитивный дефицит, нейроэндокринные изменения и дисфункция вегетативной нервной системы могут возникать в контексте нейрогистологических изменений, вызванных стрессом.Он не объясняет, как и почему развивается депрессия как симптом.
Возможно, лучший способ решить эту проблему — принять во внимание, что ни один нейроанатомический очаг не объясняет депрессию, а лишь один очаг в мозгу объясняет счастье или другие сложные эмоции. Другими словами, депрессия, как и шизофрения, может быть суммой нарушений в функционировании нескольких отделов мозга. То есть функциональные изменения в разных отделах головного мозга порождают нейроэндокринный, нейровегетативный, нейрокогнитивный, нейроповеденческий и другие дефициты, которые в совокупности формируют депрессивный синдром.В то время как депрессия как специфический симптом субъективна и не может быть отражена в животных моделях, она может быть выведена из поведения животных так же, как тревога и страх могут быть выведены из поведения животных; а нейроэндокринные, нейровегетативные, нейрокогнитивные, нейроповеденческие и другие нарушения, связанные с депрессией, могут быть индивидуально изучены на животных моделях, а также области мозга, участвующие в генезисе этих нарушений.
Почему естественный отбор благоприятствовал аберрантной нейрогистологической реакции на стресс?
Тревога и страх в результате гиперактивности миндалевидного тела, по-видимому, программируют организм на избежание будущих воздействий потенциальных стрессоров.Это может иметь значение для выживания организма и, следовательно, вида, и поэтому будет способствовать эволюционному отбору. В этом отношении может быть полезно подавление гиппокампального и префронтального ответа, потому что для выживания организму необходимо быстро реагировать, чтобы избежать стресса, а не думать о стрессе, анализировать его и демонстрировать обоснованный ответ.
Однако у современных людей, хотя реакция миндалевидного тела на стресс все еще может иметь значение, аберрантная реакция гиппокампа и префронтальной области может оказаться мертвым грузом эволюции.Аргументы в пользу эволюционного значения депрессии для выживания были высказаны в другом месте.[20]
Что делают антидепрессанты: гайки и болты нейропластичности.
Клиницисты знакомы с концепцией нейропластичности в той мере, в какой она объясняет, как одна часть мозга может взять на себя некоторые или большинство функций другой, обычно соседней, части, если эта часть повреждена по таким причинам, как травма или ишемия. Нейропластичность теперь более широко понимается как способность элементов мозга демонстрировать структурные и функциональные изменения в ответ на внешние или внутренние возмущения.
На уровне нейронов нейропластичность как следствие хронического лечения антидепрессантами более конкретно относится к каскаду нейрофизиологических, нейрохимических и нейрогистологических изменений, которые приводят к усилению синапсов, росту и разветвлению дендритов и образованию новых синапсов. Важно отметить, что также были описаны нейрогенез, глиогенез, усиление поддержки эндотелия сосудов и ингибирование механизмов апоптоза, особенно в контексте ЭСТ.В то время как большая часть литературы посвящена развитию этих изменений в гиппокампе, аналогичные изменения были описаны и в префронтальной коре. Однако нейрогенез как ответ на лечение антидепрессантами не происходит за пределами гиппокампа.
Изменения нейропластичности, классически описанные в гиппокампе в контексте обучения и памяти, такие же, как и при длительном лечении антидепрессантами [3]. Значение этого наблюдения будет обсуждаться позже.Ранние и поздние изменения нейропластичности обобщены в следующих разделах. Читатели могут заметить, что эти изменения являются общими для широкого спектра антидепрессантов и методов лечения, что также будет подчеркнуто в следующем разделе.
1. Нейропластичность – Ранние изменения
Нейропластичность инициируется возбуждающим нейротрансмиттером глутаматом. Глутамат связывается с постсинаптическим рецептором NMDA, который блокирует канал ионов кальция. Поступление кальция в постсинаптический нейрон вызывает ряд изменений; они включают молекулы нейромедиаторов и нейромодуляторов, такие как арахидоновая кислота, простаноиды, эндогенные каннабиноиды, фактор активации тромбоцитов и другие.Активация этих липидных сигнальных путей усиливается реверберирующими цепями положительной обратной связи, которые включают ретроградную нейротрансмиссию; регулируется ферментами, такими как ЦОГ-2; и он подавляется эндогенными химическими веществами, такими как кинуреновая кислота.[21]
Активация NMDA также приводит к активации кальций-кальмодулин-зависимой киназы II (CaMKII), увеличению количества AMPA-рецепторов (как и NMDA-рецептор, AMPA-рецептор также является ионотропным глутаматергическим рецептором) и к активации молчащие синапсы.[3]
Непосредственным конечным результатом глутаматергического каскада является долговременная потенциация (ДП). LTP — это усиление синапсов, которое представляет собой возникновение обучения и памяти. Также описана длительная депрессия (ДД); это синаптическое ослабление, которое предположительно представляет собой ослабление воспоминаний или разучивание. Здесь важно понимать, что обучение и память не обязательно должны относиться к явной цели; он также может касаться нейросхем, участвующих в здоровых или нездоровых познаниях, состояниях настроения и поведении.Читатели могут обратиться к Митчеллу и Бейкеру [22] за информацией о роли глутамата в депрессии.
2. Нейропластичность – долгосрочные изменения
Нейропластичность – это больше, чем просто перепрограммирование синапсов в форме LTP и LTD. Это также связано с изменениями в нейронной проводке. Эти изменения опосредуются индукцией нейротрофических факторов, таких как мозговой нейротрофический фактор (BDNF), который действует на рецепторы тирозинкиназы (TrK) для активации внутриклеточных каскадов с участием цАМФ-зависимой протеинкиназы A (PKA), митоген-активируемой протеинкиназы (MAPK), CaMKII и другие.Эти химические вещества активируют факторы транскрипции, такие как белок, связывающий цАМФ-чувствительный элемент (CREB), который, в свою очередь, активирует синтез ферментов и белков, участвующих в структурном выражении нейропластичности. Примеры важных генов, которые индуцируются, включают BDNF, фактор роста эндотелия сосудов (VGEF) и другие. CREB и BDNF являются одними из наиболее важных участников исследований нейропластичности. [3,11]
Конечным результатом этих внутриклеточных сигнальных каскадов является стимуляция нейрогенеза в зубчатой извилине.Как в гиппокампе, так и в префронтальной коре также наблюдается увеличение количества глиальных клеток, увеличение богатства и сложности ветвления дендритов и увеличение образования новых синаптических связей. Динамика этих изменений нейропластичности параллельна динамике действия антидепрессантов, что позволяет сделать разумный вывод о том, что эти вызванные антидепрессантами нейрогистологические эффекты ответственны за начало клинического выздоровления.[3] Интересно, что доказательства структурных изменений мозга, вызванных антидепрессантами, могут быть обнаружены при МРТ-сканировании.Например, недавно Малыхин и соавт. [16] наблюдали увеличение объема гиппокампа у пациентов с большим депрессивным расстройством, получавших лекарства, по сравнению с пациентами, не получавшими медикаментозное лечение.
Почему индукция нейропластичности может предрасполагать к реакции на антидепрессанты? Разумной гипотезой является то, что он обращает вспять гистологические и, следовательно, когнитивные, поведенческие и другие нарушения, вызванные стрессом; эти нарушения были описаны в предыдущих разделах.
В то время как антидепрессанты устраняют структурные и функциональные последствия стресса в гиппокампе и префронтальной коре, они не обращают изменений, наблюдаемых в миндалевидном теле.[18] Таким образом, сохраняется уязвимость к стрессу, что обеспечивает биологическое объяснение наблюдаемой потребности в поддерживающей терапии антидепрессантами после успешного лечения депрессии лекарствами. Важно отметить, что лечение антидепрессантами предотвращает многие нейрогистологические изменения, вызванные стрессом [3,11], и это может объяснить, как и почему антидепрессанты защищают от вызванного стрессом рецидива депрессии.
Обучение, память и нейропластичность, вызванная антидепрессантами
Существует поразительное сходство в изменениях нейропластичности, вызванных антидепрессантами, и изменениях, лежащих в основе обучения и памяти.Поскольку эти нейрогистологические изменения противоположны изменениям, вызванным стрессом и депрессией, разумно предположить, что лечение антидепрессантами является терапевтическим за счет индукции механизмов обучения и памяти на нейрохимическом и нейрогистологическом уровнях.
Почему индукция механизмов обучения и памяти должна способствовать или способствовать выздоровлению от депрессии? Предположительно, нейропластичность может обеспечить необходимые условия для закрепления более здоровых когнитивных функций, аффективных реакций и поведенческих выражений посредством изучения более здоровых когнитивных стратегий и методов преодоления.Такому адаптивному обучению может способствовать психотерапия, или оно может возникнуть просто благодаря воздействию здоровой и благоприятной среды.
Нейропластичность как общий механизм действия антидепрессантов
Антидепрессанты — не единственные препараты, вызывающие нейропластичность. Существует обширная литература, которая показывает, что ЭСТ вызывает аналогичные изменения нейропластичности; [23–28] фактически ЭСТ может быть наиболее мощным индуктором нейропластичности в головном мозге. Физические упражнения, которые, как сообщается, обладают антидепрессивным эффектом, также вызывают изменения нейропластичности.[29–30] Предположительно, в той степени, в которой КПТ требует обучения и адаптации, можно сказать, что нейропластичность также лежит в основе КПТ. Наконец, данные также свидетельствуют о нейропластичности при применении других препаратов, оказывающих антидепрессивное действие, от кветиапина [31, 32] до tDCS [33]. Таким образом, нейропластичность представляется последним общим путем или великим объединяющим механизмом действия различных антидепрессантов.
Другие примечания
Нейрогистологические изменения при стрессе и ответе на антидепрессанты зависят от локализации.Например, как уже было сказано, стресс приводит к противоположным структурным и функциональным изменениям в миндалевидном теле по сравнению с гиппокампом и префронтальной корой. Затем, в то время как повышенная экспрессия CREB и BDNF в гиппокампе обращает вспять вызванные стрессом изменения в этой структуре, повышенная экспрессия CREB и BDNF в прилежащем ядре увеличивает выученную беспомощность и социальное поражение в моделях депрессии на животных [3].
Будущие методы лечения депрессии могут непосредственно пытаться индуцировать нейропластические изменения.Например, внутрижелудочковое введение BDNF оказывает антидепрессивное действие на животных моделях. Индукция каскада цАМФ-CREB под действием ролипрама обращает модели депрессии на животных, но, к сожалению, не дает впечатляющих результатов в клинических условиях [3].
ЗАКЛЮЧИТЕЛЬНЫЕ НАБЛЮДЕНИЯ И ПРЕДПОЛОЖЕНИЯ
Согласуется ли гипотеза о нейропластичности действия антидепрессантов с результатами, полученными в клинических или исследовательских условиях? Некоторые наблюдения кратко рассмотрены и даны спекулятивные примирительные ответы.Они могут стать основой для будущих исследований в этой области.
Наблюдения : Эпизоды депрессии могут возникать при кажущемся отсутствии стресса. Стресс не обязательно вызывает депрессивное состояние. Некоторые люди, кажется, процветают на стрессе. Стресс может привести к различным формам депрессии: горю, дистимии или большим депрессивным эпизодам. Стресс может привести к другим расстройствам, кроме депрессии.
Примирение : Нет такой вещи, как отсутствие стресса.Фактически, сами стрессы и напряжения повседневной жизни могут быть нейротоксичными для уязвимых людей, при этом уязвимость определяется генетическими и эпигенетическими механизмами. Кроме того, как показали исследования жизненных событий, эпизоды болезни могут быть спровоцированы даже положительными или желательными жизненными событиями. Генетические механизмы могут объяснить, почему стресс не оказывает вредного воздействия на одних людей, но вызывает депрессию у других. Генетические механизмы могут также объяснить, почему разные люди испытывают разные формы депрессии и почему одни люди страдают депрессией, тогда как у других развивается шизофрения или другие психические расстройства в ответ на стресс.Следует отметить, что нельзя ожидать, что нейропластичность с помощью антидепрессантов облегчит первичные симптомы шизофрении, потому что шизофрения гистологически сильно отличается от депрессии.
Наблюдение : Каждый эпизод депрессии увеличивает вероятность того, что последующие эпизоды будут более вероятными, более частыми, более тяжелыми, продолжительными и труднее поддающимися лечению.
Предположение : Нейропластичность, вызванная антидепрессантами, не может полностью устранить нейротоксические эффекты стресса.В результате долгосрочные структурные изменения в гиппокампе и префронтальной коре могут хронически ухудшать совладающее поведение. Кроме того, переобучение миндалевидного тела может предотвратить угасание нездоровых эмоциональных реакций на стрессовые ситуации, что может иметь дальнейшее негативное влияние на течение болезни. Ситуация может быть аналогична слабому колену; однажды поврежденный, он слаб на всю жизнь.
Наблюдение : Польза от комбинации антидепрессант-КПТ, как правило, больше, чем польза от лечения только антидепрессантами.
Предположение : КПТ может помочь запечатлеть здоровые познания и поведение на изменениях нейропластичности, вызванных лекарствами.
Наблюдение : Некоторые пациенты не реагируют на антидепрессанты.
Предположение : После начала терапии антидепрессантами может наступить критический период для закрепления здоровых мыслей и поведения. Если неблагоприятные условия окружающей среды не позволяют установить здоровую нервную систему в этот критический период, может возникнуть рефрактерность к антидепрессантам.Продолжение стресса может противодействовать действию антидепрессантов на нейрогистологическом уровне; это также может объяснить резистентность к антидепрессантам. Наконец, генетические и эпигенетические механизмы также могут играть роль в резистентности к лечению.
Наблюдение : Некоторые формы депрессии, такие как дистимия и реакция горя, менее чувствительны к антидепрессантам, чем большие депрессивные эпизоды.
Предположение : Дистимия характеризуется глубоко укоренившейся неспособностью адаптироваться к стрессам и напряжениям повседневной жизни.Простой индукции нейропластичности может быть недостаточно для лечения дистимии; может быть необходимо запечатлеть улучшенные механизмы выживания (с помощью соответствующей психотерапии) на вновь образованных нейроцепях. Что касается реакции горя, у пострадавших людей может не быть врожденной генетической уязвимости, которая требовала бы приема антидепрессантов для адаптации к стрессу. Здесь можно отметить, что все люди обладают врожденной нейропластической способностью, и некоторым людям, страдающим депрессией, может быть достаточно просто научиться адаптивному поведению, чтобы оправиться от депрессии; антидепрессанты не всегда могут быть необходимы.
Наблюдение : Антидепрессанты часто не лучше плацебо в клинических испытаниях, проведенных на детях и подростках с депрессией.
Предположение : Детям свойственна пластичность мозга, и они могут нуждаться в антидепрессантах не так сильно, как взрослые. С другой стороны, детям может не хватить зрелости, чтобы использовать нейропластические изменения для эмоционально и психосоциально адаптивного ответа.
Наблюдение : Различные антидепрессанты связаны с разной степенью эффективности у разных пациентов.
Предположение : Различные антидепрессанты по-разному влияют на пути, опосредующие реакцию нейропластичности, и разные пациенты имеют разные генетические и эпигенетические причины депрессии. Эти различия могут объяснить различия в эффективности антидепрессантов у разных пациентов.
Наблюдение : Антидепрессанты эффективны при расстройствах, отличных от депрессии.
Примирение : Эффективность антидепрессантов при различных психических расстройствах может потребовать индукции нейропластичности только в том случае, если эти расстройства также вызваны ошибочным обучением и могут быть исправлены путем разучения и повторного обучения.Антидепрессанты также могут действовать через механизмы, не связанные с нейропластичностью. Например, местного антихолинергического действия ТЦА может быть достаточно для лечения кислотно-пептической болезни или синдрома раздраженного кишечника.
РЕЗЮМЕ
Стресс и депрессия приводят к потере дендритных шипов, дендритной атрофии и потере синапсов в гиппокампе и префронтальной коре; глиальные клетки уменьшаются в количестве и размере. Как следствие, нарушается функционирование гиппокампа и префронтальной коры, а также функционирование нижестоящих структур, таких как прилежащее ядро и гипоталамус.Напротив, стресс также связан с усилением разветвления дендритов и образованием новых синапсов в миндалевидном теле; функционирование этой структуры может усиливаться. Нейрогистологические изменения в этих участках мозга могут объяснить, почему депрессию характеризуют ангедония, отсутствие мотивации, тревога, страх, когнитивный дефицит, нейроэндокринные изменения и изменения вегетативной нервной системы.
Антидепрессанты связаны с индукцией нейропластичности в таких структурах, как гиппокамп и префронтальная кора: происходит стимуляция нейрогенеза, глиогенеза, разветвления дендритов и образования новых синапсов.Эти изменения могут лежать в основе механизмов реакции на антидепрессанты, потому что их развитие во времени совпадает с течением действия антидепрессантов, потому что они обращают вспять нейрогистологические эффекты стресса и потому что они могут способствовать повторному обучению более здоровым познаниям, более здоровым эмоциональным реакциям и более здоровым поведенческим выражениям.
Гипотеза нейропластичности действия антидепрессантов никоим образом не является достоверной или полной. Например, это не объясняет, почему кетамин [34–35], скополамин [36–37] и ЭСТ [38] могут оказывать сильное антидепрессивное действие.Однако она гораздо более правдоподобна и полна, чем любая из более ранних гипотез действия антидепрессантов.
Рекомендуемая литература
Эта статья, как видно из названия, представляет собой учебник по стрессу, депрессии, лечению антидепрессантами и нейропластичности. За последнее десятилетие было опубликовано несколько прекрасных технических обзоров по этому вопросу, и читатель может обратиться к этим обзорам за подробностями по этому вопросу. [3,11,39] эффективность
Abstract
Депрессия традиционно рассматривается как состояние химического дисбаланса, и предполагается, что антидепрессанты действуют посредством усиления моноаминергической нейротрансмиссии.Эти взгляды в настоящее время считаются упрощенными. В этой статье рассматривается литература о животных и людях, посвященная нейрогистологическим механизмам, лежащим в основе стресса, депрессии и лечения антидепрессантами. Патологический стресс и депрессия связаны с такими изменениями, как потеря дендритных шипов, сокращение дендритного дерева и потеря синапсов в гиппокампе и префронтальной коре. Также наблюдается снижение глии. Апоптоз может происходить при экстремальных обстоятельствах. Напротив, в миндалевидном теле наблюдается усиленное разветвление дендритов и синаптогенез.Лечение антидепрессантами защищает от некоторых, но не от всех, нейрогистологических изменений, вызванных стрессом, и даже обращает их вспять. Патологический стресс приводит к аберрантной реакции нейропластичности, характеризующейся аномально повышенной активностью миндалевидного тела и нарушением функционирования гиппокампа, префронтальной коры и нижестоящих структур. Эта аберрантная реакция нейропластичности напрямую объясняет большинство клинических симптомов депрессии. Лечение антидепрессантами защищает от вызванных стрессом патопластических нейрогистологических и нейрокогнитивных изменений.Лечение антидепрессантами также восстанавливает функциональную нейропластичность стрессированных организмов и, таким образом, предположительно облегчает реадаптацию посредством механизмов обучения и памяти. Таким образом, стресс-депрессивный синдром и терапевтическую и профилактическую эффективность лечения антидепрессантами можно объяснить с помощью жесткой аналогии. В этом контексте глутамат является важным нейротрансмиттером.
Ключевые слова: Депрессия, стресс, антидепрессанты, электрошоковая терапия, гиппокамп, миндалевидное тело, префронтальная кора, нейропластичность, механизм действия
ВВЕДЕНИЕ
лечение действует, вызывая нейропластические изменения в головном мозге.В этой статье дается простое (и очень упрощенное!) объяснение гипотезы нейропластичности действия антидепрессантов.
Как действуют антидепрессанты?
Обычные ответы в основном основаны на таких предпосылках, как «депрессия — это недостаточность нейротрансмиттеров» и «депрессия — это состояние химического дисбаланса в мозгу»; антидепрессанты действуют, «пополняя нейротрансмиттеры» или «исправляя химический дисбаланс». Такие ответы неполны и, в свете современных знаний, возможно, даже устарели.
Традиционные объяснения
Традиционные объяснения механизмов действия антидепрессантов просто описывают проксимальное действие антидепрессантов; Вот несколько примеров: [1]
Антидепрессанты ингибируют обратный захват моноаминов (таких как серотонин, норадреналин и дофамин) в пресинаптических нейронах; сохранение этих моноаминов в синаптической щели приводит к усилению стимуляции постсинаптических рецепторов и, следовательно, к усилению постсинаптической нейротрансмиссии.Этот эффект, по-видимому, корректирует или компенсирует нейрофизиологический дефицит, лежащий в основе депрессии. Примерами препаратов, ингибирующих обратный захват моноаминов, являются трициклические антидепрессанты (ТЦА), селективные ингибиторы обратного захвата серотонина (СИОЗС), ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) и другие.
Антидепрессанты ингибируют расщепление моноаминов (таких как серотонин, норадреналин и дофамин) в везикулах хранения пресинаптических нейронов.Сохранение этих моноаминов предположительно улучшает эффективность синаптической нейротрансмиссии. Это может скорректировать или компенсировать нейрофизиологические нарушения, лежащие в основе депрессии. Препараты, подавляющие расщепление моноаминов, представляют собой ингибиторы моноаминоксидазы (ИМАО).
Антидепрессанты увеличивают обратный захват серотонина (тианептин), увеличивают высвобождение серотонина и норадреналина (миртазапин), действуют непосредственно на рецепторы серотонина и мелатонина (агомелатин) или иным образом влияют на синаптическую нейротрансмиссию.За исключением агомелатина, в центре внимания объяснительных механизмов находится большой триумвират: серотонин, норадреналин и дофамин.
Механизмы также были предложены для соматического лечения с антидепрессивным действием. Эти методы лечения включают электросудорожную терапию (ЭСТ), повторяющуюся транскраниальную магнитную стимуляцию (rTMS), стимуляцию блуждающего нерва (VNS), транскраниальную стимуляцию постоянным током (tDCS), светотерапию, терапию депривации сна и другие. В центре внимания настоящей статьи находятся фармакологические, а не соматические методы лечения.
Ограничения синаптических объяснений действия антидепрессантов
Фундаментальная проблема описанных выше синаптических объяснений состоит в том, что, хотя они и являются немедленными, ответ антидепрессанта задерживается. Например, ТЦА ингибируют обратный захват моноаминов, как только они всасываются в организм и транспортируются через гематоэнцефалический барьер, т. е. в течение нескольких часов после введения. Однако для развития и завершения антидепрессивного ответа требуются недели или больше, и, следовательно, для наступления ответа и ремиссии.Следовательно, сказать, что ТЦА действуют, увеличивая присутствие нейротрансмиттеров в синапсах, почти так же полно, как сказать, что автомобили работают из-за повышенного количества топлива в баке. Ясно, что точно так же, как механизмы, расположенные ниже по течению от наличия топлива в баке, позволяют автомобилю двигаться, так же должно быть что-то ниже по течению, чтобы увеличить синаптическую доступность моноаминов, чтобы полностью объяснить антидепрессивные механизмы.
Расширенные пояснения
Предложены расширенные пояснения.[1,2] Например, предполагается, что большая доступность нейротрансмиттеров в синапсе приводит к компенсаторному подавлению моноаминовых рецепторов. Подавление (облегчающих) постсинаптических рецепторов снижает активность постсинаптических нейронов. Снижение активности (тормозных) пресинаптических рецепторов увеличивает активность пресинаптических нейронов. Эти изменения развиваются от нескольких дней до недель, предположительно восстанавливают баланс активности нейронов и, предположительно, объясняют задержку начала действия антидепрессантов.Примеры таких расширенных объяснений:
ТЦА подавляют пресинаптические альфа-2-адренорецепторы и постсинаптические бета-адренорецепторы.
СИОЗС подавляют пресинаптические 5-НТ1а-серотонинергические рецепторы и постсинаптические 5-НТ2-серотонинергические рецепторы.
Такие расширенные объяснения все еще неполны. Все, что они добавляют к исходной модели, используя метафору автомобиля, — это вызов действия акселератора и тормоза.Нам все еще нужно знать, что происходит под капотом, то есть как работает двигатель. Вот тут-то и вступает в дело нейропластичность. . Другими словами, депрессия — это нарушение аппаратной части мозга, а не состояние химического дисбаланса.Антидепрессанты действуют, защищая и обращая по крайней мере некоторые из этих нейрогистологических изменений.[3] Эти изменения более подробно обсуждаются в последующих разделах.
ФУНДАМЕНТАЛЬНЫЕ ПРЕДПОЛОЖЕНИЯ ГИПОТЕЗЫ НЕЙРОПЛАСТИЧНОСТИ
1. Нейробиологию депрессии можно понять из последствий стресса
Давно известно, что стресс вызывает и поддерживает состояние депрессии. Обучение тому, как лучше справляться со стрессом, оказывает как терапевтическое, так и профилактическое антидепрессивное действие, о чем свидетельствуют исследования по когнитивно-поведенческой терапии (КПТ).Следовательно, то, что стресс делает с мозгом, может объяснить, почему развивается депрессия. Другими словами, нейрохимические, нейроэндокринные, нейрофизиологические и нейрогистологические эффекты стресса на мозг могут быть биологическими медиаторами депрессии у людей, предрасположенных к этому расстройству.
2. Модели стресса и депрессии на животных являются надежными моделями для понимания нейробиологии стресса, депрессии и действия антидепрессантов у человека
Имеется большое количество литературы о влиянии различных форм стресса на биологию и поведение животных и человека.Интересно, что изменения в регуляции эндокринной системы, изменения в обучении и памяти, изменения в гистологии некоторых отделов мозга, изменения в поведении и другие изменения обнаруживают сильное сходство между животными, находящимися в состоянии стресса, и людьми, находящимися в депрессии. Это, по-видимому, подтверждает использование животных моделей для объяснения механизмов стресса и антидепрессантов у людей. Таким образом, изменения мозга, вызванные стрессом, в моделях депрессии на животных могут достоверно отражать изменения мозга у людей с депрессией, а изменения, вызванные антидепрессантами, в моделях на животных могут достоверно отражать антидепрессивные механизмы у людей с депрессией.[4]
3. Нейрогистологические изменения, вызванные стрессом, имеют фундаментальное значение для депрессии
Среди различных изменений головного мозга, вызванных стрессом, нейрогистологические изменения могут быть наиболее фундаментальными в качестве объясняющей модели депрессии. Это связано с тем, что изменения в нейронной архитектуре и связи, вероятно, вызовут фундаментальные и стойкие нарушения в функционировании пораженных нейронных территорий. Таким образом, когнитивные, аффективные и поведенческие нарушения при депрессии могут быть результатом нейрогистологических изменений (выявленных на животных моделях стресса и депрессии), которые развиваются в областях мозга, которые выполняют эти функции.
4. Если антидепрессанты вызывают нейрогистологические изменения, противоположные тем, которые возникают в результате стресса, то такие изменения могут объяснить антидепрессивную активность
В моделях на животных стресс нарушает нейропластичность в определенных частях мозга и вызывает нейропластичность в других частях мозга; что это за изменения и как они могут нарушать когнитивные функции, аффекты и волевые реакции, обсуждаются в последующих разделах. В моделях на животных антидепрессанты обращали вспять многие поведенческие и другие эффекты стресса.Кроме того, в моделях на животных антидепрессанты обращают вспять некоторые нейрогистологические изменения, вызванные стрессом, с временным ходом, который параллелен временному ходу действия антидепрессантов у людей. Поэтому разумно предположить, что антидепрессанты обращают вспять депрессию у людей, обращая вспять нейрогистологические эффекты стресса.
Кортизол как злодей произведения
Легкий стресс обычно связан с успешной адаптацией к окружающей среде. На нейрогистологическом уровне легкий стресс также связан с благоприятными изменениями нейропластичности, которые описаны далее в этой статье.Таким образом, эти нейрогистологические изменения могут представлять собой биологические корреляты обучения, ответственного за адаптацию к стрессу.
Глюкокортикоидные рецепторы в большом количестве экспрессируются на нейронах гиппокампа и других участках головного мозга.[5] Таким образом, легкий стресс может действовать посредством физиологических сигналов глюкокортикоидов. Безусловно, на физиологическом уровне гормон стресса кортизол стимулирует нейроны гиппокампа и способствует обучению и памяти. Однако на патологических уровнях кортизол чрезмерно стимулирует нейроны гиппокампа и вызывает атрофию дендритов и потерю синапсов; в то время как эти структурные изменения, как правило, обратимы, в экстремальных ситуациях патологическая чрезмерная стимуляция кортизолом также может привести к апоптозу нейронов.[5,6] Агонизм глюкокортикоидов в медиальной префронтальной коре также влияет на обучение и память: консолидация памяти облегчается, но рабочая память ухудшается.[7]
Эти нейрогистологические эффекты гиперкортизолемии наблюдаются как у животных, так и у людей. На животных моделях нейрогистологические изменения развиваются в моделях стресса и депрессии, а также после хронического введения кортикостероидов нестрессовым животным. У человека когнитивные нарушения и уменьшение объема гиппокампа описаны при депрессии (при которой известно расстройство гиперкортизолемии), при синдроме Кушинга, а также после длительного приема глюкокортикоидов по медицинским показаниям.[8]
Интересно, что антагонист глюкокортикоидных рецепторов мифепристон был предложен для лечения психотической депрессии.[9] Он также может ослаблять когнитивные нарушения, связанные с депрессией.[10]
КЛЮЧЕВЫЕ СТРУКТУРЫ МОЗГА, ПОДВЕРГАЕМЫЕ СТРЕССУ
В моделях на животных существует по крайней мере три важных участка мозга, в которых стресс вызывает значительные нейрогистологические изменения. Это гиппокамп, префронтальная кора и миндалевидное тело.
1.Стресс и гиппокамп
На животных моделях вызванные стрессом гистологические изменения в гиппокампе включают следующее:
Потеря синапсов
Потеря GLIA
Обездание нейрогенеза
Возможно, апоптоз (в экстремальных условиях)
, следовательно, существует снижение объема гиппокампа; такое снижение наблюдалось посмертно в животных моделях стресса и депрессии [3,11], а также в исследованиях людей с депрессией с помощью магнитно-резонансной томографии (МРТ).[16]
Почему важны эти гистологические изменения? Вот простое объяснение. В человеческом мозгу около ста миллиардов нейронов. Каждый нейрон образует синапсы в среднем примерно с тысячей других нейронов, образуя около ста триллионов синапсов в мозгу.[17] Как социальная поддержка, социальная значимость и социальная эффективность человека зависят от его социальных сетей, так и функциональные возможности нейрона зависят от его синаптических сетей и связности.Когда дендриты и синапсы утрачены, эта связность уменьшается, и пораженные нейроны становятся менее эффективными в цепях, в которых они лежат. Потеря глии (которая также играет важную роль в нейротрансмиссии), снижение нейрогенеза и апоптоза усугубляют нарушение.
Гиппокамп имеет проекции на дорсолатеральную префронтальную кору, вентральную область покрышки и гипоталамус. Таким образом, вызванные стрессом гистологические изменения в гиппокампе могут нарушать не только функционирование гиппокампа, но и функционирование в этих нижестоящих областях.[3]
Гиппокамп является ключевой структурой, участвующей в процессах обучения и памяти, особенно эксплицитной (сознательно приобретаемой) памяти. Возможно, в результате нарушения гиппокампа у животных, находящихся в состоянии стресса, и у людей, страдающих депрессией, наблюдается ухудшение обучения и памяти. [8,18] Поскольку преодоление трудностей требует неповрежденных механизмов обучения, нарушение гиппокампа также может объяснить нарушение поведения при преодолении депрессии, наблюдаемое при депрессии.
Дорсолатеральная префронтальная кора координирует свои действия с гиппокампом в регуляции эксплицитной памяти.Он также поддерживает другие важные когнитивные функции, такие как внимание и концентрация. Эти когнитивные функции также нарушаются при депрессии, возможно, как следствие нарушения гиппокампа.[3]
Вентральная область покрышки проецируется на прилежащее ядро. Мезолимбическая схема регулирует реакцию на новизну и опыт вознаграждения. Стрессовые животные плохо реагируют на новизну. Параллелью у депрессивных людей может быть ангедония. Таким образом, нарушение гиппокампа может объяснить ангедонию как последующий эффект.[3]
Гипоталамус регулирует вегетативную нервную систему и нейроэндокринную систему. Нарушение входных сигналов гипоталамуса, возможно, связанное с нарушением нижестоящего гиппокампа, может объяснить некоторые нарушения нейроэндокринной и вегетативной нервной системы, характерные для депрессии.[3]
2. Стресс и префронтальная кора
На животных моделях вызванные стрессом гистологические изменения в префронтальной коре включают следующее: [3,11,13,15] , уменьшение размера и количества глии и уменьшение общей толщины коры.[11]
Префронтальная кора регулирует когнитивные функции, такие как внимание, концентрация, обучение и память. Префронтальная кора также регулирует высшие психические функции, такие как мотивация и суждение. Все эти функции нарушаются при депрессии, возможно, в результате нейрогистологических префронтальных изменений, связанных со стрессом и депрессией.
3. Стресс и миндалевидное тело
На животных моделях вызванные стрессом гистологические изменения в миндалевидном теле разительно отличаются от таковых в гиппокампе и префронтальной коре.Описанные изменения включают следующее: [3,15]
Результирующее увеличение объема миндалевидного тела было описано как у стрессированных животных, так и у депрессивных людей. Увеличение не просто структурное; он также функционален. Однако недавний метаанализ 13 МРТ-исследований миндалины при униполярной депрессии показал, что увеличение объема миндалины было функцией лечения антидепрессантами.[19] Возможным объяснением этого противоречивого результата является различное определение границ миндалины в разных исследованиях, поскольку миндалина не является четко очерченной структурой.[12]
Миндалевидное тело участвует в социальном и эмоциональном обучении и, особенно, в таких эмоциях, как тревога и страх.[12] Обучение страху усиливается у стрессированных животных, т. е. они демонстрируют преувеличенную, постоянную и более генерализованную реакцию страха на анксиогенные и вредные стимулы. Параллельно с этим депрессивные люди часто беспокоятся и боятся и проявляют усиленную реакцию тревоги на незначительные провокации.
Интересно, что исследования на животных показывают, что в то время как вызванные стрессом изменения в гиппокампе постепенно обращаются вспять после устранения стресса, вызванные стрессом изменения в миндалевидном теле не обращаются вспять в течение нескольких недель или дольше.[3] На самом деле, сохранение изменений миндалевидного тела может объяснить, почему депрессивные люди чрезмерно реагируют на стресс в зависимости от черт характера, почему текущая депрессия порождает будущую депрессию, почему жизненные события имеют кумулятивный эффект в предрасположенности к депрессии и даже почему физические и сексуальное насилие над детьми предрасполагает к депрессии во взрослой жизни.
Какие нейрогистологические изменения объясняют симптом депрессии?
Предшествующее обсуждение объясняет, почему тревога, страх, ангедония, нарушение мотивации, когнитивный дефицит, нейроэндокринные изменения и дисфункция вегетативной нервной системы могут возникать в контексте нейрогистологических изменений, вызванных стрессом.Он не объясняет, как и почему развивается депрессия как симптом.
Возможно, лучший способ решить эту проблему — принять во внимание, что ни один нейроанатомический очаг не объясняет депрессию, а лишь один очаг в мозгу объясняет счастье или другие сложные эмоции. Другими словами, депрессия, как и шизофрения, может быть суммой нарушений в функционировании нескольких отделов мозга. То есть функциональные изменения в разных отделах головного мозга порождают нейроэндокринный, нейровегетативный, нейрокогнитивный, нейроповеденческий и другие дефициты, которые в совокупности формируют депрессивный синдром.В то время как депрессия как специфический симптом субъективна и не может быть отражена в животных моделях, она может быть выведена из поведения животных так же, как тревога и страх могут быть выведены из поведения животных; а нейроэндокринные, нейровегетативные, нейрокогнитивные, нейроповеденческие и другие нарушения, связанные с депрессией, могут быть индивидуально изучены на животных моделях, а также области мозга, участвующие в генезисе этих нарушений.
Почему естественный отбор благоприятствовал аберрантной нейрогистологической реакции на стресс?
Тревога и страх в результате гиперактивности миндалевидного тела, по-видимому, программируют организм на избежание будущих воздействий потенциальных стрессоров.Это может иметь значение для выживания организма и, следовательно, вида, и поэтому будет способствовать эволюционному отбору. В этом отношении может быть полезно подавление гиппокампального и префронтального ответа, потому что для выживания организму необходимо быстро реагировать, чтобы избежать стресса, а не думать о стрессе, анализировать его и демонстрировать обоснованный ответ.
Однако у современных людей, хотя реакция миндалевидного тела на стресс все еще может иметь значение, аберрантная реакция гиппокампа и префронтальной области может оказаться мертвым грузом эволюции.Аргументы в пользу эволюционного значения депрессии для выживания были высказаны в другом месте.[20]
Что делают антидепрессанты: гайки и болты нейропластичности.
Клиницисты знакомы с концепцией нейропластичности в той мере, в какой она объясняет, как одна часть мозга может взять на себя некоторые или большинство функций другой, обычно соседней, части, если эта часть повреждена по таким причинам, как травма или ишемия. Нейропластичность теперь более широко понимается как способность элементов мозга демонстрировать структурные и функциональные изменения в ответ на внешние или внутренние возмущения.
На уровне нейронов нейропластичность как следствие хронического лечения антидепрессантами более конкретно относится к каскаду нейрофизиологических, нейрохимических и нейрогистологических изменений, которые приводят к усилению синапсов, росту и разветвлению дендритов и образованию новых синапсов. Важно отметить, что также были описаны нейрогенез, глиогенез, усиление поддержки эндотелия сосудов и ингибирование механизмов апоптоза, особенно в контексте ЭСТ.В то время как большая часть литературы посвящена развитию этих изменений в гиппокампе, аналогичные изменения были описаны и в префронтальной коре. Однако нейрогенез как ответ на лечение антидепрессантами не происходит за пределами гиппокампа.
Изменения нейропластичности, классически описанные в гиппокампе в контексте обучения и памяти, такие же, как и при длительном лечении антидепрессантами [3]. Значение этого наблюдения будет обсуждаться позже.Ранние и поздние изменения нейропластичности обобщены в следующих разделах. Читатели могут заметить, что эти изменения являются общими для широкого спектра антидепрессантов и методов лечения, что также будет подчеркнуто в следующем разделе.
1. Нейропластичность – Ранние изменения
Нейропластичность инициируется возбуждающим нейротрансмиттером глутаматом. Глутамат связывается с постсинаптическим рецептором NMDA, который блокирует канал ионов кальция. Поступление кальция в постсинаптический нейрон вызывает ряд изменений; они включают молекулы нейромедиаторов и нейромодуляторов, такие как арахидоновая кислота, простаноиды, эндогенные каннабиноиды, фактор активации тромбоцитов и другие.Активация этих липидных сигнальных путей усиливается реверберирующими цепями положительной обратной связи, которые включают ретроградную нейротрансмиссию; регулируется ферментами, такими как ЦОГ-2; и он подавляется эндогенными химическими веществами, такими как кинуреновая кислота.[21]
Активация NMDA также приводит к активации кальций-кальмодулин-зависимой киназы II (CaMKII), увеличению количества AMPA-рецепторов (как и NMDA-рецептор, AMPA-рецептор также является ионотропным глутаматергическим рецептором) и к активации молчащие синапсы.[3]
Непосредственным конечным результатом глутаматергического каскада является долговременная потенциация (ДП). LTP — это усиление синапсов, которое представляет собой возникновение обучения и памяти. Также описана длительная депрессия (ДД); это синаптическое ослабление, которое предположительно представляет собой ослабление воспоминаний или разучивание. Здесь важно понимать, что обучение и память не обязательно должны относиться к явной цели; он также может касаться нейросхем, участвующих в здоровых или нездоровых познаниях, состояниях настроения и поведении.Читатели могут обратиться к Митчеллу и Бейкеру [22] за информацией о роли глутамата в депрессии.
2. Нейропластичность – долгосрочные изменения
Нейропластичность – это больше, чем просто перепрограммирование синапсов в форме LTP и LTD. Это также связано с изменениями в нейронной проводке. Эти изменения опосредуются индукцией нейротрофических факторов, таких как мозговой нейротрофический фактор (BDNF), который действует на рецепторы тирозинкиназы (TrK) для активации внутриклеточных каскадов с участием цАМФ-зависимой протеинкиназы A (PKA), митоген-активируемой протеинкиназы (MAPK), CaMKII и другие.Эти химические вещества активируют факторы транскрипции, такие как белок, связывающий цАМФ-чувствительный элемент (CREB), который, в свою очередь, активирует синтез ферментов и белков, участвующих в структурном выражении нейропластичности. Примеры важных генов, которые индуцируются, включают BDNF, фактор роста эндотелия сосудов (VGEF) и другие. CREB и BDNF являются одними из наиболее важных участников исследований нейропластичности. [3,11]
Конечным результатом этих внутриклеточных сигнальных каскадов является стимуляция нейрогенеза в зубчатой извилине.Как в гиппокампе, так и в префронтальной коре также наблюдается увеличение количества глиальных клеток, увеличение богатства и сложности ветвления дендритов и увеличение образования новых синаптических связей. Динамика этих изменений нейропластичности параллельна динамике действия антидепрессантов, что позволяет сделать разумный вывод о том, что эти вызванные антидепрессантами нейрогистологические эффекты ответственны за начало клинического выздоровления.[3] Интересно, что доказательства структурных изменений мозга, вызванных антидепрессантами, могут быть обнаружены при МРТ-сканировании.Например, недавно Малыхин и соавт. [16] наблюдали увеличение объема гиппокампа у пациентов с большим депрессивным расстройством, получавших лекарства, по сравнению с пациентами, не получавшими медикаментозное лечение.
Почему индукция нейропластичности может предрасполагать к реакции на антидепрессанты? Разумной гипотезой является то, что он обращает вспять гистологические и, следовательно, когнитивные, поведенческие и другие нарушения, вызванные стрессом; эти нарушения были описаны в предыдущих разделах.
В то время как антидепрессанты устраняют структурные и функциональные последствия стресса в гиппокампе и префронтальной коре, они не обращают изменений, наблюдаемых в миндалевидном теле.[18] Таким образом, сохраняется уязвимость к стрессу, что обеспечивает биологическое объяснение наблюдаемой потребности в поддерживающей терапии антидепрессантами после успешного лечения депрессии лекарствами. Важно отметить, что лечение антидепрессантами предотвращает многие нейрогистологические изменения, вызванные стрессом [3,11], и это может объяснить, как и почему антидепрессанты защищают от вызванного стрессом рецидива депрессии.
Обучение, память и нейропластичность, вызванная антидепрессантами
Существует поразительное сходство в изменениях нейропластичности, вызванных антидепрессантами, и изменениях, лежащих в основе обучения и памяти.Поскольку эти нейрогистологические изменения противоположны изменениям, вызванным стрессом и депрессией, разумно предположить, что лечение антидепрессантами является терапевтическим за счет индукции механизмов обучения и памяти на нейрохимическом и нейрогистологическом уровнях.
Почему индукция механизмов обучения и памяти должна способствовать или способствовать выздоровлению от депрессии? Предположительно, нейропластичность может обеспечить необходимые условия для закрепления более здоровых когнитивных функций, аффективных реакций и поведенческих выражений посредством изучения более здоровых когнитивных стратегий и методов преодоления.Такому адаптивному обучению может способствовать психотерапия, или оно может возникнуть просто благодаря воздействию здоровой и благоприятной среды.
Нейропластичность как общий механизм действия антидепрессантов
Антидепрессанты — не единственные препараты, вызывающие нейропластичность. Существует обширная литература, которая показывает, что ЭСТ вызывает аналогичные изменения нейропластичности; [23–28] фактически ЭСТ может быть наиболее мощным индуктором нейропластичности в головном мозге. Физические упражнения, которые, как сообщается, обладают антидепрессивным эффектом, также вызывают изменения нейропластичности.[29–30] Предположительно, в той степени, в которой КПТ требует обучения и адаптации, можно сказать, что нейропластичность также лежит в основе КПТ. Наконец, данные также свидетельствуют о нейропластичности при применении других препаратов, оказывающих антидепрессивное действие, от кветиапина [31, 32] до tDCS [33]. Таким образом, нейропластичность представляется последним общим путем или великим объединяющим механизмом действия различных антидепрессантов.
Другие примечания
Нейрогистологические изменения при стрессе и ответе на антидепрессанты зависят от локализации.Например, как уже было сказано, стресс приводит к противоположным структурным и функциональным изменениям в миндалевидном теле по сравнению с гиппокампом и префронтальной корой. Затем, в то время как повышенная экспрессия CREB и BDNF в гиппокампе обращает вспять вызванные стрессом изменения в этой структуре, повышенная экспрессия CREB и BDNF в прилежащем ядре увеличивает выученную беспомощность и социальное поражение в моделях депрессии на животных [3].
Будущие методы лечения депрессии могут непосредственно пытаться индуцировать нейропластические изменения.Например, внутрижелудочковое введение BDNF оказывает антидепрессивное действие на животных моделях. Индукция каскада цАМФ-CREB под действием ролипрама обращает модели депрессии на животных, но, к сожалению, не дает впечатляющих результатов в клинических условиях [3].
ЗАКЛЮЧИТЕЛЬНЫЕ НАБЛЮДЕНИЯ И ПРЕДПОЛОЖЕНИЯ
Согласуется ли гипотеза о нейропластичности действия антидепрессантов с результатами, полученными в клинических или исследовательских условиях? Некоторые наблюдения кратко рассмотрены и даны спекулятивные примирительные ответы.Они могут стать основой для будущих исследований в этой области.
Наблюдения : Эпизоды депрессии могут возникать при кажущемся отсутствии стресса. Стресс не обязательно вызывает депрессивное состояние. Некоторые люди, кажется, процветают на стрессе. Стресс может привести к различным формам депрессии: горю, дистимии или большим депрессивным эпизодам. Стресс может привести к другим расстройствам, кроме депрессии.
Примирение : Нет такой вещи, как отсутствие стресса.Фактически, сами стрессы и напряжения повседневной жизни могут быть нейротоксичными для уязвимых людей, при этом уязвимость определяется генетическими и эпигенетическими механизмами. Кроме того, как показали исследования жизненных событий, эпизоды болезни могут быть спровоцированы даже положительными или желательными жизненными событиями. Генетические механизмы могут объяснить, почему стресс не оказывает вредного воздействия на одних людей, но вызывает депрессию у других. Генетические механизмы могут также объяснить, почему разные люди испытывают разные формы депрессии и почему одни люди страдают депрессией, тогда как у других развивается шизофрения или другие психические расстройства в ответ на стресс.Следует отметить, что нельзя ожидать, что нейропластичность с помощью антидепрессантов облегчит первичные симптомы шизофрении, потому что шизофрения гистологически сильно отличается от депрессии.
Наблюдение : Каждый эпизод депрессии увеличивает вероятность того, что последующие эпизоды будут более вероятными, более частыми, более тяжелыми, продолжительными и труднее поддающимися лечению.
Предположение : Нейропластичность, вызванная антидепрессантами, не может полностью устранить нейротоксические эффекты стресса.В результате долгосрочные структурные изменения в гиппокампе и префронтальной коре могут хронически ухудшать совладающее поведение. Кроме того, переобучение миндалевидного тела может предотвратить угасание нездоровых эмоциональных реакций на стрессовые ситуации, что может иметь дальнейшее негативное влияние на течение болезни. Ситуация может быть аналогична слабому колену; однажды поврежденный, он слаб на всю жизнь.
Наблюдение : Польза от комбинации антидепрессант-КПТ, как правило, больше, чем польза от лечения только антидепрессантами.
Предположение : КПТ может помочь запечатлеть здоровые познания и поведение на изменениях нейропластичности, вызванных лекарствами.
Наблюдение : Некоторые пациенты не реагируют на антидепрессанты.
Предположение : После начала терапии антидепрессантами может наступить критический период для закрепления здоровых мыслей и поведения. Если неблагоприятные условия окружающей среды не позволяют установить здоровую нервную систему в этот критический период, может возникнуть рефрактерность к антидепрессантам.Продолжение стресса может противодействовать действию антидепрессантов на нейрогистологическом уровне; это также может объяснить резистентность к антидепрессантам. Наконец, генетические и эпигенетические механизмы также могут играть роль в резистентности к лечению.
Наблюдение : Некоторые формы депрессии, такие как дистимия и реакция горя, менее чувствительны к антидепрессантам, чем большие депрессивные эпизоды.
Предположение : Дистимия характеризуется глубоко укоренившейся неспособностью адаптироваться к стрессам и напряжениям повседневной жизни.Простой индукции нейропластичности может быть недостаточно для лечения дистимии; может быть необходимо запечатлеть улучшенные механизмы выживания (с помощью соответствующей психотерапии) на вновь образованных нейроцепях. Что касается реакции горя, у пострадавших людей может не быть врожденной генетической уязвимости, которая требовала бы приема антидепрессантов для адаптации к стрессу. Здесь можно отметить, что все люди обладают врожденной нейропластической способностью, и некоторым людям, страдающим депрессией, может быть достаточно просто научиться адаптивному поведению, чтобы оправиться от депрессии; антидепрессанты не всегда могут быть необходимы.
Наблюдение : Антидепрессанты часто не лучше плацебо в клинических испытаниях, проведенных на детях и подростках с депрессией.
Предположение : Детям свойственна пластичность мозга, и они могут нуждаться в антидепрессантах не так сильно, как взрослые. С другой стороны, детям может не хватить зрелости, чтобы использовать нейропластические изменения для эмоционально и психосоциально адаптивного ответа.
Наблюдение : Различные антидепрессанты связаны с разной степенью эффективности у разных пациентов.
Предположение : Различные антидепрессанты по-разному влияют на пути, опосредующие реакцию нейропластичности, и разные пациенты имеют разные генетические и эпигенетические причины депрессии. Эти различия могут объяснить различия в эффективности антидепрессантов у разных пациентов.
Наблюдение : Антидепрессанты эффективны при расстройствах, отличных от депрессии.
Примирение : Эффективность антидепрессантов при различных психических расстройствах может потребовать индукции нейропластичности только в том случае, если эти расстройства также вызваны ошибочным обучением и могут быть исправлены путем разучения и повторного обучения.Антидепрессанты также могут действовать через механизмы, не связанные с нейропластичностью. Например, местного антихолинергического действия ТЦА может быть достаточно для лечения кислотно-пептической болезни или синдрома раздраженного кишечника.
РЕЗЮМЕ
Стресс и депрессия приводят к потере дендритных шипов, дендритной атрофии и потере синапсов в гиппокампе и префронтальной коре; глиальные клетки уменьшаются в количестве и размере. Как следствие, нарушается функционирование гиппокампа и префронтальной коры, а также функционирование нижестоящих структур, таких как прилежащее ядро и гипоталамус.Напротив, стресс также связан с усилением разветвления дендритов и образованием новых синапсов в миндалевидном теле; функционирование этой структуры может усиливаться. Нейрогистологические изменения в этих участках мозга могут объяснить, почему депрессию характеризуют ангедония, отсутствие мотивации, тревога, страх, когнитивный дефицит, нейроэндокринные изменения и изменения вегетативной нервной системы.
Антидепрессанты связаны с индукцией нейропластичности в таких структурах, как гиппокамп и префронтальная кора: происходит стимуляция нейрогенеза, глиогенеза, разветвления дендритов и образования новых синапсов.Эти изменения могут лежать в основе механизмов реакции на антидепрессанты, потому что их развитие во времени совпадает с течением действия антидепрессантов, потому что они обращают вспять нейрогистологические эффекты стресса и потому что они могут способствовать повторному обучению более здоровым познаниям, более здоровым эмоциональным реакциям и более здоровым поведенческим выражениям.
Гипотеза нейропластичности действия антидепрессантов никоим образом не является достоверной или полной. Например, это не объясняет, почему кетамин [34–35], скополамин [36–37] и ЭСТ [38] могут оказывать сильное антидепрессивное действие.Однако она гораздо более правдоподобна и полна, чем любая из более ранних гипотез действия антидепрессантов.
Рекомендуемая литература
Эта статья, как видно из названия, представляет собой учебник по стрессу, депрессии, лечению антидепрессантами и нейропластичности. За последнее десятилетие было опубликовано несколько прекрасных технических обзоров по этому вопросу, и читатель может обратиться к ним за подробностями по этому вопросу.[3,11,39]
Как на самом деле действуют антидепрессанты? | Неврология
Антидепрессанты; лечение депрессии или генерализованной тревожности.Это невероятно, если подумать, тот факт, что у вас может быть изнурительное расстройство настроения, принять несколько таблеток и почувствовать себя лучше. Невероятно, что медицинская наука продвинулась настолько далеко, что теперь мы полностью понимаем, как человеческий мозг создает настроение и другие эмоции, поэтому можем манипулировать ими с помощью дизайнерских наркотиков.
Верно, это невероятно. Потому что это не так. Тот факт, что антидепрессанты сейчас так распространены, вызывает смешанные чувства. С одной стороны, все, что помогает уменьшить стигматизацию и позволяет страдающим понять, что они не одиноки, может быть только полезным.Депрессия невероятно распространена, поэтому это осознание может буквально спасти множество жизней.
С другой стороны, знакомство не означает автоматически понимание. В наши дни почти у каждого есть смартфон, но сколько людей, если их подтолкнуть, смогут построить сенсорный экран? Держу пари, не так много. Так же и с депрессией и антидепрессантами. Несмотря на все освещение и мнения о них, детали того, как они работают, остаются несколько туманными и неуловимыми.
На самом деле, в случае с антидепрессантами это скорее вопрос почему они действуют, а не как.Большинство антидепрессантов, от первых ингибиторов трициклических соединений и монаминоксидазы до вездесущих современных селективных ингибиторов обратного захвата серотонина (СИОЗС), действуют путем повышения уровня специфических нейротрансмиттеров в головном мозге, как правило, путем предотвращения их расщепления и реабсорбции в нейроны. , что означает, что они дольше задерживаются в синапсах, вызывая большую активность, тем самым «компенсируя» снижение общего уровня. Антидепрессанты заставляют остальные нейротрансмиттеры работать в два раза активнее, поэтому общая активность становится, так сказать, более «нормальной».
Но то, что это делают антидепрессанты, на самом деле не объясняет, как они в конечном итоге облегчают депрессию. В некотором смысле нейротрансмиттеры для мозга то же, что алфавит для языка; основные элементы гораздо более богатых и сложных конструкций. Таким образом, повышение уровня нейротрансмиттеров по всему мозгу на самом деле не говорит нам ничего конкретного. Это как реставрировать классическую картину, а вам говорят, что ей «нужно больше зелени»; это может быть правдой, но где? Сколько? Какой оттенок? Это слишком неконкретно, чтобы сообщить нам что-то полезное.
Депрессия настолько плохо изучена, что большинство людей иллюстрируют ее, когда кто-то держит голову руками, как показывает просмотр любого архива изображений. Это не делает ваш мозг тяжелее или что-то в этом роде. Фотография: Nastia11/Getty Images/iStockphotoПо правде говоря, антидепрессанты были открыты в значительной степени случайно; Швейцарские ученые, искавшие средства для лечения шизофрении, в 1950-х годах поняли, что определенное экспериментальное вещество вызывало у их испытуемых эйфорию. И вот, антидепрессанты родились.Здесь нет ничего необычного, удача и интуиция стоят за открытиями многих лекарств. Но это привело к моноаминовой теории депрессии, которая утверждает, что, поскольку большинство антидепрессантов повышают уровень нейротрансмиттеров класса моноаминов, депрессия вызывается истощением моноаминов в мозге.
За исключением моноаминовой гипотезы, которая все чаще считается недостаточной. Конечно, это часть происходящего, но не вся история. Во-первых, антидепрессанты практически мгновенно повышают активность нейротрансмиттеров, но терапевтический эффект обычно проявляется через несколько недель.Почему? Это как заправить пустой бак вашего автомобиля бензином, и только через месяц он снова заведется; это означает, что отсутствие топлива могло быть проблемой , но это явно не проблема , а только проблема .
Возможны и другие объяснения. Было показано, что нейропластичность, способность образовывать новые связи между нейронами, нарушена у пациентов с депрессией. Теория состоит в том, что это мешает мозгу «правильно» реагировать на аверсивные стимулы и стресс. Происходит что-то плохое, и нарушение пластичности означает, что мозг более «фиксирован» как есть, как торт, оставленный слишком долго, что мешает двигаться дальше, адаптироваться или избегать негативного мышления и, следовательно, депрессии.Антидепрессанты также постепенно повышают нейропластичность, поэтому, возможно, именно поэтому они работают так, как они работают, спустя много времени после повышения уровня медиаторов. Это не то же самое, что заливать топливо в машину, это больше похоже на удобрение растения; нужно время, чтобы полезные элементы впитались в систему.
Есть и другие возможности. Воспаление, вызывающее чрезмерную нагрузку на мозг, — это одно, гиперактивная передняя поясная кора — другое. По сути, это сложно, и мы пока ничего не можем подтвердить.
По сути, депрессия — это не перелом ноги или простуда. Мы не можем посмотреть на это, сказать «вот что не так, вот здесь» и приступить к исправлению. Психиатрические проблемы никогда не бывают такими простыми (и это без многих совпадений с более физическими недугами). Часть проблемы заключается в том, что «депрессия» — это скорее универсальный термин для чего-то, что проявляется у многих по-разному. Это расстройство настроения, но то, как оно влияет на настроение, может существенно различаться. Одни кончают непоколебимым черным отчаянием, другие не испытывают никакого настроения, о котором можно было бы говорить, просто чувствуя себя плоскими, пустыми и бесчувственными.Некоторые (в основном мужчины) становятся постоянно злыми и беспокойными.
Это одна из причин того, почему так трудно установить основную причину. Человеческий мозг — самая сложная вещь, и даже незначительный недостаток или сбой в работе могут проявляться по-разному и неожиданно. И нет причин предполагать, что каждый случай депрессии имеет одну и ту же причину. Поэтому неудивительно, что антидепрессанты не работают или даже ухудшают состояние многих пациентов. Есть и другие подходы, но и они могут вам не подойти.Если причины и последствия депрессии значительно различаются от человека к человеку, то же самое будет и с эффективностью лечения.
Большинство терапевтических вмешательств также не используют кожаные кушетки. Может, это голливудское? Фотография: Getty Images/StockbyteАнтидепрессанты также имеют много потенциальных побочных эффектов, которые сами по себе варьируются от человека к человеку. И хотя терапевтические эффекты (которые, по мнению многих, сами по себе преувеличены или основаны на сомнительных доказательствах) проявляются через несколько недель, это не относится к неприятным побочным эффектам, как недавно обнаружила Дебора Орр.
Учитывая все это, вы можете удивиться, как антидепрессанты вообще стали настолько распространены? Ну, это может сводиться к тому, что, несмотря на все недостатки и проблемы, которые у них могут быть, они лучше, чем ничего, особенно когда альтернативой является невылеченная депрессия. Некоторые придерживаются более циничной точки зрения, утверждая, что фармацевтические компании получают прибыль, проталкивая прибыльные таблетки людям, которые на самом деле в них не нуждаются.
Или, по крайней мере, в Великобритании, это может быть что-то сделать в отсутствие времени и ресурсов.В идеальном мире люди с депрессией имели бы легкий доступ к когнитивно-поведенческой терапии или другим вмешательствам; учитывая, что все пациенты разные, и то, что работает для них, часто является вопросом проб и ошибок. Но во все более недофинансируемой и перегруженной Национальной службе здравоохранения это становится все труднее, даже невозможно предложить. Многие межличностные методы лечения депрессии и других расстройств включают многочасовые контакты с высококвалифицированными (т.е. дорогостоящими) специалистами. Учитывая выбор между этим или подарить кому-то коробку таблеток и сказать «увидимся через месяц», последнее, вероятно, будет предпочтительным вариантом большую часть времени.
В целом, широкое использование антидепрессантов, вероятно, связано с многочисленными сложными причинами, а эффекты непредсказуемы и сбивают с толку. Очень похоже на саму депрессию, что кажется уместным.
Эта статья адаптирована из книги Дина Бернетта «Мозг идиота», выпущенной в мягкой обложке в США 11 июля.
ПОПУЛЯРНЫЕ АНТИДЕПРЕССАНТЫ СТИМУЛИРУЮТ РОСТ МОЗГА, ОТЧЕТ УЧЕНЫХ HOPKINS
Johns Hopkins Medicine
Office of Corporate Communications
КОНТАКТЫ: Eric Vohr
ТЕЛЕФОН: 410-955-8665
E-21217edu
19 декабря 2005 г.
Полезные эффекты широко используемого класса антидепрессантов могут быть результатом усиленного роста нервных волокон в ключевых частях мозга, согласно исследованию Джона Хопкинса, опубликованному в январском выпуске журнала за 2006 г. Журнал нейрохимии.
Исследование на крысах под руководством Василиса Э. Колиатсоса, доктора медицинских наук, невропатолога из Медицинской школы Университета Джона Хопкинса, показало, что селективные ингибиторы обратного захвата серотонина (СИОЗС) увеличивают плотность аксонов, несущих нервные импульсы, в лобных и теменные доли неокортекса и часть лимбического мозга, которые контролируют обоняние, эмоции, мотивацию и органы, которые работают рефлекторно, такие как сердце, кишечник и желудок.«Похоже, что антидепрессанты СИОЗС перепрограммируют области мозга, которые важны для мышления и чувств, а также для работы вегетативной нервной системы», — сказал Колиатсос.
Аксоны представляют собой длинные нитевидные отростки нейронов, которые вместе с миелином являются основными составляющими нервов. Аксоны проводят химически управляемые нервные импульсы от тела клетки к узкой щели, известной как синапс. Среди вовлеченных химических веществ такие моноамины, как норэпинефрин и серотонин, которые в синапсе передаются другому нейрону.
Долгое время считалось, что антидепрессанты, такие как прозак, золофт и паксил, оказывают свои клинические эффекты за счет увеличения синаптических концентраций серотонина и норадреналина, усиливая или стимулируя их передачу.
«Но наши выводы о том, что модуляторы обратного захвата серотонина увеличивают плотность нервных синапсов, особенно в передней части мозга, могут предложить лучшее объяснение того, почему антидепрессанты эффективны и почему им требуется время, чтобы подействовать», — говорит Колиацос. .
Например, антидепрессанты повышают уровень синаптических моноаминов в течение нескольких часов, а регулирующее воздействие на рецепторы завершается в течение нескольких дней, однако клинически значимые результаты от антидепрессантов обычно требуют двух-четырехнедельной задержки.
«Это несоответствие между простыми фармакологическими эффектами и клиническим опытом может быть связано со временем, которое требуется серотониновым аксонам для роста», — сказал Колиатсос.
«Для пациента эта гипотеза дает более ощутимые доказательства реального воздействия на мозг», — добавил он.
В исследовании Хопкинса Колиацос и его команда давали либо селективный ингибитор обратного захвата серотонина флуоксетин (прозак), либо селективный усилитель обратного захвата серотонина тианептин (препарат, одобренный только для использования человеком во Франции), либо селективный ингибитор обратного захвата норадреналина дезипрамин, т.е. -названный трициклическим антидепрессантом, группам крыс в течение четырех недель изучали анатомические закономерности стимуляции серотонином в различных частях мозга. Результаты показали, что флуоксетин и тианептин, но не дезипрамин, увеличивали плотность серотониновых аксонов в лобной и теменной неокортексе, а также в некоторых лимбических корковых и подкорковых областях.
Одним из возможных объяснений этого действия является фактор роста головного мозга (BDNF). По словам Колиатсоса, BDNF регулируется уровнем серотонина и, как известно, является главным кандидатом на роль серотонинового аксона.
В целом взаимосвязь между концентрацией серотонина в мозге и экспрессией BDNF очень сложна, но предыдущие исследования показали, что как более высокие (например, вызванные ингибиторами обратного захвата серотонина), так и более низкие (например, вызванные тианептином) концентрации свободного серотонина могут вызывать Экспрессия BDNF в таких областях мозга, как лобная и теменная кора.
Исследователи предупреждают, что, поскольку предыдущее исследование не смогло показать корреляцию между лечением тианептином и уровнями BDNF, необходимы дальнейшие исследования сложной регуляции BDNF антидепрессантами.
Финансирование этого исследования поступило от Национального института психического здоровья.
Исследование в настоящее время доступно в журнале веб-сайта неврохимии:
http://www.blackwellpublishing.com/journal.asp?ref=0022-3042
—JHM—
* Новый RSS Feed можно получить в Johns Hopkins Medicine:
http://www.hopkinsmedicine.org/mediaII/RSSinstructions.html
Антидепрессанты – или нет | Science
На днях я разговаривал с коллегой, который на протяжении многих лет много работал над заболеваниями центральной нервной системы, и это напомнило мне о том, что я сказал много лет назад в этом блоге (и это был первый раз, когда меня цитировали в Wall Street Journal ). Было ли это мнение об акциях какой-то компании или о климате биофармацевтики? Нет: это было заявление о том, что «мы ничего не знаем о том, как действуют лекарства на центральную нервную систему».
Я по-прежнему согласен с этим, хотя это правда, что есть некоторые наркотики (и некоторые категории наркотиков), которые мы понимаем немного лучше, чем другие. Но моя точка зрения была направлена на то, что люди вне поля могут представить, что мы знаем о (например) лекарствах от депрессии. Подумайте об этом — это очень серьезная проблема для тех, кто страдает от нее, таких людей много, и есть довольно много лекарств от этого состояния, некоторые из них достаточно известны и узнаваемы, чтобы упоминаться в названиях книг.Неспециалиста можно легко простить за то, что он думает, что мы понимаем, как работают антидепрессанты. Но мы этого не делаем.
Это достаточно известная область, так что даже заявленный механизм действия многих лекарств в ней известен гораздо большему количеству людей, чем механизмы большинства лекарств. Спросите десять тысяч случайных людей, как действует ибупрофен, и я не думаю, что вы далеко продвинетесь. Но спросите их, как действует прозак, и я держу пари, что кто-нибудь выскакивает и говорит, что он повышает уровень серотонина. Знаете, серотонин — это то, что заставляет вас чувствовать себя лучше.
Ну, на самом деле это то, что прозак и другие препараты СИОЗС будут делать до определенного момента — они определенно повлияют на серотонинергическую сигнализацию в вашем мозгу. Тем не менее, кроме этого, я не хотел бы вкладывать деньги, кроме как против утверждения, что уровень серотонина = счастье. Неофициальный девиз всех исследований ЦНС: «На самом деле это намного сложнее, чем это…», и в этом случае тоже. Долгие поиски связей между вариантами серотонинергических генов и депрессией, например, были крайне разочаровывающими, и если бы история была простой, вы бы надеялись найти там что-нибудь.
Вот обзор области с точки зрения открытия лекарств, и ссылки в нем проясняют несколько моментов. Частота ответа на препараты СИОЗС (и все антидепрессанты) вариабельна и непредсказуема. У большого числа пациентов наблюдается в лучшем случае частичный ответ, и многие из них прекращают курс лечения. Эффективность новых агентов не лучше, чем у старых, хотя (поскольку у них меньше побочных эффектов) люди готовы использовать их дольше. В некоторых случаях это хорошо, потому что начало положительных эффектов может проявиться через некоторое время.А иногда бывают положительные эффекты на какое-то время, которые потом потихоньку исчезают.
Если бы мы знали больше о том, что происходит в мозгу во время депрессии, мы могли бы добиться большего. Но это возвращает нас к первому абзацу: что происходит на нейронном уровне, когда у человека начинается большая депрессия? Несмотря на большую работу по этому вопросу, нам все еще приходится поднимать руки вверх. Количество действующих факторов, тонкость их взаимодействия и несовершенство наших инструментов, с помощью которых мы их изучаем, удерживают нас в неведении относительно реальной истории.
Позвольте мне сказать здесь, что я не нигилист: я верю, что есть реальная история, и что мы ее когда-нибудь узнаем. Это может оказаться чем-то вроде «. Если у вас больше X% нейронов типа 473 в подобласти 79Q переднего мозга, вы рискуете соскользнуть в альтернативные паттерны возбуждения нейронной сети с № 2907 по 3043, если баланс длинных -аксонная активность снижается, усиливая петлю обратной связи синтеза белка, которая производит смешанные GPCR фенотипы #973-1028, распространяясь дистально через сети аксонов с 384-й по 1028-ю.. . »
Но мы не можем ничего сказать об этом уровне детализации в живом человеческом мозгу, ни в пространственном, ни во временном разрешении, необходимом для того, чтобы начать отслеживать подобные закономерности. Мы добились огромного прогресса, но все еще Например, пытаться сопоставить каждую снежинку со своими соседями в огромной дрейфующей куче.На самом деле, это было бы проще: все снежинки примерно одинакового размера по сравнению с различиями между нейронами, и все они сделаны из воды, в отличие от десятков тысяч белков, разбросанных по ним.И, конечно же, они не все постоянно разговаривают друг с другом, по крайней мере, я не знаю.
Наибольший прогресс был достигнут в отношении функций мозга в его более механических аспектах (таких как зрительная кора). Это достаточно сложно, но когда вы начинаете двигаться к высшим функциям мозга, таким как познание и эмоции, вы наверняка вырвались из непроницаемых земных оков настолько, насколько это возможно в механистических объяснениях. Я благоговею перед мозгом, и да, у меня действительно мурашки по коже, что феномен «пребывания в благоговении» также зависит от моего мозга.Сознание — одна из сложных проблем.
Но нам не нужно понимать сознание (к счастью), чтобы иметь лучшие антидепрессанты, чем сейчас. На самом деле, я думаю, что полезные агенты скорее появятся эмпирическим путем. Наш прогресс не будет красивым, и он не будет быстрым и уверенным, но по мере того, как мы будем исследовать больше комбинаций нейроактивных агентов и искать больше эффектов существующих соединений (всех видов), я на самом деле думаю, что шансы хорошо, что мы можем придумать что-то лучше, чем есть сейчас.По общему признанию, это отчасти потому, что то, что мы имеем сейчас, не так уж хорошо. Пройдет немало времени, прежде чем мы сможем гордиться нашим детальным клеточным и молекулярным пониманием депрессии, но тем временем я думаю, что мы все еще можем помочь людям, страдающим от нее, и если мы не можем гордиться этим, как бы мы ни наткнулись на лечение, чем мы можем гордиться?





 Без письменного согласия отвезти человека в больницу можно только на 72 часа, затем собирается врачебная комиссия и ее решение уходит в суд.
Без письменного согласия отвезти человека в больницу можно только на 72 часа, затем собирается врачебная комиссия и ее решение уходит в суд.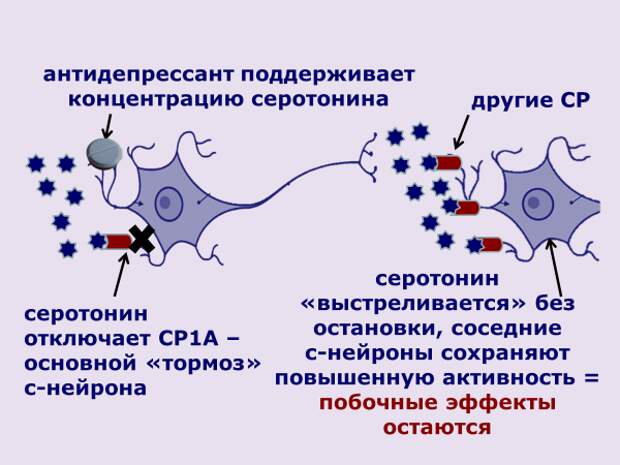 Сейчас их используют достаточно редко из-за выраженных побочных эффектов и высокой токсичности.
Сейчас их используют достаточно редко из-за выраженных побочных эффектов и высокой токсичности.
 Это не означает слабость или потерю контроля.
Это не означает слабость или потерю контроля. Продукты животного происхождения: сайда, лосось, зубатка, омары, семга, субпродукты, краб, золотистый окунь, устрицы, моллюски, улитки, тунец, макрель, сельдь, радужная форель, осьминог, козлятина, печень, птичьи потроха, рыбная икра, мидии, эму. (Источник)
Продукты животного происхождения: сайда, лосось, зубатка, омары, семга, субпродукты, краб, золотистый окунь, устрицы, моллюски, улитки, тунец, макрель, сельдь, радужная форель, осьминог, козлятина, печень, птичьи потроха, рыбная икра, мидии, эму. (Источник)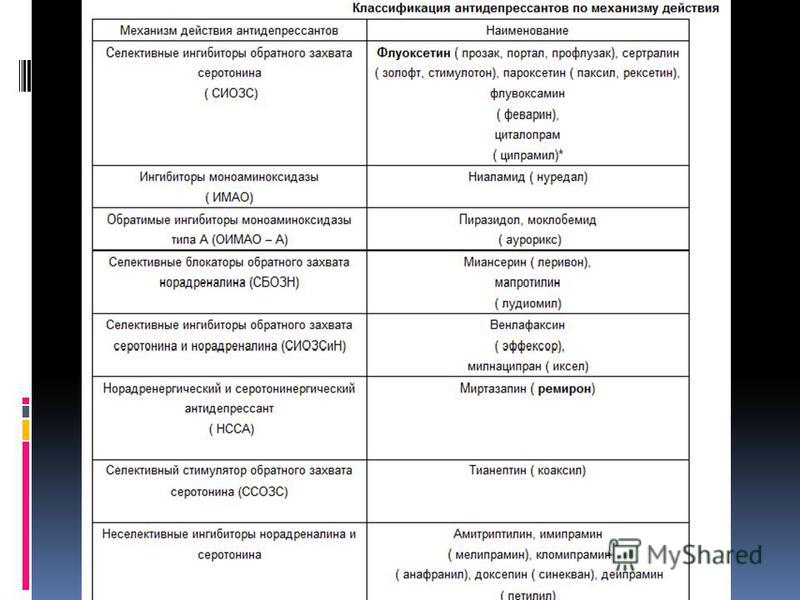

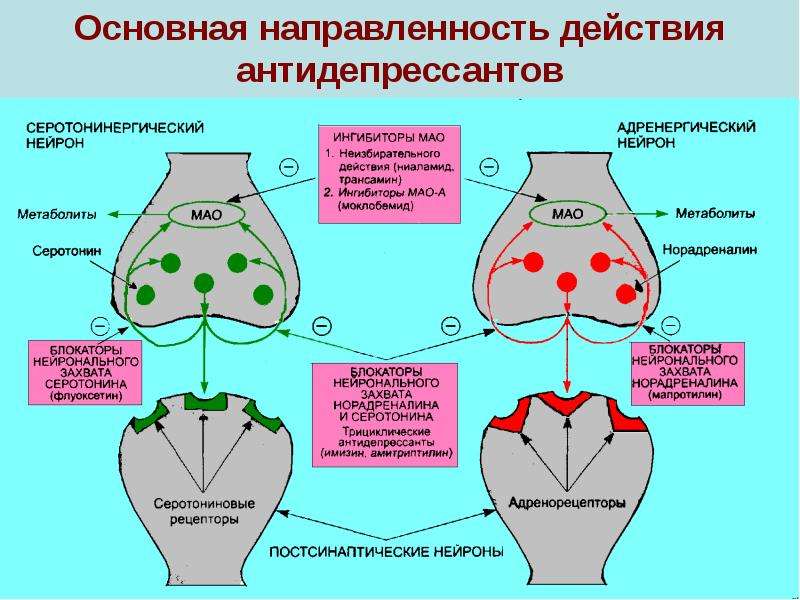
 Этот эффект, по-видимому, корректирует или компенсирует нейрофизиологический дефицит, лежащий в основе депрессии. Примерами препаратов, ингибирующих обратный захват моноаминов, являются трициклические антидепрессанты (ТЦА), селективные ингибиторы обратного захвата серотонина (СИОЗС), ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) и другие.
Этот эффект, по-видимому, корректирует или компенсирует нейрофизиологический дефицит, лежащий в основе депрессии. Примерами препаратов, ингибирующих обратный захват моноаминов, являются трициклические антидепрессанты (ТЦА), селективные ингибиторы обратного захвата серотонина (СИОЗС), ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) и другие. За исключением агомелатина, в центре внимания объяснительных механизмов находится большой триумвират: серотонин, норадреналин и дофамин.
За исключением агомелатина, в центре внимания объяснительных механизмов находится большой триумвират: серотонин, норадреналин и дофамин.