Прививки манту состав: Правда ли, что в состав пробы Манту входят ядовитые вещества? | ЗДОРОВЬЕ: Медицина | ЗДОРОВЬЕ
Порядок проведения вакцинации детей. Право на отказ от туберкулинодиагностики. Разъясняет аппарат прокуратуры Свердловской области
19.03.2018г.
Старший прокурор отдела по надзору за исполнением законов о несовершеннолетних прокуратуры области Н.А. Новокрещенова
В соответствии с Конституцией Российской Федерации в ст.ст. 41, 42 каждый имеет право на охрану здоровья, на благоприятную окружающую среду. При этом согласно ч.3 ст. 17 Конституции РФ осуществление прав и свобод человека и гражданина не должно нарушать права и свободы других лиц.
Санитарно-эпидемиологическое благополучие населения является одним из основных условий реализации конституционных прав граждан на охрану здоровья и благоприятную окружающую среду.
Федеральными законами от 17.09.1998 № 157-ФЗ «Об иммунопрофилактике инфекционных болезней», от 18.06.2001 № 77-ФЗ «О предупреждении распространения туберкулеза в Российской Федерации» установлены правовые основы государственной политики в области иммунопрофилактики инфекционных болезней, предупреждения распространения туберкулеза, осуществляемые в целях охраны здоровья и обеспечения санитарно-эпидемиологического благополучия населения.
В связи с этим статей 9 закона предусмотрен национальный календарь профилактических прививок, предусматривающий проведение детям профилактических прививок против 13 инфекционных заболеваний, в том числе туберкулеза, сроки их проведения.
Прививки проводятся в медицинских организациях, имеющих лицензию на право осуществления медицинской деятельности, в том числе по вакцинации, специально обученными медицинскими работниками.
В соответствии со статьями 5, 11 Федерального закона «Об иммунопрофилактике инфекционных болезней» профилактические прививки проводятся с письменного информированного добровольного согласия одного из родителей либо иного законного представителя несовершеннолетнего в возрасте до 15 лет на медицинское вмешательство гражданина, при отсутствии медицинских противопоказаний.
При осуществлении иммунопрофилактики родители имеют право на получение от медиков полной и объективной информации о необходимости прививок, возможных поствакцинальных осложнениях, на отказ от профилактических прививок, последствиях отказа.
В силу п. 2 ст. 5 указанного закона отсутствие профилактических прививок влечет временный отказ в приеме граждан в образовательные организации и оздоровительные учреждения в случае возникновения массовых инфекционных заболеваний или при угрозе возникновения эпидемий.
Федеральным законом от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» полномочия по введению (отмене) ограничительных мероприятий (карантина) возложены на главных государственных санитарных врачей и их заместителей.
В других случаях отсутствие профилактических прививок не влечет ограничение прав детей на получение образования и посещение образовательного учреждения.
По информации Минздрава России туберкулинодиагностика (постановка реакции Манту) не является профилактической прививкой, а является диагностическим тестом для определения специфической сенсибилизации организма к микобактериям туберкулеза. Диагностика проводится в целях раннего выявления туберкулеза у детей и подростков и позволяет своевременно оказать им противотуберкулезную помощь, обеспечить охрану здоровья граждан и санитарно-эпидемиологическое благополучие населения.
В соответствии со ст. 7 Федерального закона от 18.06.2001 № 77-ФЗ «О предупреждении распространения туберкулеза в Российской Федерации» противотуберкулезная помощь несовершеннолетним в возрасте до 15 лет оказывается с согласия родителя или иного законного представителя.
Статьей ст. 39 Федерального закона от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» установлено, что на территории Российской Федерации действуют санитарные правила, утвержденные федеральным органом исполнительной власти, осуществляющим федеральный государственный санитарно-эпидемиологический надзор. Соблюдение санитарных правил является обязательным для физических и юридических лиц.
В соответствии с п.п. 5.1, 5.2, абзацем вторым п. 5.7 СП 3.1.2.3114-13 «Профилактика туберкулеза», утвержденных постановлением Главного государственного санитарного врача РФ от 22.10.2013 № 60, проба Манту проводится:
— 1 раз в год независимо от результата предыдущих проб — вакцинированным против туберкулеза детям с 12-месячного возраста и до достижения 18 лет;
— 2 раза в год — детям, не вакцинированным против туберкулеза по медицинским противопоказаниям, а также по причине отказа родителей от иммунизации ребенка, до получения ребенком прививки против туберкулеза.
Дети, туберкулинодиагностика которым не проводилась, допускаются в детскую организацию при наличии заключения врача-фтизиатра об отсутствии заболевания.
Законность данной нормы подтверждена решением Верховного суда Российской Федерации от 17.02.2015, в соответствии с которым названное требование направлено на предупреждение возникновения, распространения туберкулеза, а также соблюдение прав других граждан на охрану здоровья и благоприятную окружающую среду. Положение абзаца второго п. 5.7 не противоречит нормам законодательства, так как не регулирует отношения, связанные с оказанием противотуберкулезной помощи несовершеннолетнему в возрасте до 15 лет, а также не предусматривает медицинского вмешательства без информированного добровольного согласия гражданина или его законного представителя.
Также указанное положение не устанавливает и ограничений прав на образование, гарантированных Федеральным законом от 29.12.2012 № 273-ФЗ «Об образовании в Российской Федерации».
Сложившаяся судебная практика в Свердловской области и других субъектах Российской Федерации также признает законным не допуск детей в образовательные организации без заключений (справок) от врача-фтизиатра об отсутствии заболевания.
Министерством здравоохранения Российской Федерации в письме от 07.04.2017 «О направлении клинических рекомендаций «Выявление и диагностика туберкулеза у детей, поступающих и обучающихся в образовательных организациях» разъяснено, что отсутствие обследования на туберкулезную инфекцию предполагает зачисление ребенка в образовательную организацию с последующим выбором форм и методов образовательного процесса, исключающих посещение необследованным ребенком здорового детского коллектива. При отказе от иммунодиагностики (любого иного метода, позволяющего исключить заболевание туберкулезом) врач-фтизиатр определяет возможность выдачи справки или медицинского заключения об отсутствии активной формы туберкулеза.
Федеральным законом Российской Федерации от 29. 12.2012 № 273-ФЗ «Об образовании в Российской Федерации» (ст.ст. 17, 28) с целью обеспечения права ребенка на образование предусмотрены различные формы получения образования и обучения как в организациях, осуществляющих образовательную деятельность, так и в форме семейного образования и самообразования.
12.2012 № 273-ФЗ «Об образовании в Российской Федерации» (ст.ст. 17, 28) с целью обеспечения права ребенка на образование предусмотрены различные формы получения образования и обучения как в организациях, осуществляющих образовательную деятельность, так и в форме семейного образования и самообразования.
ДИАСКИН Тест -туберкулинодиагностика
Диаскинтест (Туберкулиновая проба): АЛЛЕРГЕН ТУБЕРКУЛЕЗНЫЙ РЕКОМБИНАНТНЫЙ
Современные российские клиники, начиная с 2009 года, практикуют новые методы определения и диагностирования присутствия бактерий туберкулеза у взрослых и детей. В частности, для наибольшей точности установления диагноза, широкое применение получила методика – Диаскинтест.
Диаскинтест представляет собой инновационный препарат, специально синтезированный для аллергодиагностики туберкулеза. Так называемый аллерген туберкулезный рекомбинантный состав позволяет с наилучшим процентом точности зафиксировать присутствие инфекционного заражения в организме.
В основу препарата вошли два антигена с аббревиатурными номерами CFP10 и ESAT6, которые имеют присутствие в штампах вирулентных бактерий туберкулеза, но по факту являются безопасными элементами, применяемыми для производства сывороток БЦЖ и БЦЖ-М.
При использовании Диаскинтест явные следы истинного инфицирования туберкулезом неизменно себя проявят. Даже если у человека уже была произведена прививка БЦЖ или имеется поствакцинальная аллергия на данный тип прививок, то проведение вакцинации аллерген туберкулезным рекомбинантным составом является приемлемым, поскольку не создает риска заболеть туберкулезом.
Важно осознавать, что Диаскинтест это не полноценная прививка, а специальная форма тестирования, аналогичная форме Манту.
Только в отличие от последнего варианта, новый способ многократно точнее отражает реальную картину. В частности, показатель точности пробы Манту составляет 50-70%, а проведение тестирования на основе диаскинтеста составляет не менее 90%.
Основанием к отказу от проведения данного теста может служить лишь острая инфекционная активность в организме пациента или явные признаки эпилепсии.
Правомерно ли отстранение ребенка от посещения занятий в школе при отказе от проведения пробы Манту?
Ответ: В соответствии со ст. 10 Федерального закона от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» граждане обязаны выполнять требования санитарного законодательства и не осуществлять действий, влекущих за собой нарушение прав других граждан на охрану здоровья и благоприятную среду обитания.
Санитарно-эпидемиологическими правилами СП 3.1.2.3114-13 «Профилактика туберкулеза» (далее- Правила) определено, что в Российской Федерации основным методом раннего выявления туберкулёза у детей является ежегодная туберкулинодиагностика (внутрикожная аллергическая проба с туберкулином – проба Манту). В целях раннего выявления туберкулёза туберкулинодиагностика проводится детям с 12-месячного возраста и до достижения ими 18 лет (пункт 5.1 Правил). Пробу Манту ставят 1 раз в год независимо от результата предыдущих проб.
В целях раннего выявления туберкулёза туберкулинодиагностика проводится детям с 12-месячного возраста и до достижения ими 18 лет (пункт 5.1 Правил). Пробу Манту ставят 1 раз в год независимо от результата предыдущих проб.
В случае отказа родителей от туберкулинодиагностики для получения заключения о состоянии здоровья ребёнка рекомендуется рентгенологическое обследование органов грудной клетки.
В соответствии со ст.17.3 Федерального закона от 09.01.1996 № 3-ФЗ «О радиационной безопасности населения» гражданин имеет право отказаться от медицинских рентгенорадиологических процедур, за исключением профилактических исследований, проводимых в целях выявления заболеваний, опасных в эпидемиологическом отношении, в т.ч. туберкулёза.
Дети, туберкулинодиагностика которым не проводилась, допускаются в детскую организацию при наличии заключения врача-фтизиатра об отсутствии заболевания (п. 5.7 Правил).
Вышеуказанный пункт Правил не устанавливает ограничений прав на образование в Российской Федерации (решение Верховного Суда Российской Федерации от 17. 12.2015 № АКПИ14-1454 «Об отказе в удовлетворении заявления о признании недействующим пункта 1.3 и абзаца второго пункта 5.7 Санитарно-эпидемиологических правил СП 3.1.2.3114-13 «Профилактика туберкулёза», утв. постановлением Главного государственного санитарного врача Российской Федерации от 22.10.2013 № 60).
12.2015 № АКПИ14-1454 «Об отказе в удовлетворении заявления о признании недействующим пункта 1.3 и абзаца второго пункта 5.7 Санитарно-эпидемиологических правил СП 3.1.2.3114-13 «Профилактика туберкулёза», утв. постановлением Главного государственного санитарного врача Российской Федерации от 22.10.2013 № 60).
В случае отказа родителей от туберкулинодиагностики и невозможности предоставить в образовательную организацию заключение врача-фтизиатра об отсутствии заболевания администрация обязана временно отстранить ребёнка от посещения образовательной организации до предоставления результатов туберкулинодиагностики.
Родители вправе реализовать право ребёнка на получение образования вне организации, осуществляющей образовательную деятельность, в форме семейного образования, самообразования в соответствии со ст. 17 Федерального закона от 29.12.2012 № 273-ФЗ «Об образовании в Российской Федерации». Это подтверждено, в частности, решением Первомайского районного суда города Мурманска от 19. 04.2016 по делу № 2а-4014/16 об оспаривании приказа директора муниципального бюджетного общеобразовательного учреждения г. Мурманска об отстранении обучающегося от посещения образовательной организации.
04.2016 по делу № 2а-4014/16 об оспаривании приказа директора муниципального бюджетного общеобразовательного учреждения г. Мурманска об отстранении обучающегося от посещения образовательной организации.
Допуск детей в образовательную организацию, не прошедших туберкулинодиагностику и не имеющих заключение фтизиатра об отсутствии заболевания туберкулёзом, влечёт за собой нарушение прав других несовершеннолетних на охрану здоровья и благоприятную среду обитания. Подобные действия администрации образовательной организации образуют состав административного правонарушения, ответственность за которое предусмотрена ст. 6.7 Кодекса об административных правонарушениях Российской Федерации.
«Сейчас без пробы Манту на дистант переводят, а потом без прививки от ковида на уроки не пустят?»: в Казани директора школ перешли в наступление на родителей-«отказников»
В Казани разгораются школьные скандалы из-за родительских отказов от постановки детям проб Манту. Две мамы учеников 127-й школы и 121-го лицея, которые категорически против «вредного» обследования детей на туберкулез, получили от учебных заведений уведомления, что с ними приостанавливают образовательные отношения. Позже одной из мам вручили другое уведомление: на этот раз о том, что ее детей 9 и 12 лет временно переводят на дистанционку. В итоге дети вот уже вторую неделю не ходят в школу, а родительница обратилась в прокуратуру.
Две мамы учеников 127-й школы и 121-го лицея, которые категорически против «вредного» обследования детей на туберкулез, получили от учебных заведений уведомления, что с ними приостанавливают образовательные отношения. Позже одной из мам вручили другое уведомление: на этот раз о том, что ее детей 9 и 12 лет временно переводят на дистанционку. В итоге дети вот уже вторую неделю не ходят в школу, а родительница обратилась в прокуратуру.
— В конце новогодних праздников классные руководители моих детей, которые учатся в 3-м и 5-м классах, прислали мне по «Ватсапу» уведомление, что школа приостанавливает со мной образовательные отношения до тех пор, пока я не предоставлю справку от фтизиатра о здоровье детей. С третьей четверти, то есть с 11 января, моих детей не пускают в школу, — рассказала «ВК» мама двух учеников школы № 127 Приволжского района, попросив не публиковать ее фамилию. — На каком основании школа нарушает конституционное право на доступное общее образование? Мои дети на учете в туберкулезном диспансере никогда не стояли, результаты их флюорографии я приносила в школу при поступлении. А туберкулинодиагностику я не признаю, так как считаю, что от нее больше вреда, чем пользы: в составе пробы Манту и диаскинтеста содержится ядовитый фенол.
А туберкулинодиагностику я не признаю, так как считаю, что от нее больше вреда, чем пользы: в составе пробы Манту и диаскинтеста содержится ядовитый фенол.
Возмущенная мама обратилась в прокуратуру и написала эмоциональный пост в паблике «Поборы в школах и детсадах», сопроводив его копией уведомления, подписанного директором школы Фаридой Ферафонтовой 22 декабря 2020 года:
«Из-за отказа от противотуберкулезной диагностики директор школы отказывается допускать моих детей на уроки… Она говорит, что инициатива идет со стороны поликлиники, что предписание пришло оттуда и она ничего сделать не может… Неужели угрозой отрыва от учебы или иными мерами действительно могут принудить проходить то, что они требуют?»
Взбудораженная общественность разделилась на два лагеря. Одни убеждены, что школа «много на себя взяла». Другие — что родительница раздула проблему на ровном месте.
Тем временем мать-«отказница» по совету единомышленников взяла в тубдиспансере справку, что отказывается от обследования детей на туберкулез, и 16 января принесла ее директору 127-й школы, сняв встречу на телефон. На видео, опубликованном в том же паблике, директор берет у родительницы справку, зачитывает вслух и выносит вердикт:
На видео, опубликованном в том же паблике, директор берет у родительницы справку, зачитывает вслух и выносит вердикт:
— «На обследование — отказ родителей. Исключить заболевание туберкулезом не представляется возможности. Рекомендовано обследование на туберкулез». Эта справочка нам не подходит, так как она говорит о том, что вы не обследовались. Мы защищаем права других детей, которые у нас обучаются. Поэтому я возвращаю эту справочку и предлагаю вам, пока вы не принесете справку, что прошли обследование у фтизиатра, в течение недели с 18 по 23 января, находиться на дистанционном обучении. Вот уведомление о дистанционном обучении.
В ответ родительница на камеру заявляет, что отказывается от дистанционки.
— Кроме того, я вызвала полицию, чтобы правоохранители зафиксировали в протоколе, что моих детей не пустили в школу. Мои дети не заразные! — заявила «ВК» мама-«отказница». — Мы не можем учиться на удаленке, так как дома у нас нет компьютера, а детям нужно общение с ровесниками.
Как объяснили вчера «ВК» в администрации школы № 127, на дистанционку двое учеников были отправлены в интересах более 900 учащихся:
— Мы не имеем права подвергать их опасности. Мы руководствовались предписанием Управления Роспотребнадзора по РТ от 17 декабря 2020 года. Согласно документу, учащиеся допускаются к урокам только при предоставлении справки от фтизиатра.
В пресс-службе мэрии Казани на наш запрос ответили, что в действиях руководства школы нарушений не выявлено:
«Пунктом 5.7 Санитарно-эпидемиологических правил СП 3.1.2.3114-13 «Профилактика туберкулеза» предусмотрено, что дети, которым туберкулинодиагностика не проводилась, допускаются в детскую организацию при наличии заключения врача-фтизиатра об отсутствии заболевания. При отсутствии такой справки ребенок действительно не может быть допущен к учебе, о чем руководитель школы спокойно и вежливо пояснила родителю.
Отсутствие медицинского заключения врача-фтизиатра влечет нарушение прав ребенка на образование и в данном случае является неисполнением родителями обязанностей по его содержанию и воспитанию… До получения данного заключения школа готова предоставить семье возможность обучения с использованием дистанционных технологий, однако мама от нее категорически отказалась».
Уведомление «о приостановлении образовательных отношений» получила в январе еще одна казанская родительница — противница проб Манту, чья дочь учится в лицее № 121 Советского района.
— Когда учительница заявила нам перед дверями кабинета: «Вы в класс не зайдете», я ответила, что вызову полицию. Это помогло: пока дочь спокойно ходит на занятия, а я в диалоге с руководством школы, — рассказала «ВК» Динара Зайнуллина.
— Мы будем внимательно следить за развитием конфликтов и при необходимости обратимся в Рособрнадзор по факту самоуправства школ, — прокомментировала в свою очередь ситуацию «ВК» создатель паблика «Поборы в школах и детсадах» Екатерина Матвеева. — Складывается впечатление, что в Татарстане начался очередной этап борьбы с противниками туберкулинодиагностики. Если раньше родителей пытались запугать комиссиями ПДН, мол, плохо выполняете родительские обязанности, то теперь решили не пускать детей в школу. Сейчас детей без пробы Манту принудительно на дистант переводят, а потом без прививки от ковида на уроки не пустят?
Вакцинация детей и взрослых, вакцины нового поколения – сеть клиник МЕДСИ
Вакцинация в клиниках МЕДСИ проводится под контролем квалифицированного специалиста в соответствии с Национальным календарем прививок. Кроме того, осуществляется вакцинация против некоторых инфекций, не входящих в список обязательных прививок, в том числе от гепатита А, вируса папилломы человека, клещевого энцефалита, ротавирусной инфекции, менингококковой инфекции, ветряной оспы.
Кроме того, осуществляется вакцинация против некоторых инфекций, не входящих в список обязательных прививок, в том числе от гепатита А, вируса папилломы человека, клещевого энцефалита, ротавирусной инфекции, менингококковой инфекции, ветряной оспы.
В клиниках используются только качественные отечественные и импортные вакцины. Специалисты МЕДСИ пристально следят за тенденциями фармацевтического рынка и оперативно приобретают в арсенал клиник вакцины нового поколения, то есть более эффективные и безопасные.
Вакцинация проводится в клиниках МЕДСИ по предварительной записи на удобное для вас время при наличии вакцины и после осмотра врача. Записаться на приём и уточнить информацию о наличии нужной Вам вакцины в клиниках «МЕДСИ» можно по телефону круглосуточного контактного центра +7 ((495) 023-60-84.
Ежегодная вакцинации против гриппа – защита взрослых и детей
Грипп – острая инфекция, вызывающая ежегодные эпидемии. Протекает с высокой температурой в течение 3-5 дней, с резкой интоксикацией в виде головной боли, болей в мышцах. Грипп обостряет хронические воспалительные процессы в организме, тем самым обусловливая высокую летальность от осложнений.
Протекает с высокой температурой в течение 3-5 дней, с резкой интоксикацией в виде головной боли, болей в мышцах. Грипп обостряет хронические воспалительные процессы в организме, тем самым обусловливая высокую летальность от осложнений.
Возбудители – пневмотропные РНК-содержащие вирусы 3-х серотипов (А,В,С).
Распространение гриппа в наше время в значительной степени связано с быстротой перемещения населения.
Вакцинация – наиболее эффективный метод снижения заболеваемости не только гриппом, но и ОРЗ, вызванных другими респираторными вирусами, как среди взрослых, так и среди детей, в том числе больных бронхиальной астмой и респираторными аллергозами.
Иммунитет вырабатывается через 14 дней после вакцинации.
Постоянная мутация штаммов вируса гриппа, а также непродолжительность поствакцинального периода (6-12 месяцев) требуют ежегодного повторения прививок, даже если ее штаммовый состав, по сравнению с предыдущим сезоном, не изменился. При заражении штаммами гриппозного вируса, отличающимся от вакцинных, заболевание у вакцинированных протекает легче. Живые вакцины слабореактогенны, температура выше 37, 5 в первые 3 дня допускается не более чем у 2% привитых. Субъединичные вакцины дают слабые кратковременные (48-72 часа) реакции не более чем у 3%. Наименее реактогенными по данным международных независимых исследований являются субъединичные вакцины.
При заражении штаммами гриппозного вируса, отличающимся от вакцинных, заболевание у вакцинированных протекает легче. Живые вакцины слабореактогенны, температура выше 37, 5 в первые 3 дня допускается не более чем у 2% привитых. Субъединичные вакцины дают слабые кратковременные (48-72 часа) реакции не более чем у 3%. Наименее реактогенными по данным международных независимых исследований являются субъединичные вакцины.
Противопоказания для всех вакцин – аллергия к белкам куриного яйца, аллергические реакции на введение любой гриппозной вакцины. Все гриппозные вакцины готовятся из актуальных штаммов вирусов А/h2N1, A/h4N2, В, рекомендуемых ежегодно BОЗ.
Безопасность
Памятки для населения по профилактике туберкулеза
Внимание! Туберкулез не дремлет!Напоминаем, что туберкулез – это очень серьезное инфекционное заболевание, которое поражает легкие. Еще более опасным его делает путь передачи – воздушно-капельный. Велика вероятность заразиться туберкулезом даже при обычном разговоре с больным. Туберкулёз не зря называют «коварным» заболеванием. И это правда! Выраженные симптомы заболевания, увы, проявляются зачастую только при необратимых изменениях в лёгких. В большинстве же случаев — заболевший туберкулёзом человек длительное время чувствует себя удовлетворительно.
Велика вероятность заразиться туберкулезом даже при обычном разговоре с больным. Туберкулёз не зря называют «коварным» заболеванием. И это правда! Выраженные симптомы заболевания, увы, проявляются зачастую только при необратимых изменениях в лёгких. В большинстве же случаев — заболевший туберкулёзом человек длительное время чувствует себя удовлетворительно.
Больше всего заболеть туберкулезом рискуют люди, у которых ослаблен иммунитет (дети, пожилые люди, ВИЧ-инфицированные). Если болезнь не начать вовремя лечить, велик риск развития опасной внелегочной формы – в этом случае он поражает другие внутренние органы (почки, головной мозг, кости).
Эпидемическая ситуация по заболеваемости туберкулезом в Пермском крае остается неблагополучной. Заболеваемость из года в год превышает уровень по России в среднем в 1,5 раза. В 2016 г. был отмечен рост заболеваемости туберкулезом детей в возрастной группе до года — в 3 раза в сравнении с 2015 г., в возрасте от 3-х до 6-ти лет в 1,4 раза, в возрасте 15-17 лет в 1,2 раза в сравнении с 2015 г.
Одной из основных причин значительного роста заболеваемости туберкулезом детей является увеличение числа отказов родителей от прививок против туберкулеза (БЦЖ) и иммунодиагностики (пробы Манту и Диаскинтеста).
Число детей оставшихся без прививки БЦЖ, рождённых в 2016 году – 1752 чел. Всего в Пермском крае не охвачено БЦЖ 4199 детей и эта цифра с каждым годом становится все больше.
Вакцинация против туберкулеза по-прежнему остается самой эффективной мерой, влияющей на заболеваемость детей и подростков, и это подтверждается фактами. Так, заболеваемость туберкулезом среди вакцинированных детей до 14 лет в 2015 г. составила 10,1 на 100 тыс., в 2016 г. – 9,6, среди не вакцинированных – в 38 и 29 раз выше (386,6 и 279,1 на 100 тыс.) соответственно.
Прививки БЦЖ полностью защищают детей от самых тяжелых видов туберкулеза, способных привести к смерти. После вакцинации сохраняется иммунитет до 7 лет.
Повторная вакцинация от туберкулеза может быть проведена в 7 и 14 лет, ее необходимость определяется с помощью пробы Манту, которую нужно делать ежегодно.
Диагностическая туберкулиновая проба Манту широко используется в России с 1965 г., а применяемый для нее туберкулин утвержден ВОЗ в качестве стандарта еще в 1952 г. Уже как минимум три поколения людей приходят со своими детьми за получением пуговки, но только в последние годы туберкулинодиагностика внезапно была объявлена опасной для здоровья.
Кто-то вдруг прочитал, что в состав туберкулина входит фенол. И началось!
- Фенол способен вызывать шок, слабость, конвульсии, поражение почек, сердечную недостаточность, токсичен для всех клеток организма!
- Фенол вызывает лейкоз!
- Фенол поражает нервную систему!
При этом борцов с пробой Манту не смущает тот факт, что фенол в качестве консерванта используется, помимо туберкулина, в огромном количестве других медицинских препаратов. Матери детей-аллергиков отказываются от пробы Манту из-за боязни фенола, но не возражают против диагностического внутрикожного введения аллергенов, содержащих 0,2–0,4% того же самого фенола! Фенол в качестве консерванта содержится в инсулине, в свечах, антисептиках для полоскания горла, каплях для ушей, других разнообразных препаратах. Можно составить впечатляющий список лекарственных препаратов, которые в процессе метаболизма в организме превращаются в фенол. И возглавит этот список не что иное, как парацетомол (парацетиламинофенол), который на основании многих исследований во всем мире считается самым безопасным детским лекарством от «температуры». Что же, фармацевтическая промышленность вознамерилась всех отравить? Конечно, нет! Фенол токсичен, но в гораздо более высоких дозах, чем те, которые содержатся в медикаментах (в том числе и туберкулине). Случаев отравления фенолом от пробы Манту (или диагностических аллергенов) не описывается в источниках литературы.
Можно составить впечатляющий список лекарственных препаратов, которые в процессе метаболизма в организме превращаются в фенол. И возглавит этот список не что иное, как парацетомол (парацетиламинофенол), который на основании многих исследований во всем мире считается самым безопасным детским лекарством от «температуры». Что же, фармацевтическая промышленность вознамерилась всех отравить? Конечно, нет! Фенол токсичен, но в гораздо более высоких дозах, чем те, которые содержатся в медикаментах (в том числе и туберкулине). Случаев отравления фенолом от пробы Манту (или диагностических аллергенов) не описывается в источниках литературы.
Следует добавить, что мутагенного эффекта любых доз фенола в отношении млекопитающих (и человека тоже) никогда не наблюдалось. Канцерогенность фенола не доказана, несмотря на продолжающиеся эксперименты и многолетние наблюдения за людьми, подвергающимися хроническому фенольному воздействию.
Знайте, что уберечь ребенка от туберкулеза можно. Во-первых, это вакцинация – основной фактор защиты, который даст уверенность в том, что ребенок не заболеет. Далее — при помощи Манту или Диаскинтеста. Родители не должны забывать, что надо не только сделать реакцию Манту ребенку, но и самому пройти флюорографию, и в случае возникновения вопросов пройти дообследование.
Далее — при помощи Манту или Диаскинтеста. Родители не должны забывать, что надо не только сделать реакцию Манту ребенку, но и самому пройти флюорографию, и в случае возникновения вопросов пройти дообследование.
Помните – забота о детях и их будущее в наших с Вами руках!
Назад
Минздрав края отвечает на вопросы о вакцинации от коронавируса
Продолжается вакцинация населения от коронавирусной инфекции. Министерство здравоохранения Красноярского края отвечает на вопросы жителей, которые планируют поставить прививку от COVID-19.Большая часть современных вакцин содержит куриный белок и ее нельзя ставит людям с аллергией на вещество. Есть ли белок в вакцине «Спутник V»?
Вакцина белок куриного яйца не содержит. Ее можно ставить тем, у кого есть непереносимость куриного белка.
Вакцина «Спутник V» «живая» или «неживая»?
«Спутник V» — это комбинированная векторная вакцина. Она не содержит в себе «живых» вирусов.
Есть ли противопоказания для прививки? С какими заболеваниями точно нельзя ставить прививку от коронавируса?
Противопоказано ставить прививку людям со следующими хроническими заболеваниями:
После вакцинации пациент должен находиться под наблюдением медицинского персонала в течение 30 минут.
 В первые-вторые сутки могут развиваться кратковременные общие реакции организма – пациент может почувствовать озноб, повышение температуры тела, головную боль, общее недомогание, боли в суставах, быструю утомляемость.
В первые-вторые сутки могут развиваться кратковременные общие реакции организма – пациент может почувствовать озноб, повышение температуры тела, головную боль, общее недомогание, боли в суставах, быструю утомляемость.Помимо этого, часть пациентов чувствует болезненность в месте укола. Однако все эти возможные реакции быстро проходят.
Редко возможно развитие аллергических реакций, кратковременное повышение уровня печеночных трансаминаз, креатинина и креатинфосфокиназы в сыворотке крови.
Обязательно ли перед прививкой сдавать анализ на антитела к коронавирусной инфекции?
Сдавать антитела перед прививкой необязательно.
Необходимо ли сдавать какие-то дополнительные анализы перед прививкой?
Сдавать анализы перед прививкой необязательно. В день прививки осмотр будет проводить врач, который расспросит обо всех хронических заболеваниях.
Если человек переболел, но антител к коронаврусной инфекции у него нет, можно ли ставить прививку?
Переболевшие COVID-19 в течение последних шести месяцев не прививаются. Однако если Вы сдали анализ на антитела и он отрицательный, то прививку ставить можно.
Однако если Вы сдали анализ на антитела и он отрицательный, то прививку ставить можно.
Вакцинация бесплатна для всех групп населения?
Да, прививка ставится бесплатно.
Можно ли ставить вакцину людям старше 65 лет?
Да, можно. Вакцина разрешена людям от 18 лет и старше.
Можно ли ставить прививку детям?
Детям прививку не ставят из-за отсутствия соответствующих исследований. Прививку ставят людям старше 18 лет.
Можно ли ставить прививку беременным?
Беременным и кормящим женщинам прививку не ставят. Планирующим беременность женщинам стоит поставить прививку от коронавирусной инфекции минимум за 3 месяца до зачатия.
Как можно записаться на прививку?
Записаться на прививку можно, обратившись по телефону в регистратуру любой поликлиники или обратившись лично в регистратуру лечебного учреждения (В Железногорске по телефону колл-центра Клинической больницы 75-40-40).
Также записаться можно через личный кабинет на портале www.web-registratura.ru либо через личный кабинет на едином портале государственных услуг www.gosuslugi.ru.
Можно ли вакцинироваться тем, кто сделал прививку от гриппа? Защищает ли прививка от коронавируса также и от гриппа?
Тем, кто привился от гриппа, поставить прививку от коронавируса можно через месяц. Прививка от Covid-19 не сможет защитить организм от гриппа.
Нужно ли заполнять дневник самочувствия?
Да. Это позволит отслеживать реакцию организма на прививку. Дневник пациента нужно заполнять в личном кабинете на сайте www.gosuslugi.ru.
Что делать, если стало плохо после того, как сделали прививку?
Обязательно обратиться к врачу. Информацию о состоянии также необходимо внести в дневник наблюдений за состоянием здоровья после прививки.
Нужно ли носить маску после вакцинации?
Да, маску носить необходимо и после вакцинации.
Можно ли принимать алкоголь перед и после прививки?
Три дня до и три дня после введения вакцины необходимо воздержаться от алкоголя.
Выдается ли сертификат после прививки?
После прививки пациент получает сертификат, в котором написано, какую прививку и когда он поставил.
Очищенные белковые производные туберкулина
FEMS Immunol Med Microbiol. Авторская рукопись; Доступен в PMC 2013 декабря 1.
Опубликовано в окончательной редактированной форме AS:
PMCID: PMC34
NIHMSID: NIHMMS3
Государственный университет Колорадо, Департамент микробиологии, иммунологии и патологии, Форт-Коллинз, Colorado 80523
* Автор, ответственный за переписку: Карен М. Добос, Почтовый адрес: 1682 Campus Delivery, отделение микробиологии, иммунологии и патологии; Университет штата Колорадо, Форт.Collins, CO 80523-1682, тел.: 970-491-6549, [email protected] См. другие статьи в PMC, в которых цитируется опубликованная статья.
Abstract
Туберкулиновая кожная проба, которая включает мониторинг иммунной реакции на инъекцию очищенного производного белка (PPD), была наиболее широко используемым методом для выявления инфекции Mycobacterium tuberculosis с момента ее разработки в 1930-х годах. До недавнего времени молекулярный состав PPD был неизвестен. Это помешало открытию улучшенных реагентов для кожных тестов и резко затруднило усилия по определению механизма действия.Протеомная оценка PPD в сочетании с подробным анализом на модели туберкулеза морской свинки привела к дальнейшему определению молекулярного состава PPD. В этом сообщении рассматривается история и текущее состояние PPD, в дополнение к описанию реагентов-кандидатов PPD следующего поколения, основанных на использовании отдельного белка или белковых коктейлей.
Ключевые слова: Туберкулез, Очищенное производное белка, Туберкулиновая кожная проба, Диагностика2 – 1,5 миллиона смертей и 8,5 – 9,2 миллиона случаев заболевания в 2010 г. , причем большинство этих трагических событий произошло в развивающихся странах (ВОЗ, 2011 г.). Его тяжесть усугубляется способностью Mycobacterium tuberculosis ( Mtb ), возбудителя туберкулеза, сохраняться в виде персистирующей бессимптомной инфекции, называемой латентной туберкулезной инфекцией (ЛТБИ). В течение почти столетия лица, инфицированные Mtb , выявлялись с помощью туберкулиновой кожной пробы (ТКП). В 1890 году Роберт Кох предположил, что глицериновый экстракт туберкулезных бацилл может как лечить, так и предотвращать туберкулез.Хотя «Старый туберкулин» Коха в конечном итоге потерпел неудачу в качестве терапии, его открытия стали катализатором разработки современной ТКП, наиболее важного инструмента для выявления потенциальных случаев ТБ на сегодняшний день (Shingadia & Novelli, 2008).
, причем большинство этих трагических событий произошло в развивающихся странах (ВОЗ, 2011 г.). Его тяжесть усугубляется способностью Mycobacterium tuberculosis ( Mtb ), возбудителя туберкулеза, сохраняться в виде персистирующей бессимптомной инфекции, называемой латентной туберкулезной инфекцией (ЛТБИ). В течение почти столетия лица, инфицированные Mtb , выявлялись с помощью туберкулиновой кожной пробы (ТКП). В 1890 году Роберт Кох предположил, что глицериновый экстракт туберкулезных бацилл может как лечить, так и предотвращать туберкулез.Хотя «Старый туберкулин» Коха в конечном итоге потерпел неудачу в качестве терапии, его открытия стали катализатором разработки современной ТКП, наиболее важного инструмента для выявления потенциальных случаев ТБ на сегодняшний день (Shingadia & Novelli, 2008).
ТКП также известна как проба Манту в честь французского врача Шарля Манту (1877–1947), который установил диагностические критерии для чтения ТКП. Метод Манту, одобренный Американским торакальным обществом и Центрами по контролю и профилактике заболеваний (CDC), в настоящее время является золотым стандартом для определения того, инфицирован ли человек Mtb. Этот иммунологический тест состоит из двух частей. Сначала реагент очищенного производного белка (PPD) вводят внутрикожно в предплечье. Во-вторых, реакцию гиперчувствительности замедленного типа (ГЗТ) отслеживают через 48-72 часа после инъекции путем измерения диаметра уплотнения (отека из-за воспаления) в миллиметрах в месте инъекции. Обычным явлением является визуализация эритемы (покраснения) в течение первых 24 часов после введения PPD; это не следует измерять, так как это не указывает на инфекцию.Проведение и чтение результатов этого теста должны выполняться обученными медицинскими работниками, которые могут интерпретировать факторы риска наряду с измерением при определении положительной реакции (Mackin, 1998).
Этот иммунологический тест состоит из двух частей. Сначала реагент очищенного производного белка (PPD) вводят внутрикожно в предплечье. Во-вторых, реакцию гиперчувствительности замедленного типа (ГЗТ) отслеживают через 48-72 часа после инъекции путем измерения диаметра уплотнения (отека из-за воспаления) в миллиметрах в месте инъекции. Обычным явлением является визуализация эритемы (покраснения) в течение первых 24 часов после введения PPD; это не следует измерять, так как это не указывает на инфекцию.Проведение и чтение результатов этого теста должны выполняться обученными медицинскими работниками, которые могут интерпретировать факторы риска наряду с измерением при определении положительной реакции (Mackin, 1998).
Помимо своей роли индикатора инфекции Mtb , ТКП также используется в качестве эпидемиологического инструмента для оценки распространенности латентной туберкулезной инфекции (ЛТБИ). Прогноз о том, что одна треть населения мира инфицирована Mtb , частично основан на частоте положительной ТКП (Dye , et al. , 1999).
, 1999).
В текущем обзоре мы представляем обзор истории, развития и текущего использования PPD. Кроме того, будут рассмотрены исследования, направленные на определение ключевых молекулярных компонентов PPD и его биологической активности.
Прошлое и настоящее использование PPD
Первая кожная туберкулиновая проба была введена в 1907 г. фон Пирке (1874–1929), австрийским ученым и педиатром (Turk, 1987). В его исследовании использовалась ОТ Коха, нагретый бульон, состоящий из неочищенной неопределенной смеси белков и других макромолекул, полученных из туберкулезной палочки.OT Коха готовили из концентрированного фильтрата глицерино-пептонного бульона, в котором Mtb росли в течение 6–8 недель. OT Koch и аналогичные продукты не используются в качестве реагентов для ТКП в США из-за недостаточной чистоты, различий в эффективности и специфичности, а также из-за недостаточной стандартизации.
В 1930 г. из фильтрата культуры Mtb был получен альтернативный состав, известный как MA-100, в виде состава, не содержащего полисахаридов (Masucci & McAlpine, 1930). Было обнаружено, что МА-100 значительно более эффективен, чем ОТ Коха; однако его использование в качестве стандартного диагностического реагента было ограничено — в основном из-за сенсибилизирующего действия, наблюдаемого при повторных инъекциях в кожу.
Было обнаружено, что МА-100 значительно более эффективен, чем ОТ Коха; однако его использование в качестве стандартного диагностического реагента было ограничено — в основном из-за сенсибилизирующего действия, наблюдаемого при повторных инъекциях в кожу.
В 1934 году Флоренс Б. Зайберт (1897–1991), биохимик из Института Генри Фиппса Пенсильванского университета, разработала более стабильный и последовательный препарат (Seibert, 1934). Первоначально обозначенный по способу его производства, SOTT, аббревиатура от «синтетический средний осадок туберкулина трихлоруксусной кислоты», этот продукт позже был назван очищенным белковым производным или PPD. Его получали пропариванием культур Mtb в стерилизаторе Arnold и очисткой белков повторным осаждением сульфатом аммония (Seibert & Glen, 1941).По сравнению с предыдущими туберкулиновыми реагентами, в этом методе приготовления PPD было значительно снижено содержание полисахаридов, нуклеиновых кислот и липидов, и, таким образом, это был реагент, богатый белком.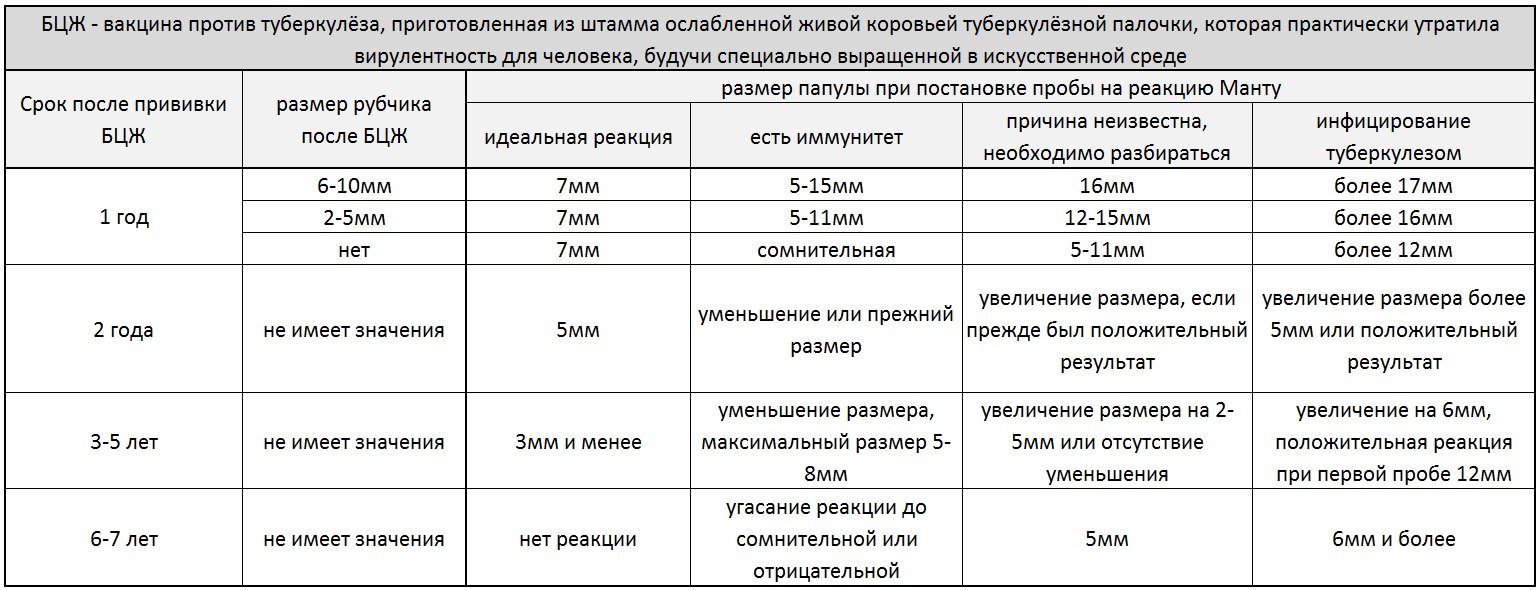 В 1944 году большая партия этого улучшенного PPD (партия 49608), переименованного в PPD-S (PPD-Standard), была предоставлена в качестве эталонного продукта в Соединенных Штатах. PPD-S состоял примерно из 92,9% белка, 5,9% полисахаридов и 1,2% нуклеиновой кислоты (Seibert & Glen, 1941). Из-за повышенной чистоты и активности PPD-S был принят Всемирной организацией здравоохранения (ВОЗ) в качестве международного стандарта туберкулина в 1952 году (Guld , et al., 1958). С 1978 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) потребовало, чтобы все партии PPD были квалифицированы биологическим анализом и должны демонстрировать активность, эквивалентную активности PPD-S (Sbarbaro, 1978). Международная единица (МЕ) для PPD была определена как часть этого эффекта; одна МЕ равна биологической активности, содержащейся в 0,028 мкг ППД-С (0,02 мкг ППД с 0,008 мкг солей). Однако в США и Канаде эффективность PPD выражается в туберкулиновых единицах (TU), а не в IU.
В 1944 году большая партия этого улучшенного PPD (партия 49608), переименованного в PPD-S (PPD-Standard), была предоставлена в качестве эталонного продукта в Соединенных Штатах. PPD-S состоял примерно из 92,9% белка, 5,9% полисахаридов и 1,2% нуклеиновой кислоты (Seibert & Glen, 1941). Из-за повышенной чистоты и активности PPD-S был принят Всемирной организацией здравоохранения (ВОЗ) в качестве международного стандарта туберкулина в 1952 году (Guld , et al., 1958). С 1978 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) потребовало, чтобы все партии PPD были квалифицированы биологическим анализом и должны демонстрировать активность, эквивалентную активности PPD-S (Sbarbaro, 1978). Международная единица (МЕ) для PPD была определена как часть этого эффекта; одна МЕ равна биологической активности, содержащейся в 0,028 мкг ППД-С (0,02 мкг ППД с 0,008 мкг солей). Однако в США и Канаде эффективность PPD выражается в туберкулиновых единицах (TU), а не в IU.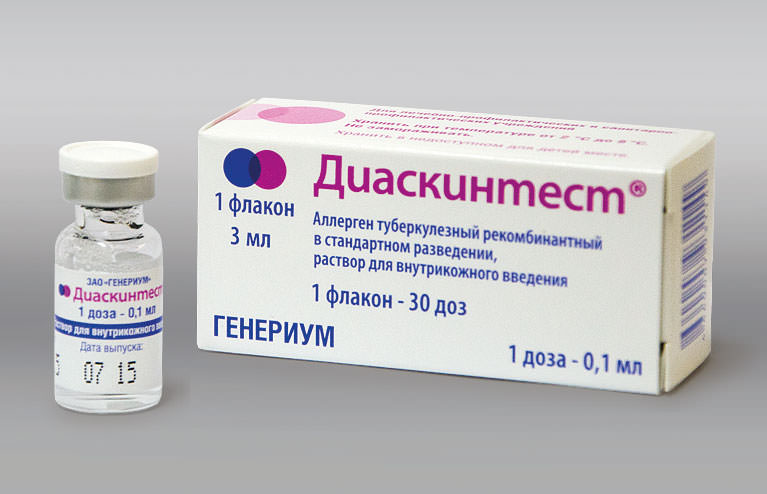 Один TU определяется как 0.02 мкг PPD-S (Edwards & Edwads, 1960). Пять ТЕ являются стандартной дозой для внутрикожного диагностического применения, как определено в эпидемиологических исследованиях (Bothamley, и др., , 1999).
Один TU определяется как 0.02 мкг PPD-S (Edwards & Edwads, 1960). Пять ТЕ являются стандартной дозой для внутрикожного диагностического применения, как определено в эпидемиологических исследованиях (Bothamley, и др., , 1999).
PPD-S2, текущий стандарт США на туберкулин PPD, был разработан в ожидании возможного истощения запасов PPD-S (Villarino, et al. ., 2000). В настоящее время Aplisol ® (JHP Pharmaceuticals, Inc, Рочестер, Мичиган) и Tubersol ® (Sanofi Pasteur Limited, Swiftwater, PA) являются двумя широко используемыми коммерчески доступными продуктами PPD-S2 (Jensen, et al., 2005). Результаты кожных испытаний с Aplisol ® и Tubersol ® вполне сравнимы с результатами оригинального стандарта PPD, PPD-S (Villarino, et al. ., 1999). Однако переход от Tubersol ® к Aplisol ® или наоборот привел к отклонениям от нормы кожных тестов, хотя точная причина до сих пор неясна (Gillenwater, et al . , 2006, Mehta, et al. , 2009).
, 2006, Mehta, et al. , 2009).
Помимо PPD-S, существует несколько других составов PPD, используемых за пределами США и Канады (Li , et al., 2008). Некоторые из этих туберкулиновых продуктов, включая PPD RT23, производятся Государственным институтом сывороток (SSI) (Comstock, и др., , 1964). В настоящее время ВОЗ и Международный союз по борьбе с туберкулезом и заболеваниями легких (IUATLD) рекомендуют 2 ТЕ PPD-RT23 с твином 80. RT23 является наиболее широко используемым продуктом PPD во всем мире (Rangel-Frausto, и др. , 2001). Несколько исследований по всему миру использовали PPD RT23 для оценки распространенности инфекции туберкулезной палочкой, включая Индию (Rao , et al. , 2008), (Vashishtha & John, 2010), Гана (Addo et al. 2010), Йемен (Al-Absi, et al. , 2009), Южная Африка (Kritzinger, et al. , 2009) (Hanifa, et al. , 2009), Непале (Shrestha, et al. , 2008), Бразилии (Lopes, et al. , 2008) и Индонезии (Bachtiar, et al. ). , 2008). Кроме того, он также использовался для оценки крупномасштабных контактов с больными туберкулезом в Нидерландах (Borgen, et al. , 2008).
, 2008) и Индонезии (Bachtiar, et al. ). , 2008). Кроме того, он также использовался для оценки крупномасштабных контактов с больными туберкулезом в Нидерландах (Borgen, et al. , 2008).
В дополнение к вышеупомянутым продуктам PPD также используются другие варианты PPD, такие как PPD RT23 Mexico (Laboratorio Nacional de Salud, Secretaria de Salud, Мехико, Мексика), продукт PPD, используемый в Латинской Америке (Rangel-Frausto и др., 2001), и японский продукт PPD-s. (Кимура, и др., 2005 ). Многочисленные продукты PPD, используемые в настоящее время, перечислены в .
Таблица 1
Препараты PPD, которые в настоящее время используются у людей
 , 1999, Teixeira , et al. , 2000, Rangel-frusto , et al. , 2001)
, 1999, Teixeira , et al. , 2000, Rangel-frusto , et al. , 2001) , 2004)
, 2004) Поскольку существует несколько производителей PPD, важно оценить различия в эффективности этих продуктов PPD.Из-за ограниченных знаний о точном составе каждого продукта PPD невозможно использовать традиционные методы контроля качества для сравнения препаратов PPD. Поэтому сравнения с использованием животных, инфицированных микобактериями, проводятся для оценки биологической активности продуктов PPD. При этом продукты PPD должны вводиться в тех же условиях, в которых они будут использоваться в клинических условиях (Hansen , et al. , 1964).
При этом продукты PPD должны вводиться в тех же условиях, в которых они будут использоваться в клинических условиях (Hansen , et al. , 1964).
Первое опубликованное сравнение эффективности PPD было проведено между PPD-S и PPD-RT23.Исследование, проведенное среди 6 групп населения в США, включая детей-эскимосов, больных туберкулезом и новобранцев в учебных центрах ВМС США, показало, что 2,5 ТЕ PPD-RT23, содержащего твин 80, обладают эффективностью, аналогичной 5 ТЕ PPD-S. (Комсток , и др. , 1964). Совсем недавно исследование 69 больных туберкулезом и 1189 субъектов с низким риском в США сравнило PPD-S2 с PPD-S1. Было обнаружено, что эти два продукта статистически неразличимы у больных туберкулезом. Кроме того, такая же высокая специфичность наблюдалась среди субъектов с низким риском.Это исследование показало, что PPD-S2 функционально эквивалентен PPD-S1 и может легко заменить его (Villarino , et al. , 2000). Многочисленные исследования сравнивали активность RT23, приготовленного в SSI, с другими источниками PPD, включая IC-65, и среди них была обнаружена эквивалентная эффективность (Ulea , et al. 2010), (Chadha , et al. , 2003), (Шиллер и др. 2010). Однако аналогичное исследование в Мексике сравнило эффективность местного производства PPD RT23 (Мексика), Tubersol ® и PPD RT23 (SSI) и выявило, что из трех RT23 (Мексика) имел гораздо более низкую чувствительность (Rangel- Фраусто и др., 2001). RT23 и туберкулин Merieux (разработанный в Pasteur-Merieux) также недавно сравнивали по их относительной активности. Оба препарата были получены из нескольких штаммов микобактерий (RT23 был получен из семи штаммов Mtb , Merieux был получен из трех штаммов Mtb, плюс M. bovis ) и, по-видимому, обладают биологической активностью, эквивалентной PPD-S. , который является продуктом одного штамма. Однако RT23 часто вызывает более сильную антигенную реакцию, чем препарат Мерье (Sgountzos, et al., 2009). Недавно Schiller et al. сравнили диагностическую надежность PPD из разных источников с помощью инновационного подхода к мониторингу ответов интерферона-γ в культурах цельной крови (Schiller , et al.
2010), (Chadha , et al. , 2003), (Шиллер и др. 2010). Однако аналогичное исследование в Мексике сравнило эффективность местного производства PPD RT23 (Мексика), Tubersol ® и PPD RT23 (SSI) и выявило, что из трех RT23 (Мексика) имел гораздо более низкую чувствительность (Rangel- Фраусто и др., 2001). RT23 и туберкулин Merieux (разработанный в Pasteur-Merieux) также недавно сравнивали по их относительной активности. Оба препарата были получены из нескольких штаммов микобактерий (RT23 был получен из семи штаммов Mtb , Merieux был получен из трех штаммов Mtb, плюс M. bovis ) и, по-видимому, обладают биологической активностью, эквивалентной PPD-S. , который является продуктом одного штамма. Однако RT23 часто вызывает более сильную антигенную реакцию, чем препарат Мерье (Sgountzos, et al., 2009). Недавно Schiller et al. сравнили диагностическую надежность PPD из разных источников с помощью инновационного подхода к мониторингу ответов интерферона-γ в культурах цельной крови (Schiller , et al.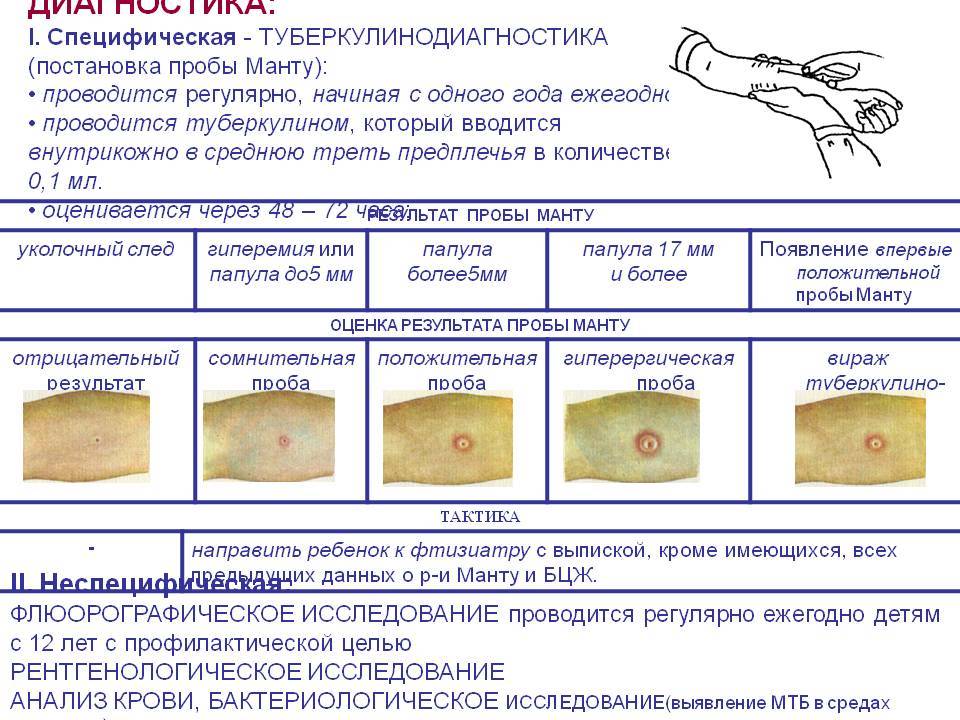 2010). В этом исследовании образцы цельной крови стимулировали несколькими различными туберкулинами, и через 24 часа после стимуляции отслеживали реакцию IFN-γ. Их результаты подтверждают, что существуют значительные различия между депрессорами из разных источников, и указывают на необходимость дальнейшей стандартизации продуктов депрессоров.Была введена количественная шкала, обозначенная как RP30 (относительная активность 30), определяемая как концентрация белка, при которой конкретный препарат PPD имеет 30% максимальной активности. RP30 можно использовать в качестве инструмента для быстрого сравнения биологической активности партий и источников PPD. Хотя в этих отчетах подчеркивается важность оценки биологической активности продуктов PPD из разных источников, расхождения в эффективности трудно объяснить из-за сложности и неоднозначности молекулярного состава PPD.Протеомная характеристика PPD была описана нашей лабораторией (Cho, et al. , 2012) и другими (Borsuk , et al.
2010). В этом исследовании образцы цельной крови стимулировали несколькими различными туберкулинами, и через 24 часа после стимуляции отслеживали реакцию IFN-γ. Их результаты подтверждают, что существуют значительные различия между депрессорами из разных источников, и указывают на необходимость дальнейшей стандартизации продуктов депрессоров.Была введена количественная шкала, обозначенная как RP30 (относительная активность 30), определяемая как концентрация белка, при которой конкретный препарат PPD имеет 30% максимальной активности. RP30 можно использовать в качестве инструмента для быстрого сравнения биологической активности партий и источников PPD. Хотя в этих отчетах подчеркивается важность оценки биологической активности продуктов PPD из разных источников, расхождения в эффективности трудно объяснить из-за сложности и неоднозначности молекулярного состава PPD.Протеомная характеристика PPD была описана нашей лабораторией (Cho, et al. , 2012) и другими (Borsuk , et al. , 2009), демонстрируя, что PPD состоит из сотен различных белков. Дополнительный сравнительный протеомный, биологический и гистологический анализы использовались для измерения относительных различий в молекулярном составе и биологической активности между PPD-S2, RT23 и PPD-KIT (PPD Корейского технологического института) (Cho, et al ., 2012). Это исследование продемонстрировало, что, хотя все 3 препарата PPD были неразличимы по своей способности индуцировать ответ ГЗТ, были очевидны гистологические различия и различия в относительном количестве нескольких белков, включая членов семейства белков Esx, что позволяет предположить корреляцию между повышенной гистопатологией и повышенная концентрация белков Esx в PPD (Cho, et al ., 2012). В совокупности все эти сравнительные отчеты иллюстрируют сложность PPD и проблемы, связанные с созданием стандартизированного реагента.
, 2009), демонстрируя, что PPD состоит из сотен различных белков. Дополнительный сравнительный протеомный, биологический и гистологический анализы использовались для измерения относительных различий в молекулярном составе и биологической активности между PPD-S2, RT23 и PPD-KIT (PPD Корейского технологического института) (Cho, et al ., 2012). Это исследование продемонстрировало, что, хотя все 3 препарата PPD были неразличимы по своей способности индуцировать ответ ГЗТ, были очевидны гистологические различия и различия в относительном количестве нескольких белков, включая членов семейства белков Esx, что позволяет предположить корреляцию между повышенной гистопатологией и повышенная концентрация белков Esx в PPD (Cho, et al ., 2012). В совокупности все эти сравнительные отчеты иллюстрируют сложность PPD и проблемы, связанные с созданием стандартизированного реагента.
Подводные камни PPD
Несмотря на то, что в прошлом столетии ТКП была стандартом для выявления лиц, подверженных риску активного ТБ, она имеет несколько фундаментальных недостатков, которые служат стимулом для разработки более стандартизированной методологии и более эффективных инструментов для выявления ЛТБИ. Основной проблемой текущего теста является высокий уровень ложноположительных результатов, вызванный неспособностью TST отличить инфекцию Mtb от воздействия нетуберкулезных микобактерий или вакцинации M.bovis Bacille Calmett-Guérin (BCG) (Huebner, и др. , 1993). Оба случая ложноположительных ответов обычно приписывают иммунному ответу, запускаемому гомологичными антигенами либо при вакцинации БЦЖ, либо от микобактерий из окружающей среды (Harboe, 1981, Huebner, и др., , 1993). Эти предположения были недавно подтверждены молекулярным анализом PPD, показывающим, что четыре белка теплового шока (GroEl, GroEs, DnaK и HspX) составляют примерно 60% протеомного содержания PPD (Cho, et al ., 2012, Борсук и др. , 2009). Эти белки-шапероны обладают высокой гомологией (более 70%) и консервативны среди большинства видов микобактерий (Cho, et al., , 2012, Borsuk, , et al., , 2009). Это усложняет использование ТКП в качестве инструмента как для эпидемиологических исследований, так и для выявления лиц, инфицированных Mtb , из-за потенциальной перекрестной реактивности при вакцинации БЦЖ или заражении нетуберкулезными микобактериями.
Основной проблемой текущего теста является высокий уровень ложноположительных результатов, вызванный неспособностью TST отличить инфекцию Mtb от воздействия нетуберкулезных микобактерий или вакцинации M.bovis Bacille Calmett-Guérin (BCG) (Huebner, и др. , 1993). Оба случая ложноположительных ответов обычно приписывают иммунному ответу, запускаемому гомологичными антигенами либо при вакцинации БЦЖ, либо от микобактерий из окружающей среды (Harboe, 1981, Huebner, и др., , 1993). Эти предположения были недавно подтверждены молекулярным анализом PPD, показывающим, что четыре белка теплового шока (GroEl, GroEs, DnaK и HspX) составляют примерно 60% протеомного содержания PPD (Cho, et al ., 2012, Борсук и др. , 2009). Эти белки-шапероны обладают высокой гомологией (более 70%) и консервативны среди большинства видов микобактерий (Cho, et al., , 2012, Borsuk, , et al., , 2009). Это усложняет использование ТКП в качестве инструмента как для эпидемиологических исследований, так и для выявления лиц, инфицированных Mtb , из-за потенциальной перекрестной реактивности при вакцинации БЦЖ или заражении нетуберкулезными микобактериями. Ложноотрицательные результаты также проблематичны, особенно у детей и лиц с ослабленным иммунитетом (Farhat, и др., )., 2006 г., Шингадия и Новелли, 2008 г.). Это связано с тем, что положительный PPD требует эффективного ответа DTH. Поэтому вполне вероятно, что PPD не может служить индикатором инфекции Mtb в тех популяциях, где отсутствует надежный Т-клеточный иммунитет. Наконец, хотя ТКП можно использовать для выявления ЛТБИ, он не позволяет провести различие между этим заболеванием, активным заболеванием или выздоравливающим пациентом. Несмотря на эти подводные камни, TST остается наиболее часто используемым инструментом для обнаружения инфекции Mtb .
Ложноотрицательные результаты также проблематичны, особенно у детей и лиц с ослабленным иммунитетом (Farhat, и др., )., 2006 г., Шингадия и Новелли, 2008 г.). Это связано с тем, что положительный PPD требует эффективного ответа DTH. Поэтому вполне вероятно, что PPD не может служить индикатором инфекции Mtb в тех популяциях, где отсутствует надежный Т-клеточный иммунитет. Наконец, хотя ТКП можно использовать для выявления ЛТБИ, он не позволяет провести различие между этим заболеванием, активным заболеванием или выздоравливающим пациентом. Несмотря на эти подводные камни, TST остается наиболее часто используемым инструментом для обнаружения инфекции Mtb .
Будущее PPD – открытие и разработка PPD следующего поколения
Разработка новых и более эффективных реагентов для выявления ЛТБИ является ключом к успеху в борьбе с туберкулезом. Улучшенное обнаружение латентных бацилл приведет к стратегиям раннего вмешательства и, вероятно, снизит заболеваемость и разорвет цикл передачи болезни.
Не следует упускать из виду усовершенствование существующих реагентов ТКП, поскольку мы движемся к цели создания новых реагентов для обнаружения ЛТБИ; однако стоит отметить, что метод количественной оценки иммунного ответа весьма субъективен.Вместо измерения диаметра уплотнений в миллиметрах тестируется несколько новых методов. К ним относятся: лазерная допплеровская визуализация у людей (Harrison, et al. , 1993), использование ручного спектрофотометра для измерения реакции ГЗТ (Chambers, et al. , 2002) и ультразвуковое исследование у пациентов ( Ciftci и др. , 2005). Эти альтернативные методы могут применяться для объективного количественного определения TST и могут преодолевать ограничения обычного способа измерения; однако следует учитывать возможность использования дорогостоящих технологий в регионах с ограниченными ресурсами.
В дополнение к улучшению метода измерения для улучшения стандартизации теста, можно улучшить фактический состав депрессора. Определение молекулярного состава PPD в течение многих лет было серьезным препятствием. Длительное нагревание сырого туберкулина для приготовления PPD способствовало денатурации, частичной деградации и агрегации многих белковых компонентов. Многочисленные исследования идентифицировали PPD как смесь очень гетерогенных белков размером от очень больших агрегатов до очень маленьких деградировавших молекул (Klausen, et al ., 1994, Rowland, et al. ., 1999, Ho, et al. , 2006). Точно так же мало было известно о том, какой из этих компонентов в PPD отвечает за реакцию DTH. С недавней идентификацией более ста белков из четырех различных PPD с помощью масс-спектрометрии (Borsuk , et al. , 2009, Cho , et al. , 2012) можно применять новые подходы для определения того, какие из этих компонентов незаконный ответ DTH.
Определение молекулярного состава PPD в течение многих лет было серьезным препятствием. Длительное нагревание сырого туберкулина для приготовления PPD способствовало денатурации, частичной деградации и агрегации многих белковых компонентов. Многочисленные исследования идентифицировали PPD как смесь очень гетерогенных белков размером от очень больших агрегатов до очень маленьких деградировавших молекул (Klausen, et al ., 1994, Rowland, et al. ., 1999, Ho, et al. , 2006). Точно так же мало было известно о том, какой из этих компонентов в PPD отвечает за реакцию DTH. С недавней идентификацией более ста белков из четырех различных PPD с помощью масс-спектрометрии (Borsuk , et al. , 2009, Cho , et al. , 2012) можно применять новые подходы для определения того, какие из этих компонентов незаконный ответ DTH.
Почти за два десятилетия до публикации молекулярного состава PPD были проведены многочисленные исследования отдельных белков для проверки их способности индуцировать реакцию ГЗТ (Klausen , et al. , 1994). Такие исследования по-прежнему имеют решающее значение для оптимизации PPD и понимания того, как он модулирует иммунную систему. Антигены, тестируемые в качестве будущих реагентов PPD, приведены в .
, 1994). Такие исследования по-прежнему имеют решающее значение для оптимизации PPD и понимания того, как он модулирует иммунную систему. Антигены, тестируемые в качестве будущих реагентов PPD, приведены в .
Таблица 2
Антигены в настоящее время под оценкой как следующее поколение PPD кандидаты
| Gene Number | Antigen | Animals | Дозировка (мкг) | Страна | Ссылка | ||
|---|---|---|---|---|---|---|---|
| Rv1980c | МПТ 64 | ГП | 0. 1 1 | Denmark | (Oettinger , et al. , 1995) | ||
| RV3875 / RV1980C | ESAT-6 / MPT 64 | GP | 1 | Denmark | (ELHAY , et al. , 1998) | ||
| RV0652 | RV0652 | Рибосомальный белок L7 / L12 | GP | 0.2 | Япония | (Kitaura , et al. , 1999) , 1999) | |
| RV0061 | DPPD | GP / Hu | 2 (GP) | USA | (Coler , et al., 2000) | ||
| RV3874 | CFP10 | GP | GP | 2 | USA | (Colangeli , et al. , 2000) | |
| RV3875 / RV3874 | ESAT-6 / CFP10 | GP / CA | 1 (GP) 2 (CA) | UK | (Van Pinxteren , et al. , 2000) , 2000) | ||
| RV3875 | ESAT-6 | CA | 25-400 | 25-400 | Дания | (Pollock , et al., 2003) | |
| RV0061 | |||||||
| DPPD | HU | Hu | 0.2-5 | США | (Campos-Neto , et al. , 2001) , 2001) | ||
| RV0061 | DPPD | GP | 5 | USA | (Liu , et al. , 2004) | , 2004)||
| RV3875 | ESAT-6 | GP | GP | 0.01-1 | Дания | (Aggerbeck & Madsen, 2006) | |
| Rv3875 | ESAT-6 | Ху | 0.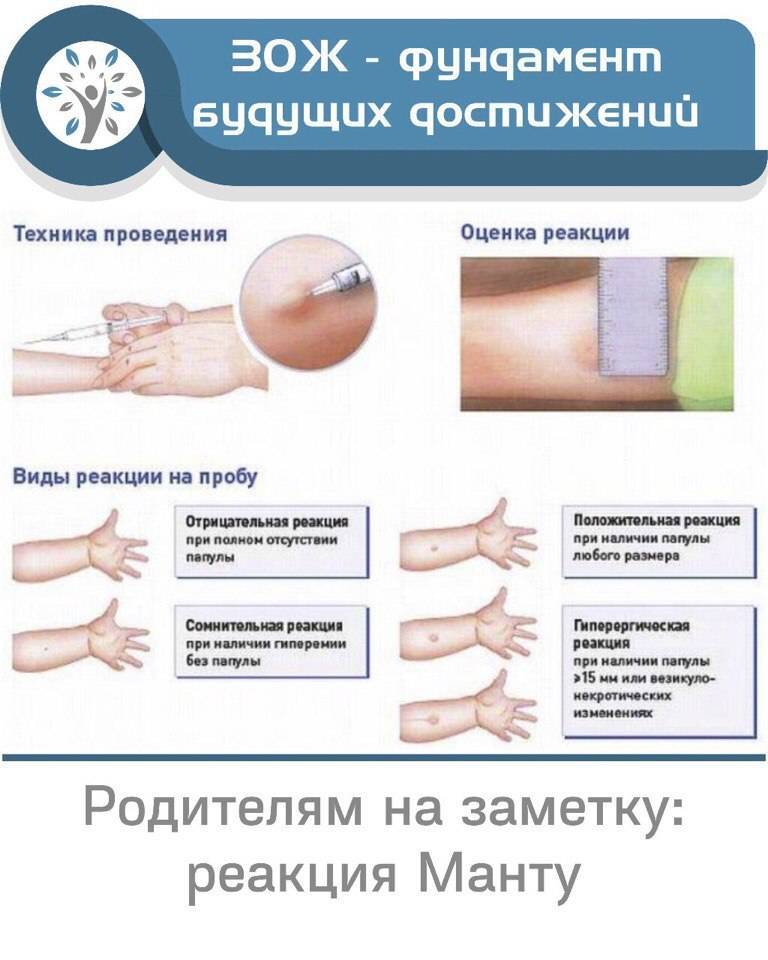 01-1 01-1 | Нидерланды / Дания | (Arend , et al. , 2008) | ||
| RV3875 | ESAT-6 | GP / HU | 0,1-1 (GP) 1 (HU) | China | (WU , et al. , 2008) | ||
| RV0934 | TPA38 | GP / HU | 3-5 | China | (He , et al.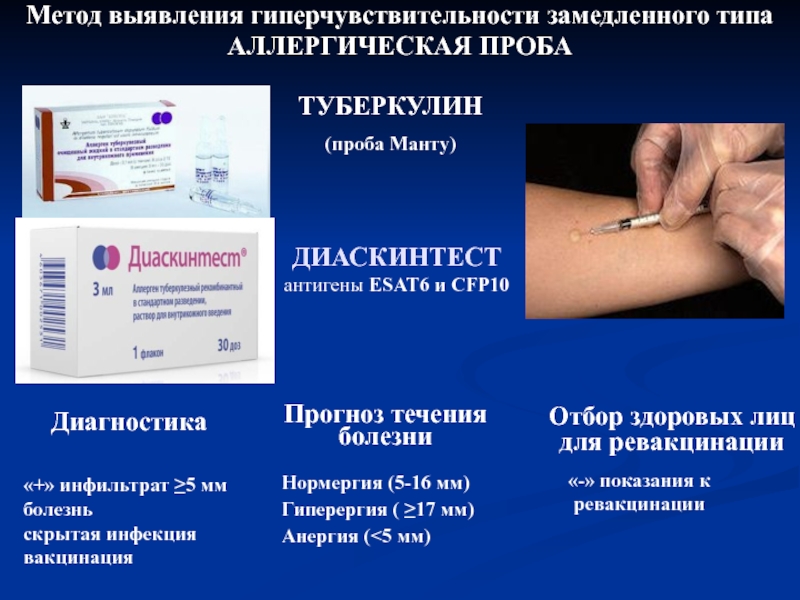 , 2007) , 2007) | ||
| Rv0350 | ДНК | ГП | 0.4 | USA | (Yang, et al. , 2011) | RV0685 | GREL2 | GP | 0.4 | USA | (Yang, et al. , 2011) |
Помимо протеомики, геномика сыграла ключевую роль в идентификации Mtb -специфических антигенов. Геномное сравнение штамма Mtb h47Rv и нескольких вакцинных штаммов M. bovis выявило 129 ORF, уникальных для Mtb , сгруппированных в 16 областях различий (RD) на хромосоме.Оценка и включение белков, кодируемых из этих областей, может играть жизненно важную роль в создании реагентов PPD следующего поколения, более специфичных к Mtb (Mustafa, 2001). Среди этих 16 RD наиболее изученным является RD1; гены, предсказанные в этом сегменте ДНК, удалены из всех вакцинных штаммов БЦЖ, в то время как они сохраняются во всех лабораторных и клинических изолятах M. bovis и Mtb , проверенных до сих пор (Mahairas , et al. , 1996).Двумя кандидатами, специфичными для комплекса Mtb и кодируемыми областью RD1, являются низкомолекулярные секретируемые белки CFP10 и ESAT-6 (Olsen , et al. , 2000, van Pinxteren , et al. , 2000, Brusasca и др. , 2001, Mustafa, 2002, Aagaard и др. , 2004).
Геномное сравнение штамма Mtb h47Rv и нескольких вакцинных штаммов M. bovis выявило 129 ORF, уникальных для Mtb , сгруппированных в 16 областях различий (RD) на хромосоме.Оценка и включение белков, кодируемых из этих областей, может играть жизненно важную роль в создании реагентов PPD следующего поколения, более специфичных к Mtb (Mustafa, 2001). Среди этих 16 RD наиболее изученным является RD1; гены, предсказанные в этом сегменте ДНК, удалены из всех вакцинных штаммов БЦЖ, в то время как они сохраняются во всех лабораторных и клинических изолятах M. bovis и Mtb , проверенных до сих пор (Mahairas , et al. , 1996).Двумя кандидатами, специфичными для комплекса Mtb и кодируемыми областью RD1, являются низкомолекулярные секретируемые белки CFP10 и ESAT-6 (Olsen , et al. , 2000, van Pinxteren , et al. , 2000, Brusasca и др. , 2001, Mustafa, 2002, Aagaard и др. , 2004).
ESAT-6 (Rv3875) и CFP10 (Rv3874), хорошо изученные Т-клеточные антигены, отсутствующие в БЦЖ, в настоящее время используются в качестве реагентов для диагностики туберкулеза с помощью анализа высвобождения гамма-интерферона (IGRA) (Mazurek, 2005).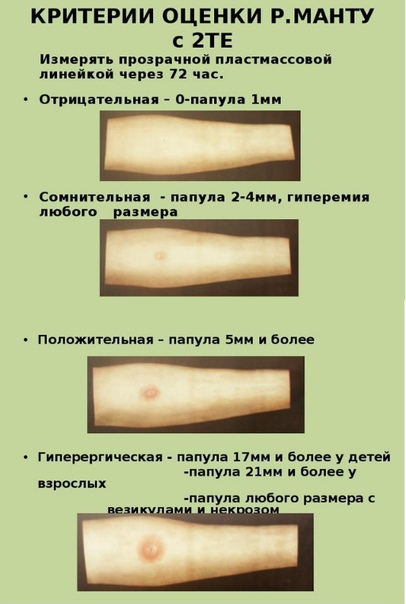 , Чанг К.С. и Леунг К.С., 2010).Рекомбинантный ESAT-6 вызывает положительный кожный ответ у инфицированных Mtb морских свинок и людей (Wu, et al. ., 2008). По сравнению с максимальным ответом DTH через 72 часа, индуцированным PPD, ответ DTH на ESAT-6 достиг пика через 24 часа (Pollock , et al. , 2003). Интересно, что комбинация ESAT-6 и CFP10 оказалась высокочувствительной и специфичной по ответу DTH (van Pinxteren , et al. , 2000). CFP10 действует как шаперон и связывается с ESAT-6 в плотном комплексе 1:1, стабилизируя его складчатую структуру (Renshaw , et al., 2002). Исследование рекомбинантного димера ESAT-6 (rdESAT-6), сверхэкспрессированного в Lactococcus lactis , показало, что он может быть успешным диагностическим средством, поскольку он отличает инфекцию Mtb от вакцинации БЦЖ и профили токсичности rdESAT-6 на нескольких животных моделях. утвердили rdESAT-6 как безопасный реагент для ТКП (Aggerbeck & Madsen, 2006).
, Чанг К.С. и Леунг К.С., 2010).Рекомбинантный ESAT-6 вызывает положительный кожный ответ у инфицированных Mtb морских свинок и людей (Wu, et al. ., 2008). По сравнению с максимальным ответом DTH через 72 часа, индуцированным PPD, ответ DTH на ESAT-6 достиг пика через 24 часа (Pollock , et al. , 2003). Интересно, что комбинация ESAT-6 и CFP10 оказалась высокочувствительной и специфичной по ответу DTH (van Pinxteren , et al. , 2000). CFP10 действует как шаперон и связывается с ESAT-6 в плотном комплексе 1:1, стабилизируя его складчатую структуру (Renshaw , et al., 2002). Исследование рекомбинантного димера ESAT-6 (rdESAT-6), сверхэкспрессированного в Lactococcus lactis , показало, что он может быть успешным диагностическим средством, поскольку он отличает инфекцию Mtb от вакцинации БЦЖ и профили токсичности rdESAT-6 на нескольких животных моделях. утвердили rdESAT-6 как безопасный реагент для ТКП (Aggerbeck & Madsen, 2006). Недавно было завершено двойное слепое рандомизированное исследование фазы I, сравнивающее rdESAT-6 и RT23 у людей. Хотя это исследование показало очень многообещающие результаты в отношении дозировки и безопасности, необходимы дальнейшие исследования, чтобы в достаточной мере продемонстрировать побочные эффекты и эффективность, а также устранить сенсибилизацию (Arend , et al., 2008). Эффективность ESAT-6 и CFP10 в отношении индукции реакций ГЗТ также является предметом споров, поскольку было показано, что они вызывают некротические реакции (Elhay , et al. , 1998).
Недавно было завершено двойное слепое рандомизированное исследование фазы I, сравнивающее rdESAT-6 и RT23 у людей. Хотя это исследование показало очень многообещающие результаты в отношении дозировки и безопасности, необходимы дальнейшие исследования, чтобы в достаточной мере продемонстрировать побочные эффекты и эффективность, а также устранить сенсибилизацию (Arend , et al., 2008). Эффективность ESAT-6 и CFP10 в отношении индукции реакций ГЗТ также является предметом споров, поскольку было показано, что они вызывают некротические реакции (Elhay , et al. , 1998).
В аналогичных исследованиях ESAT-6 сочетали со вторым белком культурального фильтрата, MPT64 (Rv1980c). Было показано, что, как и ESAT-6, рекомбинантный MPT64 вызывает ответ DTH у Mtb инфицированных морских свинок. Дальнейшие эксперименты показали, что 15 остатков между аминокислотами Gly-173 и Ala-187 являются ключевыми для вызова реакции ГЗТ (Oettinger , et al., 1995). Животные, подвергшиеся воздействию смеси ESAT-6-MPT64, показали, что эта комбинация имеет потенциал в качестве высокоспецифичного реагента (Elhay , et al.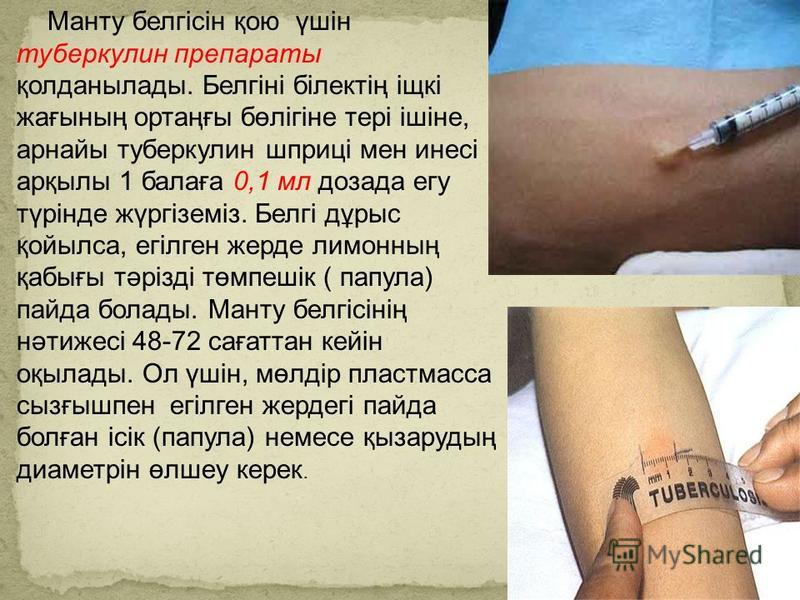 , 1998). В 2007 году сообщалось, что MPT64 находится на стадии III клинических испытаний для оценки его потенциала для замены PPD (Wang , et al. , 2007).
, 1998). В 2007 году сообщалось, что MPT64 находится на стадии III клинических испытаний для оценки его потенциала для замены PPD (Wang , et al. , 2007).
Ген Rv0061 уникален для комплекса Mtb и кодирует белок DPPD, который способен индуцировать сильную реакцию ГЗН у морских свинок, инфицированных Mtb (Coler , et al., 2000). Последующие исследования больных туберкулезом и клинически здоровых людей убедительно свидетельствуют о том, что DPPD является многообещающей альтернативой PPD (Campos-Neto , et al. , 2001, Liu , et al. , 2004). Недавнее исследование подтвердило биологическую активность очищенного рекомбинантного DPPD с использованием мононуклеарных клеток периферической крови от PPD-положительных доноров крови, что указывает на то, что DPPD можно использовать в качестве очищенного антигена для выявления туберкулеза (Kashino & Campos-Neto, 2011).
Перспективы и выводы
Несмотря на идентификацию более дюжины белков-кандидатов для включения в реагенты PPD следующего поколения и обнадеживающие предварительные данные исследований на животных и людях, создание нового реагента – одного или нескольких антигенов – для замены PPD остается испытывающий. ТКП, специфичная для выявления исключительно активного или латентного туберкулеза, могла бы принести большую пользу диагностическим и эпидемиологическим программам. Таким образом, необходимо использовать новые стратегии для обнаружения более чувствительных и специфичных антигенов кожных тестов.С другой стороны, один антиген не может эффективно заменить PPD, поскольку для оптимального реагента PPD следующего поколения может потребоваться коктейль антигенов или комбинация нескольких DTH-индуцирующих эпитопов (Oettinger , et al. , 1995). , Лященко , и др. , 1998, Родос , и др. , 2000).
ТКП, специфичная для выявления исключительно активного или латентного туберкулеза, могла бы принести большую пользу диагностическим и эпидемиологическим программам. Таким образом, необходимо использовать новые стратегии для обнаружения более чувствительных и специфичных антигенов кожных тестов.С другой стороны, один антиген не может эффективно заменить PPD, поскольку для оптимального реагента PPD следующего поколения может потребоваться коктейль антигенов или комбинация нескольких DTH-индуцирующих эпитопов (Oettinger , et al. , 1995). , Лященко , и др. , 1998, Родос , и др. , 2000).
Для достижения этой цели идентификация молекулярного состава PPD облегчает разработку более совершенного реагента. Протеомные исследования выявили высококонсервативные шапероны GroES, GroEL2 и DnaK как три наиболее доминирующих белка, которые могут объяснить положительные свойства и сниженную специфичность PPD (Borsuk , et al., 2009, Чо и др. , 2012). Наша группа недавно идентифицировала два новых препарата, DnaK/GroEL2/Rv0685 и DnaK/GroEL2/Rv0009, которые были способны индуцировать ответы DTH, эквивалентные PPD, в модели Mtb морских свинок (Yang , et al. , 2011). . Лучшее понимание реакции DTH, вызванной этими определенными белками, может способствовать открытию быстрых и чувствительных реагентов для кожных тестов следующего поколения для обнаружения инфекции Mtb .
, 2011). . Лучшее понимание реакции DTH, вызванной этими определенными белками, может способствовать открытию быстрых и чувствительных реагентов для кожных тестов следующего поколения для обнаружения инфекции Mtb .
Благодарности
Эта работа финансировалась в рамках контракта на материалы для испытаний и исследований противотуберкулезной вакцины (HHSN266200400091C) с NIH.
Сноски
Конкурирующие интересы: Не заявлено.
Этическое одобрение: Не требуется.
Ссылки
- Aagaard C, Brock I, Olsen A, Ottenhoff TH, Weldingh K, Andersen P. Картирование иммунной реактивности по отношению к Rv2653 и Rv2654: два новых низкомолекулярных антигена, обнаруженных специфически в комплексе Mycobacterium tuberculosis. J заразить Dis. 2004; 189: 812–819. [PubMed] [Google Scholar]
- Addo KK, Hof SV, Mensah GI, et al.Опрос туберкулиновых кожных проб среди ганских школьников. Общественное здравоохранение BMC.
 2010;10:35. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2010;10:35. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Aggerbeck H, Madsen SM. Безопасность ЭСАТ-6. Туберкулез (Эдинб) 2006; 86: 363–373. [PubMed] [Google Scholar]
- Аль-Абси А., Бассили А., Абдул Бари Х. и др. Снижение заболеваемости туберкулезом в Йемене: оценка на основе двух общенациональных туберкулиновых обследований. Int J Tuberc Lung Dis. 2009;13:1100–1105. [PubMed] [Google Scholar]
- Аренд С.М., Франкен В.П., Аггербек Х. и др.Двойное слепое рандомизированное исследование фазы I, сравнивающее rdESAT-6 с туберкулином в качестве реагента для кожных тестов при диагностике туберкулезной инфекции. Туберкулез (Эдинб) 2008; 88: 249–261. [PubMed] [Google Scholar]
- Bachtiar A, Miko TY, Machmud R, et al. Годовой риск заражения туберкулезом в провинции Западная Суматра, Индонезия. Int J Tuberc Lung Dis. 2008; 12: 255–261. [PubMed] [Google Scholar]
- Борген К., Костер Б., Мейер Х., Куйвенховен В., ван дер Санде М., Кобеленс Ф. Оценка крупномасштабного расследования контакта с туберкулезом в Нидерландах.
 Eur Respir J. 2008; 32: 419–425. [PubMed] [Google Scholar]
Eur Respir J. 2008; 32: 419–425. [PubMed] [Google Scholar] - Борсук С., Ньюкомб Дж., Мендум Т.А., Деллагостин О.А., Макфадден Дж. Идентификация белков из очищенного туберкулинового белкового производного (PPD) с помощью ЖХ-МС/МС. Туберкулез (Эдинб) 2009;89:423–430. [PubMed] [Google Scholar]
- Ботамли Г.Х., Кэтти Д., Клифтон-Хэдли Р., Гриффин Ф., Хьюинсон Г., Поллок Дж. Иммунодиагностика микобактериальной инфекции. Глава 10. Blackwell Science Ltd; Oxford: 1999. [Google Scholar]
- Brusasca PN, Colangeli R, Lyashchenko KP, et al.Иммунологическая характеристика антигенов, кодируемых областью RD1 генома Mycobacterium tuberculosis. Сканд Дж. Иммунол. 2001; 54: 448–452. [PubMed] [Google Scholar]
- Campos-Neto A, Rodrigues-Junior V, Pedral-Sampaio DB и др. Оценка DPPD, одного рекомбинантного белка Mycobacterium tuberculosis, в качестве альтернативного антигена для реакции Манту. Туберкулез (Эдинб) 2001;81:353–358. [PubMed] [Google Scholar]
- Чадха В.
 К., Джаганнатха П.С., Вайдьянатан П.С., Джагота П.PPD RT23 для туберкулиновых обследований в Индии. Int J Tuberc Lung Dis. 2003; 7: 172–179. [PubMed] [Google Scholar]
К., Джаганнатха П.С., Вайдьянатан П.С., Джагота П.PPD RT23 для туберкулиновых обследований в Индии. Int J Tuberc Lung Dis. 2003; 7: 172–179. [PubMed] [Google Scholar] - Chambers MA, Jahans K, Whelan A, Hughes C, Sayers R, Perkins A, Glyn Hewinson R. Простое объективное измерение кожной реакции гиперчувствительности замедленного типа на туберкулин с помощью спектрофотометрии. Технология восстановления кожи. 2002; 8: 89–93. [PubMed] [Google Scholar]
- Чо Ю.С., Добос К.М., Пренни Дж. и др. Расшифровка протеома реагента для прижизненной диагностики «очищенное белковое производное» микобактерий туберкулеза.Протеомика. 2012; 12: 979–991. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ciftci E, Ilgazli A, Gulleroglu B, Ara I, Akansel G. Ультрасонографическое измерение туберкулинового кожного теста: сравнение с ручным чтением. Infect Dis Clin Pract (Baltim Md) 2005; 13:20–23. [Google Scholar]
- Colangeli R, Spencer JS, Bifani P, et al. MTSA-10, продукт гена Rv3874 Mycobacterium tuberculosis, вызывает туберкулёзную гиперчувствительность замедленного типа у морских свинок.
 Заразить иммун.2000;68:990–993. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Заразить иммун.2000;68:990–993. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Coler RN, Skeiky YA, Ovendale PJ, et al. Клонирование гена Mycobacterium tuberculosis, кодирующего очищенный белковый производный белок, который вызывает сильную туберкулёзную специфическую гиперчувствительность замедленного типа. J заразить Dis. 2000; 182: 224–233. [PubMed] [Google Scholar]
- Comstock GW, Edwards LB, Philip RN, Winn WA. Сравнение в Соединенных Штатах Америки двух туберкулинов, Ppd-S и Rt 23. Bull World Health Organ.1964; 31: 161–170. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dye C, Scheele S, Dolin P, Pathania V, Raviglione MC. Заявление о консенсусе. Глобальное бремя туберкулеза: оценка заболеваемости, распространенности и смертности по странам. Глобальный проект ВОЗ по эпиднадзору и мониторингу. ДЖАМА. 1999; 282: 677–686. [PubMed] [Google Scholar]
- Edwards PQ, Edwads LB. История туберкулиновой пробы с эпидемиологической точки зрения. Ам преподобный Респир Дис.
 1960; 81 (1 часть 2): 1–47. [PubMed] [Google Scholar]
1960; 81 (1 часть 2): 1–47. [PubMed] [Google Scholar] - Elhay MJ, Oettinger T, Andersen P.Реакция гиперчувствительности замедленного типа на ESAT-6 и MPT64 от Mycobacterium tuberculosis у морской свинки. Заразить иммун. 1998;66:3454–3456. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Farhat M, Greenaway C, Pai M, Menzies D. Ложноположительные туберкулиновые кожные пробы: каков абсолютный эффект БЦЖ и нетуберкулезных микобактерий? Int J Tuberc Lung Dis. 2006; 10:1192–1204. [PubMed] [Google Scholar]
- Фернандес-Вильяр А., Горис А., Отеро М., Чусино Н., Васкес Р., Муньос М.Дж., Пинейро Л.Консервация очищенного белкового производного туберкулина РТ-23. Арка Бронконемол. 2004;40:301–303. [PubMed] [Google Scholar]
- Gillenwater KA, Sapp SC, Pearce K, Siberry GK. Увеличение числа конвертеров туберкулиновых кожных проб среди медицинских работников после перехода с туберсола на аплисол. Am J Infect Control. 2006; 34: 651–654. [PubMed] [Google Scholar]
- Guld J, Bentzon MW, Bleiker MA, Griep WA, Magnusson M, Waaler H.
 Стандартизация новой партии очищенного туберкулина (PPD), предназначенного для международного использования.Всемирный орган здравоохранения Быка. 1958; 19: 845–951. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Стандартизация новой партии очищенного туберкулина (PPD), предназначенного для международного использования.Всемирный орган здравоохранения Быка. 1958; 19: 845–951. [Статья бесплатно PMC] [PubMed] [Google Scholar] - Hanifa Y, Grant AD, Lewis J, Corbett EL, Fielding K, Churchyard G. Распространенность латентной туберкулезной инфекции среди золотодобытчиков в Южной Африке. Int J Tuberc Lung Dis. 2009; 13:39–46. [PubMed] [Google Scholar]
- Хансен О.Г., Линдквист К., Валер Х. Оценка эффективности туберкулина у людей и морских свинок. Всемирный орган здравоохранения Быка. 1964; 31: 171–182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Harrison DK, Abbot NC, Beck JS, McCollum PT.Предварительная оценка лазерной допплеровской визуализации перфузии кожи человека с использованием туберкулиновой реакции в качестве модели. Физиол Изм. 1993; 14: 241–252. [PubMed] [Google Scholar]
- He XY, Luo YA, Zhang XG и др. Клиническая оценка рекомбинантного белка 38 кДа Mycobacterium tuberculosis.
 Scand J Infect Dis. 2007: 1–6. [PubMed] [Google Scholar]
Scand J Infect Dis. 2007: 1–6. [PubMed] [Google Scholar] - Ho MM, Kairo SK, Corbel MJ. Иммуноанализ очищенных белковых производных туберкулина (PPD) в качестве альтернативного анализа in vitro для идентификации и подтверждения активности.Гум Вакцина. 2006; 2:29–33. [PubMed] [Google Scholar]
- Дженсен П.А., Ламберт Л.А., Ядемарко М.Ф., Ридзон Р. Руководство по предотвращению передачи микобактерий туберкулеза в медицинских учреждениях, 2005 г. MMWR Recomm Rep. 2005; 54:1–141. [PubMed] [Google Scholar]
- Кимура М., Комсток Г.В., Мори Т. Сравнение эритемы и уплотнения по результатам туберкулиновых тестов. Int J Tuberc Lung Dis. 2005; 9: 853–857. [PubMed] [Google Scholar]
- Kitaura H, Kinomoto M, Yamada T. Рибосомальный белок L7, включенный в состав очищенного белкового производного туберкулина (PPD), является основным термоустойчивым белком, вызывающим сильную гиперчувствительность замедленного типа.Сканд Дж. Иммунол. 1999; 50: 580–587. [PubMed] [Google Scholar]
- Клаузен Дж.
 , Магнуссон М., Андерсен А.Б., Кох С. Характеристика очищенного белкового производного туберкулина с использованием моноклональных антител: выделение реактивного компонента гиперчувствительности замедленного типа из культурального фильтрата M.tuberculosis. Сканд Дж. Иммунол. 1994;40:345–349. [PubMed] [Google Scholar]
, Магнуссон М., Андерсен А.Б., Кох С. Характеристика очищенного белкового производного туберкулина с использованием моноклональных антител: выделение реактивного компонента гиперчувствительности замедленного типа из культурального фильтрата M.tuberculosis. Сканд Дж. Иммунол. 1994;40:345–349. [PubMed] [Google Scholar] - Kritzinger FE, den Boon S, Verver S, et al. Отсутствие снижения годового риска заражения туберкулезом в эндемичных районах Кейптауна, Южная Африка.Троп Мед Int Health. 2009; 14:136–142. [PubMed] [Google Scholar]
- Li J, Munsiff SS, Agerton TB. Распространенность положительных результатов туберкулиновых кожных проб среди клинического населения в Нью-Йорке. J Immigr Minor Health 2008 [PubMed] [Google Scholar]
- Liu C, Flamoe E, Chen HJ, Carter D, Reed SG, Campos-Neto A. Экспрессия и очистка иммунологически реактивного DPPD, рекомбинантного антигена кожного теста Mycobacterium tuberculosis, с использованием клеток-хозяев Mycobacterium smegmatis и Escherichia coli.
 Может J Microbiol. 2004; 50:97–105. [PubMed] [Google Scholar]
Может J Microbiol. 2004; 50:97–105. [PubMed] [Google Scholar] - Лопес Л.К., Телес С.А., Соуза А.С., Рабахи М.Ф., Типпл А.Ф. Риск туберкулеза среди медсестер из Центральной Бразилии. Am J Infect Control. 2008; 36: 148–151. [PubMed] [Google Scholar]
- Лященко К., Манка С., Коланджели Р., Хейбель А., Уильямс А., Дженнаро М.Л. Использование коктейлей специфических антигенов комплекса микобактерий туберкулеза для кожных тестов, специфичных для туберкулеза. Заразить иммун. 1998;66:3606–3610. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Mackin LA.Скрининг на туберкулез в учреждениях первичной медико-санитарной помощи. Lippincotts Prim Care Pract. 1998; 2: 599–610. викторина 611–593. [PubMed] [Google Scholar]
- Maes M, Gimenez JF, D’Alessandro A, De Waard JH. Стабильность человеческого, бычьего и птичьего очищенного белкового производного туберкулина (PPD) J Infect Dev Ctries. 2011;5:781–785. [PubMed] [Google Scholar]
- Mahairas GG, Sabo PJ, Hickey MJ, Singh DC, Stover CK.
 Молекулярный анализ генетических различий между Mycobacterium bovis BCG и вирулентными M.крупный рогатый скот J Бактериол. 1996; 178:1274–1282. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Молекулярный анализ генетических различий между Mycobacterium bovis BCG и вирулентными M.крупный рогатый скот J Бактериол. 1996; 178:1274–1282. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Masucci P, McAlpine KL. Биохимические исследования бактериальных производных. X. Получение белка туберкулезной палочки человека МА-100. Proc Soc Exp Biol Med. 1930; 27: 661–663. [Google Scholar]
- Мехта С.Р., МакГрудер С., Луни Д., Джонс С., Смит Д.М. Различия в туберкулиновой реактивности, установленной в программе обследования здоровья сотрудников администрации ветеранов. Клин Вакцина Иммунол. 2009; 16: 541–543.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мустафа А.С. Биотехнология в разработке новых вакцин и диагностических реагентов против туберкулеза. Карр Фарм Биотехнолог. 2001; 2: 157–173. [PubMed] [Google Scholar]
- Мустафа А.С. Разработка новых вакцин и диагностических реагентов против туберкулеза. Мол Иммунол. 2002; 39: 113–119. [PubMed] [Google Scholar]
- Эттингер Т.
 , Холм А., Мтони И.М., Андерсен А.Б., Хаслоов К. Картирование эпитопа секретируемого белка MPT64 Mycobacterium tuberculosis, вызывающего гиперчувствительность замедленного типа.Заразить иммун. 1995;63:4613–4618. [Статья бесплатно PMC] [PubMed] [Google Scholar]
, Холм А., Мтони И.М., Андерсен А.Б., Хаслоов К. Картирование эпитопа секретируемого белка MPT64 Mycobacterium tuberculosis, вызывающего гиперчувствительность замедленного типа.Заразить иммун. 1995;63:4613–4618. [Статья бесплатно PMC] [PubMed] [Google Scholar] - Olsen AW, Hansen PR, Holm A, Andersen P. Эффективная защита от Mycobacterium tuberculosis путем вакцинации одним субдоминантным эпитопом антигена ESAT-6. Евр Дж Иммунол. 2000;30:1724–1732. [PubMed] [Google Scholar]
- Pollock JM, McNair J, Bassett H, et al. Специфические реакции гиперчувствительности замедленного типа на ESAT-6 идентифицируют крупный рогатый скот, инфицированный туберкулезом. Дж. Клин Микробиол. 2003; 41: 1856–1860.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rangel-Frausto MS, Ponce-De-Leon-Rosales S, Martinez-Abaroa C, Haslov K. Туберкулез и качество туберкулина: лучшие намерения, вводящие в заблуждение результаты. Infect Control Hosp Epidemiol. 2001; 22: 481–484. [PubMed] [Google Scholar]
- Рао В.
 Г., Гопи П.Г., Ядав Р. и др. Ежегодный риск заражения туберкулезом среди племенного населения центральной Индии. Троп Мед Int Health. 2008; 13:1372–1377. [PubMed] [Google Scholar]
Г., Гопи П.Г., Ядав Р. и др. Ежегодный риск заражения туберкулезом среди племенного населения центральной Индии. Троп Мед Int Health. 2008; 13:1372–1377. [PubMed] [Google Scholar] - Renshaw PS, Panagiotidou P, Whelan A, Gordon SV, Hewinson RG, Williamson RA, Carr MD.Убедительные доказательства того, что основные Т-клеточные антигены комплекса Mycobacterium tuberculosis ESAT-6 и CFP-10 образуют плотный комплекс 1:1, и характеристика структурных свойств ESAT-6, CFP-10 и ESAT-6* Комплекс КФП-10. Значение для патогенеза и вирулентности. Дж. Биол. Хим. 2002; 277:21598–21603. [PubMed] [Google Scholar]
- Rhodes SG, Gavier-Widen D, Buddle BM, Whelan AO, Singh M, Hewinson RG, Vordermeier HM. Антигенная специфичность при экспериментальном туберкулезе крупного рогатого скота. Заразить иммун.2000;68:2573–2578. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rowland SS, Ruckert JL, Cummings PJ. Белковые структуры с низкой молекулярной массой в фильтратах культур микобактерий и очищенных белковых производных.
 FEMS Immunol Med Microbiol. 1999; 23:21–25. [PubMed] [Google Scholar]
FEMS Immunol Med Microbiol. 1999; 23:21–25. [PubMed] [Google Scholar] - Sbarbaro JA. Антигены кожных тестов: оценка, время которой пришло. Ам преподобный Респир Дис. 1978; 118:1–5. [PubMed] [Google Scholar]
- Schiller I, Vordermeier HM, Waters WR, et al. Сравнение активности туберкулина с использованием гамма-интерферона для диагностики туберкулеза крупного рогатого скота.Ветеринар Рек. 2010; 167:322–326. [PubMed] [Google Scholar]
- Seibert FB. Выделение и свойства очищенного белкового производного туберкулина. Ам преподобный Туберк. 1934; 30: 713–720. [Google Scholar]
- Seibert FB, Glen JT. PPD-S состоял примерно из 92,1% белка, 5,9% полисахаридов и 1,2% нуклеиновой кислоты. Ам преподобный Туберк. 1941; 44: 9–24. [Google Scholar]
- Sgountzos V, Simopoulou S, Kretsou S, Sakayianni K, Pavlerou S, Gourgoulianis K, Grigorakos L. Сравнительное исследование RT23 и туберкулина Мерьё, протестированных на здоровых добровольцах.Int J Tuberc Lung Dis.
 2009; 13:312–316. [PubMed] [Google Scholar]
2009; 13:312–316. [PubMed] [Google Scholar] - Shigeto E. [Очищенные белковые производные, полученные из Mycobacterium tuberculosis (PPD) и M. intracellulare (PPD-B) в дифференциальной диагностике микобактериозов] Kekkaku. 1990; 65: 701–709. [PubMed] [Google Scholar]
- Шингадия Д., Новелли В. Туберкулиновая кожная проба: сто, а не выход? Арч Дис Чайлд. 2008; 93: 189–190. [PubMed] [Google Scholar]
- Shrestha KB, Malla P, Jha KK, Shakya TM, Akhtar M, Gunneberg C, van der Werf MJ.Первое национальное туберкулиновое обследование в Непале. Int J Tuberc Lung Dis. 2008; 12: 909–915. [PubMed] [Google Scholar]
- Teixeira L, Maciel E, Dutra ME, Perkins MD, Johnson JL, do Valle Dettoni V. Одновременное сравнение реактивности очищенного белкового производного RT-23 и туберсола у медицинских работников в Витории, Бразилия . Int J Tuberc Lung Dis. 2000;4:1074–1077. [PubMed] [Google Scholar]
- Turk JL. Фон Пирке, аллергия и инфекционные заболевания: обзор. JR Soc Med.
 1987; 80: 31–33.[PMC free article] [PubMed] [Google Scholar]
1987; 80: 31–33.[PMC free article] [PubMed] [Google Scholar] - Ulea I, Murgoci G, Popa ML, Popa L, Stavri H. Сравнительное исследование туберкулинов RT23 и IC-65, испытанных на детях с туберкулезом. Роум Арч Микробиол Иммунол. 2010;69:75–78. [PubMed] [Google Scholar]
- Ван Пинкстерен Л.А., Равн П., Аггер Э.М., Поллок Дж., Андерсен П. Диагностика туберкулеза на основе двух специфических антигенов ESAT-6 и CFP10. Клин Диагн Лаб Иммунол. 2000;7:155–160. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Vashishtha VM, John TJ.Распространенность инфекции Mycobacterium tuberculosis у детей в Западном Уттар-Прадеше. Индийский педиатр. 2010;47:97–100. [PubMed] [Google Scholar]
- Villarino ME, Burman W, Wang YC, et al. Сопоставимая специфичность двух коммерческих туберкулиновых реагентов у лиц с низким риском туберкулезной инфекции. ДЖАМА. 1999; 281:169–171. [PubMed] [Google Scholar]
- Villarino ME, Brennan MJ, Nolan CM, et al. Сравнительное тестирование действующих (PPD-S1) и предложенных (PPD-S2) эталонных стандартов туберкулина.
 Am J Respir Crit Care Med. 2000; 161:1167–1171. [PubMed] [Google Scholar]
Am J Respir Crit Care Med. 2000; 161:1167–1171. [PubMed] [Google Scholar] - Wang Z, Potter BM, Gray AM, Sacksteder KA, Geisbrecht BV, Laity JH. Структура раствора антигена MPT64 Mycobacterium tuberculosis определяет новое семейство белков бета-захвата. Дж Мол Биол. 2007; 366: 375–381. [PubMed] [Google Scholar]
- ВОЗ. Доклад Всемирной организации здравоохранения за 2011 г. 2011 г. Глобальная борьба с туберкулезом. [Google Scholar]
- Wu X, Zhang L, Zhang J, Zhang C, Zhu L, Shi Y. Рекомбинантный белок-мишень 6 раннего секретируемого антигена в качестве антигена кожного теста для специфического выявления инфекции Mycobacterium tuberculosis.Клин Эксп Иммунол. 2008; 152:81–87. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Yang HL, Troudt J, Grover A, et al. Три белковых коктейля опосредуют ответы ГЗТ, неотличимые от PPD в модели Mycobacterium tuberculosis на морских свинках. Infect Immun 2011 [бесплатная статья PMC] [PubMed] [Google Scholar]
Очищенные белковые производные туберкулина
FEMS Immunol Med Microbiol. Авторская рукопись; Доступен в PMC 2013 декабря 1.
Авторская рукопись; Доступен в PMC 2013 декабря 1.
Опубликовано в окончательной редактированной форме AS:
PMCID: PMC34
NIHMSID: NIHMMS3
Государственный университет Колорадо, Департамент микробиологии, иммунологии и патологии, Форт-Коллинз, Colorado 80523
* Автор, ответственный за переписку: Карен М.Добос, почтовый адрес: 1682 Campus Delivery, кафедра микробиологии, иммунологии и патологии; Университет штата Колорадо, Форт. Collins, CO 80523-1682, тел.: 970-491-6549, [email protected] См. другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Туберкулиновая кожная проба, которая включает мониторинг иммунной реакции на инъекцию очищенного производного белка (PPD), была наиболее широко используемым методом для выявления инфекции Mycobacterium tuberculosis с момента ее разработки в 1930-х годах.До недавнего времени молекулярный состав PPD был неизвестен. Это помешало открытию улучшенных реагентов для кожных тестов и резко затруднило усилия по определению механизма действия. Протеомная оценка PPD в сочетании с подробным анализом на модели туберкулеза морской свинки привела к дальнейшему определению молекулярного состава PPD. В этом сообщении рассматривается история и текущее состояние PPD, в дополнение к описанию реагентов-кандидатов PPD следующего поколения, основанных на использовании отдельного белка или белковых коктейлей.
Протеомная оценка PPD в сочетании с подробным анализом на модели туберкулеза морской свинки привела к дальнейшему определению молекулярного состава PPD. В этом сообщении рассматривается история и текущее состояние PPD, в дополнение к описанию реагентов-кандидатов PPD следующего поколения, основанных на использовании отдельного белка или белковых коктейлей.
Ключевые слова: Туберкулез, Очищенный белковый производный, Туберкулиновая кожная проба, Диагностика причем большинство этих трагических событий произошло в развивающихся странах (ВОЗ, 2011 г.). Его тяжесть усугубляется способностью Mycobacterium tuberculosis ( Mtb ), возбудителя туберкулеза, сохраняться в виде персистирующей бессимптомной инфекции, называемой латентной туберкулезной инфекцией (ЛТБИ).В течение почти столетия лица, инфицированные Mtb , выявлялись с помощью туберкулиновой кожной пробы (ТКП). В 1890 году Роберт Кох предположил, что глицериновый экстракт туберкулезных бацилл может как лечить, так и предотвращать туберкулез. Хотя «Старый туберкулин» Коха в конечном итоге потерпел неудачу в качестве терапии, его открытия стали катализатором разработки современной ТКП, наиболее важного инструмента для выявления потенциальных случаев ТБ на сегодняшний день (Shingadia & Novelli, 2008).
Хотя «Старый туберкулин» Коха в конечном итоге потерпел неудачу в качестве терапии, его открытия стали катализатором разработки современной ТКП, наиболее важного инструмента для выявления потенциальных случаев ТБ на сегодняшний день (Shingadia & Novelli, 2008).
ТКП также известна как проба Манту в честь французского врача Шарля Манту (1877–1947), который установил диагностические критерии для чтения ТКП.Метод Манту, одобренный Американским торакальным обществом и Центрами по контролю и профилактике заболеваний (CDC), в настоящее время является золотым стандартом для определения того, инфицирован ли человек Mtb. Этот иммунологический тест состоит из двух частей. Сначала реагент очищенного производного белка (PPD) вводят внутрикожно в предплечье. Во-вторых, реакцию гиперчувствительности замедленного типа (ГЗТ) отслеживают через 48-72 часа после инъекции путем измерения диаметра уплотнения (отека из-за воспаления) в миллиметрах в месте инъекции.Обычным явлением является визуализация эритемы (покраснения) в течение первых 24 часов после введения PPD; это не следует измерять, так как это не указывает на инфекцию. Проведение и чтение результатов этого теста должны выполняться обученными медицинскими работниками, которые могут интерпретировать факторы риска наряду с измерением при определении положительной реакции (Mackin, 1998).
Проведение и чтение результатов этого теста должны выполняться обученными медицинскими работниками, которые могут интерпретировать факторы риска наряду с измерением при определении положительной реакции (Mackin, 1998).
Помимо своей роли индикатора инфекции Mtb , ТКП также используется в качестве эпидемиологического инструмента для оценки распространенности латентной туберкулезной инфекции (ЛТБИ).Прогноз о том, что одна треть населения мира инфицирована Mtb , частично основан на частоте положительной ТКП (Dye , et al. , 1999).
В текущем обзоре мы представляем обзор истории, развития и текущего использования PPD. Кроме того, будут рассмотрены исследования, направленные на определение ключевых молекулярных компонентов PPD и его биологической активности.
Прошлое и настоящее использование PPD
Первая кожная туберкулиновая проба была введена в 1907 г. фон Пирке (1874–1929), австрийским ученым и педиатром (Turk, 1987).В его исследовании использовалась ОТ Коха, нагретый бульон, состоящий из неочищенной неопределенной смеси белков и других макромолекул, полученных из туберкулезной палочки. OT Коха готовили из концентрированного фильтрата глицерино-пептонного бульона, в котором Mtb росли в течение 6–8 недель. OT Koch и аналогичные продукты не используются в качестве реагентов для ТКП в США из-за недостаточной чистоты, различий в эффективности и специфичности, а также из-за недостаточной стандартизации.
OT Коха готовили из концентрированного фильтрата глицерино-пептонного бульона, в котором Mtb росли в течение 6–8 недель. OT Koch и аналогичные продукты не используются в качестве реагентов для ТКП в США из-за недостаточной чистоты, различий в эффективности и специфичности, а также из-за недостаточной стандартизации.
В 1930 г. из фильтрата культуры Mtb был получен альтернативный состав, известный как MA-100, в виде состава, не содержащего полисахаридов (Masucci & McAlpine, 1930).Было обнаружено, что МА-100 значительно более эффективен, чем ОТ Коха; однако его использование в качестве стандартного диагностического реагента было ограничено — в основном из-за сенсибилизирующего действия, наблюдаемого при повторных инъекциях в кожу.
В 1934 году Флоренс Б. Зайберт (1897–1991), биохимик из Института Генри Фиппса Пенсильванского университета, разработала более стабильный и последовательный препарат (Seibert, 1934). Первоначально обозначенный по способу его производства, SOTT, аббревиатура от «синтетический средний осадок туберкулина трихлоруксусной кислоты», этот продукт позже был назван очищенным белковым производным или PPD. Его получали пропариванием культур Mtb в стерилизаторе Arnold и очисткой белков повторным осаждением сульфатом аммония (Seibert & Glen, 1941). По сравнению с предыдущими туберкулиновыми реагентами, в этом методе приготовления PPD было значительно снижено содержание полисахаридов, нуклеиновых кислот и липидов, и, таким образом, это был реагент, богатый белком. В 1944 году большая партия этого улучшенного PPD (партия 49608), переименованного в PPD-S (PPD-Standard), была предоставлена в качестве эталонного продукта в Соединенных Штатах.PPD-S состоял примерно из 92,9% белка, 5,9% полисахаридов и 1,2% нуклеиновой кислоты (Seibert & Glen, 1941). Из-за повышенной чистоты и активности PPD-S был принят Всемирной организацией здравоохранения (ВОЗ) в качестве международного стандарта туберкулина в 1952 г. (Guld , et al. , 1958). С 1978 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) потребовало, чтобы все партии PPD были квалифицированы биологическим анализом и должны демонстрировать активность, эквивалентную активности PPD-S (Sbarbaro, 1978).
Его получали пропариванием культур Mtb в стерилизаторе Arnold и очисткой белков повторным осаждением сульфатом аммония (Seibert & Glen, 1941). По сравнению с предыдущими туберкулиновыми реагентами, в этом методе приготовления PPD было значительно снижено содержание полисахаридов, нуклеиновых кислот и липидов, и, таким образом, это был реагент, богатый белком. В 1944 году большая партия этого улучшенного PPD (партия 49608), переименованного в PPD-S (PPD-Standard), была предоставлена в качестве эталонного продукта в Соединенных Штатах.PPD-S состоял примерно из 92,9% белка, 5,9% полисахаридов и 1,2% нуклеиновой кислоты (Seibert & Glen, 1941). Из-за повышенной чистоты и активности PPD-S был принят Всемирной организацией здравоохранения (ВОЗ) в качестве международного стандарта туберкулина в 1952 г. (Guld , et al. , 1958). С 1978 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) потребовало, чтобы все партии PPD были квалифицированы биологическим анализом и должны демонстрировать активность, эквивалентную активности PPD-S (Sbarbaro, 1978). Международная единица (МЕ) для PPD была определена как часть этого эффекта; одна МЕ равна биологической активности, содержащейся в 0.028 мкг PPD-S (0,02 мкг PPD с 0,008 мкг солей). Однако в США и Канаде эффективность PPD выражается в туберкулиновых единицах (TU), а не в IU. Одна TU определяется как 0,02 мкг PPD-S (Edwards & Edwads, 1960). Пять ТЕ являются стандартной дозой для внутрикожного диагностического применения, как определено в эпидемиологических исследованиях (Bothamley, и др., , 1999).
Международная единица (МЕ) для PPD была определена как часть этого эффекта; одна МЕ равна биологической активности, содержащейся в 0.028 мкг PPD-S (0,02 мкг PPD с 0,008 мкг солей). Однако в США и Канаде эффективность PPD выражается в туберкулиновых единицах (TU), а не в IU. Одна TU определяется как 0,02 мкг PPD-S (Edwards & Edwads, 1960). Пять ТЕ являются стандартной дозой для внутрикожного диагностического применения, как определено в эпидемиологических исследованиях (Bothamley, и др., , 1999).
PPD-S2, текущий стандарт США на туберкулин PPD, был разработан в ожидании возможного истощения PPD-S (Villarino, et al ., 2000). В настоящее время Aplisol ® (JHP Pharmaceuticals, Inc, Рочестер, Мичиган) и Tubersol ® (Sanofi Pasteur Limited, Swiftwater, PA) являются двумя широко используемыми коммерчески доступными продуктами PPD-S2 (Jensen, et al. ). , 2005). Результаты кожных испытаний с Aplisol ® и Tubersol ® вполне сравнимы с результатами оригинального стандарта PPD, PPD-S (Villarino, et al.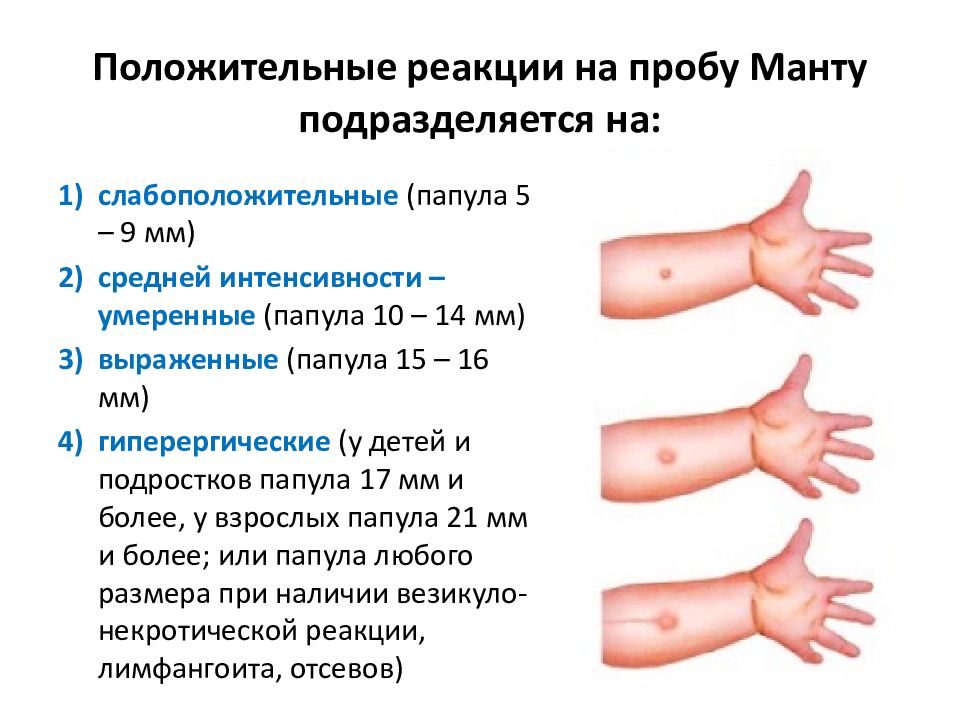 ., 1999). Однако переход от Tubersol ® к Aplisol ® или наоборот привел к отклонениям в кожных тестах, хотя точная причина до сих пор неясна (Gillenwater, et al ., 2006, Мехта, и др. , 2009).
., 1999). Однако переход от Tubersol ® к Aplisol ® или наоборот привел к отклонениям в кожных тестах, хотя точная причина до сих пор неясна (Gillenwater, et al ., 2006, Мехта, и др. , 2009).
Помимо PPD-S, за пределами США и Канады используется несколько других составов PPD (Li , et al. , 2008). Некоторые из этих туберкулиновых продуктов, включая PPD RT23, производятся Государственным институтом сывороток (SSI) (Comstock, и др., , 1964). В настоящее время ВОЗ и Международный союз по борьбе с туберкулезом и заболеваниями легких (IUATLD) рекомендуют 2 ТЕ PPD-RT23 с твином 80. RT23 является наиболее широко используемым продуктом PPD во всем мире (Rangel-Frausto, и др. ., 2001). Несколько исследований по всему миру использовали PPD RT23 для оценки распространенности инфекции туберкулезной палочкой, включая Индию (Rao , et al. , 2008), (Vashishtha & John, 2010), Гану (Addo , et al. 2010), Йемен (Аль-Абси, и др. , 2009), Южная Африка (Критцингер, и др. , 2009) (Ханифа, и др. , 2009), Непал (Шреста, et , 2008), Бразилии (Lopes, и др. , 2008) и Индонезии (Bachtiar, и др. )., 2008). Кроме того, он также использовался для оценки крупномасштабных контактов с больными туберкулезом в Нидерландах (Borgen, et al. , 2008).
, 2009), Южная Африка (Критцингер, и др. , 2009) (Ханифа, и др. , 2009), Непал (Шреста, et , 2008), Бразилии (Lopes, и др. , 2008) и Индонезии (Bachtiar, и др. )., 2008). Кроме того, он также использовался для оценки крупномасштабных контактов с больными туберкулезом в Нидерландах (Borgen, et al. , 2008).
В дополнение к вышеупомянутым продуктам PPD также используются другие варианты PPD, такие как PPD RT23 Mexico (Laboratorio Nacional de Salud, Secretaria de Salud, Мехико, Мексика), продукт PPD, используемый в Латинской Америке (Rangel-Frausto , и др. , 2001), и японский продукт PPD-s. (Кимура, и др., 2005 ). Многочисленные продукты PPD, используемые в настоящее время, перечислены в .
Таблица 1
Препараты PPD, которые в настоящее время используются у людей
 , 1999)
, 1999)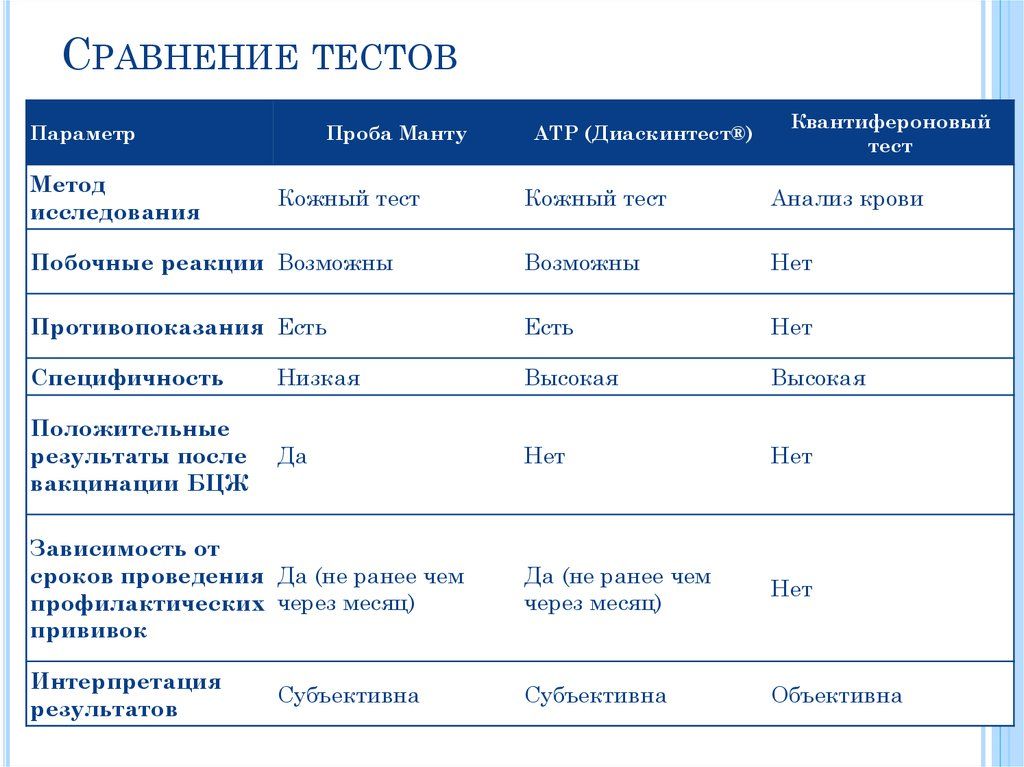 , 2001)
, 2001) 2010)
2010)Так как есть несколько производителей PPD важно оценить различия в эффективности этих продуктов PPD.Из-за ограниченных знаний о точном составе каждого продукта PPD невозможно использовать традиционные методы контроля качества для сравнения препаратов PPD. Поэтому сравнения с использованием животных, инфицированных микобактериями, проводятся для оценки биологической активности продуктов PPD. При этом продукты PPD должны вводиться в тех же условиях, в которых они будут использоваться в клинических условиях (Hansen , et al. , 1964).
Первое опубликованное сравнение эффективности PPD было проведено между PPD-S и PPD-RT23.Исследование, проведенное среди 6 групп населения в США, включая детей-эскимосов, больных туберкулезом и новобранцев в учебных центрах ВМС США, показало, что 2,5 ТЕ PPD-RT23, содержащего твин 80, обладают эффективностью, аналогичной 5 ТЕ PPD-S. (Комсток , и др. , 1964). Совсем недавно исследование 69 больных туберкулезом и 1189 субъектов с низким риском в США сравнило PPD-S2 с PPD-S1.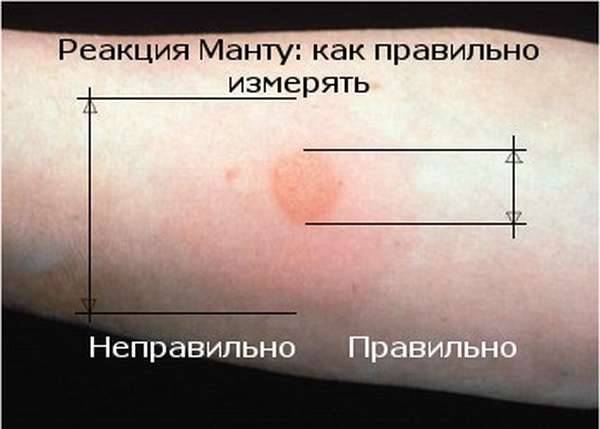 Было обнаружено, что эти два продукта статистически неразличимы у больных туберкулезом. Кроме того, такая же высокая специфичность наблюдалась среди субъектов с низким риском.Это исследование показало, что PPD-S2 функционально эквивалентен PPD-S1 и может легко заменить его (Villarino , et al. , 2000). Многочисленные исследования сравнивали активность RT23, приготовленного в SSI, с другими источниками PPD, включая IC-65, и среди них была обнаружена эквивалентная эффективность (Ulea , et al. 2010), (Chadha , et al. , 2003), (Шиллер и др. 2010). Однако аналогичное исследование в Мексике сравнило эффективность местного производства PPD RT23 (Мексика), Tubersol ® и PPD RT23 (SSI) и выявило, что из трех RT23 (Мексика) имел гораздо более низкую чувствительность (Rangel- Фраусто и др., 2001). RT23 и туберкулин Merieux (разработанный в Pasteur-Merieux) также недавно сравнивали по их относительной активности. Оба препарата были получены из нескольких штаммов микобактерий (RT23 был получен из семи штаммов Mtb , Merieux был получен из трех штаммов Mtb, плюс M.
Было обнаружено, что эти два продукта статистически неразличимы у больных туберкулезом. Кроме того, такая же высокая специфичность наблюдалась среди субъектов с низким риском.Это исследование показало, что PPD-S2 функционально эквивалентен PPD-S1 и может легко заменить его (Villarino , et al. , 2000). Многочисленные исследования сравнивали активность RT23, приготовленного в SSI, с другими источниками PPD, включая IC-65, и среди них была обнаружена эквивалентная эффективность (Ulea , et al. 2010), (Chadha , et al. , 2003), (Шиллер и др. 2010). Однако аналогичное исследование в Мексике сравнило эффективность местного производства PPD RT23 (Мексика), Tubersol ® и PPD RT23 (SSI) и выявило, что из трех RT23 (Мексика) имел гораздо более низкую чувствительность (Rangel- Фраусто и др., 2001). RT23 и туберкулин Merieux (разработанный в Pasteur-Merieux) также недавно сравнивали по их относительной активности. Оба препарата были получены из нескольких штаммов микобактерий (RT23 был получен из семи штаммов Mtb , Merieux был получен из трех штаммов Mtb, плюс M. bovis ) и, по-видимому, обладают биологической активностью, эквивалентной PPD-S. , который является продуктом одного штамма. Однако RT23 часто вызывает более сильную антигенную реакцию, чем препарат Мерье (Sgountzos, et al., 2009). Недавно Schiller et al. сравнили диагностическую надежность PPD из разных источников с помощью инновационного подхода к мониторингу ответов интерферона-γ в культурах цельной крови (Schiller , et al. 2010). В этом исследовании образцы цельной крови стимулировали несколькими различными туберкулинами, и через 24 часа после стимуляции отслеживали реакцию IFN-γ. Их результаты подтверждают, что существуют значительные различия между депрессорами из разных источников, и указывают на необходимость дальнейшей стандартизации продуктов депрессоров.Была введена количественная шкала, обозначенная как RP30 (относительная активность 30), определяемая как концентрация белка, при которой конкретный препарат PPD имеет 30% максимальной активности. RP30 можно использовать в качестве инструмента для быстрого сравнения биологической активности партий и источников PPD.
bovis ) и, по-видимому, обладают биологической активностью, эквивалентной PPD-S. , который является продуктом одного штамма. Однако RT23 часто вызывает более сильную антигенную реакцию, чем препарат Мерье (Sgountzos, et al., 2009). Недавно Schiller et al. сравнили диагностическую надежность PPD из разных источников с помощью инновационного подхода к мониторингу ответов интерферона-γ в культурах цельной крови (Schiller , et al. 2010). В этом исследовании образцы цельной крови стимулировали несколькими различными туберкулинами, и через 24 часа после стимуляции отслеживали реакцию IFN-γ. Их результаты подтверждают, что существуют значительные различия между депрессорами из разных источников, и указывают на необходимость дальнейшей стандартизации продуктов депрессоров.Была введена количественная шкала, обозначенная как RP30 (относительная активность 30), определяемая как концентрация белка, при которой конкретный препарат PPD имеет 30% максимальной активности. RP30 можно использовать в качестве инструмента для быстрого сравнения биологической активности партий и источников PPD.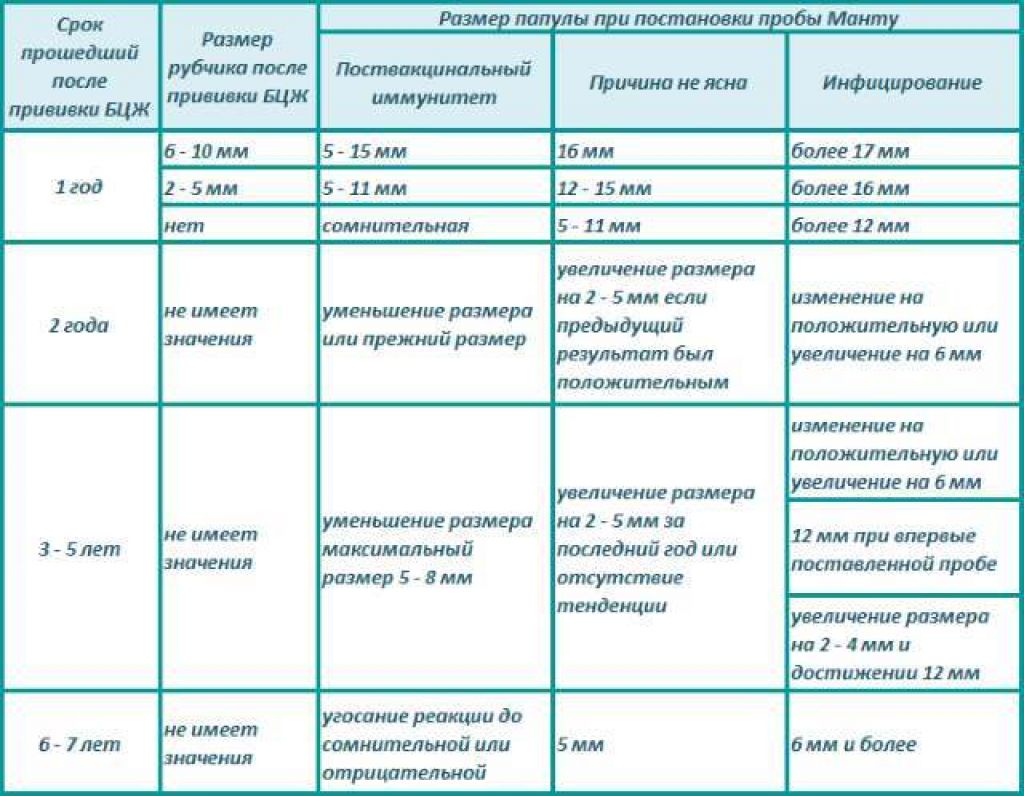 Хотя в этих отчетах подчеркивается важность оценки биологической активности продуктов PPD из разных источников, расхождения в эффективности трудно объяснить из-за сложности и неоднозначности молекулярного состава PPD.Протеомная характеристика PPD была описана нашей лабораторией (Cho, et al. , 2012) и другими (Borsuk , et al. , 2009), демонстрируя, что PPD состоит из сотен различных белков. Дополнительный сравнительный протеомный, биологический и гистологический анализы использовались для измерения относительных различий в молекулярном составе и биологической активности между PPD-S2, RT23 и PPD-KIT (PPD Корейского технологического института) (Cho, et al ., 2012). Это исследование продемонстрировало, что, хотя все 3 препарата PPD были неразличимы по своей способности индуцировать ответ ГЗТ, были очевидны гистологические различия и различия в относительном количестве нескольких белков, включая членов семейства белков Esx, что позволяет предположить корреляцию между повышенной гистопатологией и повышенная концентрация белков Esx в PPD (Cho, et al .
Хотя в этих отчетах подчеркивается важность оценки биологической активности продуктов PPD из разных источников, расхождения в эффективности трудно объяснить из-за сложности и неоднозначности молекулярного состава PPD.Протеомная характеристика PPD была описана нашей лабораторией (Cho, et al. , 2012) и другими (Borsuk , et al. , 2009), демонстрируя, что PPD состоит из сотен различных белков. Дополнительный сравнительный протеомный, биологический и гистологический анализы использовались для измерения относительных различий в молекулярном составе и биологической активности между PPD-S2, RT23 и PPD-KIT (PPD Корейского технологического института) (Cho, et al ., 2012). Это исследование продемонстрировало, что, хотя все 3 препарата PPD были неразличимы по своей способности индуцировать ответ ГЗТ, были очевидны гистологические различия и различия в относительном количестве нескольких белков, включая членов семейства белков Esx, что позволяет предположить корреляцию между повышенной гистопатологией и повышенная концентрация белков Esx в PPD (Cho, et al . , 2012). В совокупности все эти сравнительные отчеты иллюстрируют сложность PPD и проблемы, связанные с созданием стандартизированного реагента.
, 2012). В совокупности все эти сравнительные отчеты иллюстрируют сложность PPD и проблемы, связанные с созданием стандартизированного реагента.
Подводные камни PPD
Несмотря на то, что в прошлом столетии ТКП была стандартом для выявления лиц, подверженных риску активного ТБ, она имеет несколько фундаментальных недостатков, которые служат стимулом для разработки более стандартизированной методологии и более эффективных инструментов для выявления ЛТБИ. Основной проблемой текущего теста является высокий уровень ложноположительных результатов, вызванный неспособностью TST отличить инфекцию Mtb от воздействия нетуберкулезных микобактерий или вакцинации M.bovis Bacille Calmett-Guérin (BCG) (Huebner, и др. , 1993). Оба случая ложноположительных ответов обычно приписывают иммунному ответу, запускаемому гомологичными антигенами либо при вакцинации БЦЖ, либо от микобактерий из окружающей среды (Harboe, 1981, Huebner, и др., , 1993). Эти предположения были недавно подтверждены молекулярным анализом PPD, показывающим, что четыре белка теплового шока (GroEl, GroEs, DnaK и HspX) составляют примерно 60% протеомного содержания PPD (Cho, et al . , 2012, Борсук и др. , 2009). Эти белки-шапероны обладают высокой гомологией (более 70%) и консервативны среди большинства видов микобактерий (Cho, et al., , 2012, Borsuk, , et al., , 2009). Это усложняет использование ТКП в качестве инструмента как для эпидемиологических исследований, так и для выявления лиц, инфицированных Mtb , из-за потенциальной перекрестной реактивности при вакцинации БЦЖ или заражении нетуберкулезными микобактериями. Ложноотрицательные результаты также проблематичны, особенно у детей и лиц с ослабленным иммунитетом (Farhat, и др., )., 2006 г., Шингадия и Новелли, 2008 г.). Это связано с тем, что положительный PPD требует эффективного ответа DTH. Поэтому вполне вероятно, что PPD не может служить индикатором инфекции Mtb в тех популяциях, где отсутствует надежный Т-клеточный иммунитет. Наконец, хотя ТКП можно использовать для выявления ЛТБИ, он не позволяет провести различие между этим заболеванием, активным заболеванием или выздоравливающим пациентом.
, 2012, Борсук и др. , 2009). Эти белки-шапероны обладают высокой гомологией (более 70%) и консервативны среди большинства видов микобактерий (Cho, et al., , 2012, Borsuk, , et al., , 2009). Это усложняет использование ТКП в качестве инструмента как для эпидемиологических исследований, так и для выявления лиц, инфицированных Mtb , из-за потенциальной перекрестной реактивности при вакцинации БЦЖ или заражении нетуберкулезными микобактериями. Ложноотрицательные результаты также проблематичны, особенно у детей и лиц с ослабленным иммунитетом (Farhat, и др., )., 2006 г., Шингадия и Новелли, 2008 г.). Это связано с тем, что положительный PPD требует эффективного ответа DTH. Поэтому вполне вероятно, что PPD не может служить индикатором инфекции Mtb в тех популяциях, где отсутствует надежный Т-клеточный иммунитет. Наконец, хотя ТКП можно использовать для выявления ЛТБИ, он не позволяет провести различие между этим заболеванием, активным заболеванием или выздоравливающим пациентом.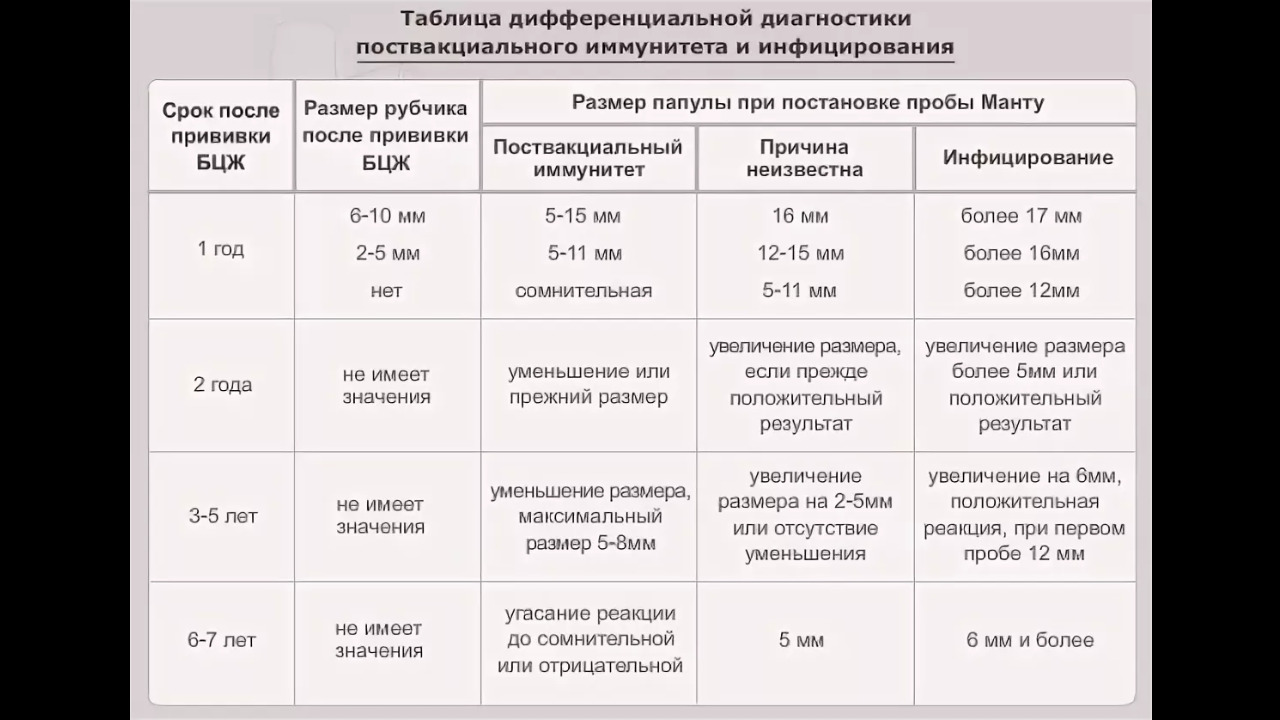 Несмотря на эти подводные камни, TST остается наиболее часто используемым инструментом для обнаружения инфекции Mtb .
Несмотря на эти подводные камни, TST остается наиболее часто используемым инструментом для обнаружения инфекции Mtb .
Будущее PPD – открытие и разработка PPD следующего поколения
Разработка новых и более эффективных реагентов для выявления ЛТБИ является ключом к успеху в борьбе с туберкулезом. Улучшенное обнаружение латентных бацилл приведет к стратегиям раннего вмешательства и, вероятно, снизит заболеваемость и разорвет цикл передачи болезни.
Не следует упускать из виду усовершенствование существующих реагентов ТКП, поскольку мы движемся к цели создания новых реагентов для обнаружения ЛТБИ; однако стоит отметить, что метод количественной оценки иммунного ответа весьма субъективен.Вместо измерения диаметра уплотнений в миллиметрах тестируется несколько новых методов. К ним относятся: лазерная допплеровская визуализация у людей (Harrison, et al. , 1993), использование ручного спектрофотометра для измерения реакции ГЗТ (Chambers, et al. , 2002) и ультразвуковое исследование у пациентов ( Ciftci и др. , 2005). Эти альтернативные методы могут применяться для объективного количественного определения TST и могут преодолевать ограничения обычного способа измерения; однако следует учитывать возможность использования дорогостоящих технологий в регионах с ограниченными ресурсами.
, 2002) и ультразвуковое исследование у пациентов ( Ciftci и др. , 2005). Эти альтернативные методы могут применяться для объективного количественного определения TST и могут преодолевать ограничения обычного способа измерения; однако следует учитывать возможность использования дорогостоящих технологий в регионах с ограниченными ресурсами.
В дополнение к улучшению метода измерения для улучшения стандартизации теста, можно улучшить фактический состав депрессора. Определение молекулярного состава PPD в течение многих лет было серьезным препятствием. Длительное нагревание сырого туберкулина для приготовления PPD способствовало денатурации, частичной деградации и агрегации многих белковых компонентов. Многочисленные исследования идентифицировали PPD как смесь очень гетерогенных белков размером от очень больших агрегатов до очень маленьких деградировавших молекул (Klausen, et al ., 1994, Rowland, et al. ., 1999, Ho, et al. , 2006). Точно так же мало было известно о том, какой из этих компонентов в PPD отвечает за реакцию DTH. С недавней идентификацией более ста белков из четырех различных PPD с помощью масс-спектрометрии (Borsuk , et al. , 2009, Cho , et al. , 2012) можно применять новые подходы для определения того, какие из этих компонентов незаконный ответ DTH.
С недавней идентификацией более ста белков из четырех различных PPD с помощью масс-спектрометрии (Borsuk , et al. , 2009, Cho , et al. , 2012) можно применять новые подходы для определения того, какие из этих компонентов незаконный ответ DTH.
Почти за два десятилетия до публикации молекулярного состава PPD были проведены многочисленные исследования отдельных белков для проверки их способности индуцировать реакцию ГЗТ (Klausen , et al., 1994). Такие исследования по-прежнему имеют решающее значение для оптимизации PPD и понимания того, как он модулирует иммунную систему. Антигены, тестируемые в качестве будущих реагентов PPD, приведены в .
Таблица 2
Антигены в настоящее время под оценкой как следующее поколение PPD кандидаты
| Gene Number | Antigen | Animals | Дозировка (мкг) | Страна | Ссылка | ||
|---|---|---|---|---|---|---|---|
| Rv1980c | МПТ 64 | ГП | 0. 1 1 | Denmark | (Oettinger , et al. , 1995) | ||
| RV3875 / RV1980C | ESAT-6 / MPT 64 | GP | 1 | Denmark | (ELHAY , et al. , 1998) | ||
| RV0652 | RV0652 | Рибосомальный белок L7 / L12 | GP | 0.2 | Япония | (Kitaura , et al. , 1999) , 1999) | |
| RV0061 | DPPD | GP / Hu | 2 (GP) | USA | (Coler , et al., 2000) | ||
| RV3874 | CFP10 | GP | GP | 2 | USA | (Colangeli , et al. , 2000) | |
| RV3875 / RV3874 | ESAT-6 / CFP10 | GP / CA | 1 (GP) 2 (CA) | UK | (Van Pinxteren , et al. , 2000) , 2000) | ||
| RV3875 | ESAT-6 | CA | 25-400 | 25-400 | Дания | (Pollock , et al., 2003) | |
| RV0061 | |||||||
| DPPD | HU | Hu | 0.2-5 | США | (Campos-Neto , et al. , 2001) , 2001) | ||
| RV0061 | DPPD | GP | 5 | USA | (Liu , et al. , 2004) | , 2004)||
| RV3875 | ESAT-6 | GP | GP | 0.01-1 | Дания | (Aggerbeck & Madsen, 2006) | |
| Rv3875 | ESAT-6 | Ху | 0. 01-1 01-1 | Нидерланды / Дания | (Arend , et al. , 2008) | ||
| RV3875 | ESAT-6 | GP / HU | 0,1-1 (GP) 1 (HU) | China | (WU , et al. , 2008) | ||
| RV0934 | TPA38 | GP / HU | 3-5 | China | (He , et al. , 2007) , 2007) | ||
| Rv0350 | ДНК | ГП | 0.4 | USA | (Yang, et al. , 2011) | RV0685 | GREL2 | GP | 0.4 | USA | (Yang, et al. , 2011) |
Помимо протеомики, геномика сыграла ключевую роль в идентификации Mtb -специфических антигенов. Геномное сравнение штамма Mtb h47Rv и нескольких вакцинных штаммов M. bovis выявило 129 ORF, уникальных для Mtb , сгруппированных в 16 областях различий (RD) на хромосоме.Оценка и включение белков, кодируемых из этих областей, может играть жизненно важную роль в создании реагентов PPD следующего поколения, более специфичных к Mtb (Mustafa, 2001). Среди этих 16 RD наиболее изученным является RD1; гены, предсказанные в этом сегменте ДНК, удалены из всех вакцинных штаммов БЦЖ, в то время как они сохраняются во всех лабораторных и клинических изолятах M. bovis и Mtb , проверенных до сих пор (Mahairas , et al. , 1996).Двумя кандидатами, специфичными для комплекса Mtb и кодируемыми областью RD1, являются низкомолекулярные секретируемые белки CFP10 и ESAT-6 (Olsen , et al. , 2000, van Pinxteren , et al. , 2000, Brusasca и др. , 2001, Mustafa, 2002, Aagaard и др. , 2004).
Геномное сравнение штамма Mtb h47Rv и нескольких вакцинных штаммов M. bovis выявило 129 ORF, уникальных для Mtb , сгруппированных в 16 областях различий (RD) на хромосоме.Оценка и включение белков, кодируемых из этих областей, может играть жизненно важную роль в создании реагентов PPD следующего поколения, более специфичных к Mtb (Mustafa, 2001). Среди этих 16 RD наиболее изученным является RD1; гены, предсказанные в этом сегменте ДНК, удалены из всех вакцинных штаммов БЦЖ, в то время как они сохраняются во всех лабораторных и клинических изолятах M. bovis и Mtb , проверенных до сих пор (Mahairas , et al. , 1996).Двумя кандидатами, специфичными для комплекса Mtb и кодируемыми областью RD1, являются низкомолекулярные секретируемые белки CFP10 и ESAT-6 (Olsen , et al. , 2000, van Pinxteren , et al. , 2000, Brusasca и др. , 2001, Mustafa, 2002, Aagaard и др. , 2004).
ESAT-6 (Rv3875) и CFP10 (Rv3874), хорошо изученные Т-клеточные антигены, отсутствующие в БЦЖ, в настоящее время используются в качестве реагентов для диагностики туберкулеза с помощью анализа высвобождения гамма-интерферона (IGRA) (Mazurek, 2005). , Чанг К.С. и Леунг К.С., 2010).Рекомбинантный ESAT-6 вызывает положительный кожный ответ у инфицированных Mtb морских свинок и людей (Wu, et al. ., 2008). По сравнению с максимальным ответом DTH через 72 часа, индуцированным PPD, ответ DTH на ESAT-6 достиг пика через 24 часа (Pollock , et al. , 2003). Интересно, что комбинация ESAT-6 и CFP10 оказалась высокочувствительной и специфичной по ответу DTH (van Pinxteren , et al. , 2000). CFP10 действует как шаперон и связывается с ESAT-6 в плотном комплексе 1:1, стабилизируя его складчатую структуру (Renshaw , et al., 2002). Исследование рекомбинантного димера ESAT-6 (rdESAT-6), сверхэкспрессированного в Lactococcus lactis , показало, что он может быть успешным диагностическим средством, поскольку он отличает инфекцию Mtb от вакцинации БЦЖ и профили токсичности rdESAT-6 на нескольких животных моделях. утвердили rdESAT-6 как безопасный реагент для ТКП (Aggerbeck & Madsen, 2006).
, Чанг К.С. и Леунг К.С., 2010).Рекомбинантный ESAT-6 вызывает положительный кожный ответ у инфицированных Mtb морских свинок и людей (Wu, et al. ., 2008). По сравнению с максимальным ответом DTH через 72 часа, индуцированным PPD, ответ DTH на ESAT-6 достиг пика через 24 часа (Pollock , et al. , 2003). Интересно, что комбинация ESAT-6 и CFP10 оказалась высокочувствительной и специфичной по ответу DTH (van Pinxteren , et al. , 2000). CFP10 действует как шаперон и связывается с ESAT-6 в плотном комплексе 1:1, стабилизируя его складчатую структуру (Renshaw , et al., 2002). Исследование рекомбинантного димера ESAT-6 (rdESAT-6), сверхэкспрессированного в Lactococcus lactis , показало, что он может быть успешным диагностическим средством, поскольку он отличает инфекцию Mtb от вакцинации БЦЖ и профили токсичности rdESAT-6 на нескольких животных моделях. утвердили rdESAT-6 как безопасный реагент для ТКП (Aggerbeck & Madsen, 2006). Недавно было завершено двойное слепое рандомизированное исследование фазы I, сравнивающее rdESAT-6 и RT23 у людей. Хотя это исследование показало очень многообещающие результаты в отношении дозировки и безопасности, необходимы дальнейшие исследования, чтобы в достаточной мере продемонстрировать побочные эффекты и эффективность, а также устранить сенсибилизацию (Arend , et al., 2008). Эффективность ESAT-6 и CFP10 в отношении индукции реакций ГЗТ также является предметом споров, поскольку было показано, что они вызывают некротические реакции (Elhay , et al. , 1998).
Недавно было завершено двойное слепое рандомизированное исследование фазы I, сравнивающее rdESAT-6 и RT23 у людей. Хотя это исследование показало очень многообещающие результаты в отношении дозировки и безопасности, необходимы дальнейшие исследования, чтобы в достаточной мере продемонстрировать побочные эффекты и эффективность, а также устранить сенсибилизацию (Arend , et al., 2008). Эффективность ESAT-6 и CFP10 в отношении индукции реакций ГЗТ также является предметом споров, поскольку было показано, что они вызывают некротические реакции (Elhay , et al. , 1998).
В аналогичных исследованиях ESAT-6 сочетали со вторым белком культурального фильтрата, MPT64 (Rv1980c). Было показано, что, как и ESAT-6, рекомбинантный MPT64 вызывает ответ DTH у Mtb инфицированных морских свинок. Дальнейшие эксперименты показали, что 15 остатков между аминокислотами Gly-173 и Ala-187 являются ключевыми для вызова реакции ГЗТ (Oettinger , et al., 1995). Животные, подвергшиеся воздействию смеси ESAT-6-MPT64, показали, что эта комбинация имеет потенциал в качестве высокоспецифичного реагента (Elhay , et al. , 1998). В 2007 году сообщалось, что MPT64 находится на стадии III клинических испытаний для оценки его потенциала для замены PPD (Wang , et al. , 2007).
, 1998). В 2007 году сообщалось, что MPT64 находится на стадии III клинических испытаний для оценки его потенциала для замены PPD (Wang , et al. , 2007).
Ген Rv0061 уникален для комплекса Mtb и кодирует белок DPPD, который способен индуцировать сильную реакцию ГЗН у морских свинок, инфицированных Mtb (Coler , et al., 2000). Последующие исследования больных туберкулезом и клинически здоровых людей убедительно свидетельствуют о том, что DPPD является многообещающей альтернативой PPD (Campos-Neto , et al. , 2001, Liu , et al. , 2004). Недавнее исследование подтвердило биологическую активность очищенного рекомбинантного DPPD с использованием мононуклеарных клеток периферической крови от PPD-положительных доноров крови, что указывает на то, что DPPD можно использовать в качестве очищенного антигена для выявления туберкулеза (Kashino & Campos-Neto, 2011).
Перспективы и выводы
Несмотря на идентификацию более дюжины белков-кандидатов для включения в реагенты PPD следующего поколения и обнадеживающие предварительные данные исследований на животных и людях, создание нового реагента – одного или нескольких антигенов – для замены PPD остается испытывающий.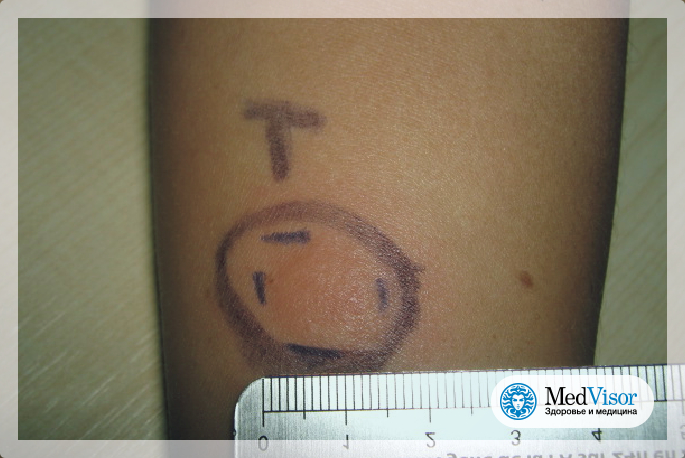 ТКП, специфичная для выявления исключительно активного или латентного туберкулеза, могла бы принести большую пользу диагностическим и эпидемиологическим программам. Таким образом, необходимо использовать новые стратегии для обнаружения более чувствительных и специфичных антигенов кожных тестов.С другой стороны, один антиген не может эффективно заменить PPD, поскольку для оптимального реагента PPD следующего поколения может потребоваться коктейль антигенов или комбинация нескольких DTH-индуцирующих эпитопов (Oettinger , et al. , 1995). , Лященко , и др. , 1998, Родос , и др. , 2000).
ТКП, специфичная для выявления исключительно активного или латентного туберкулеза, могла бы принести большую пользу диагностическим и эпидемиологическим программам. Таким образом, необходимо использовать новые стратегии для обнаружения более чувствительных и специфичных антигенов кожных тестов.С другой стороны, один антиген не может эффективно заменить PPD, поскольку для оптимального реагента PPD следующего поколения может потребоваться коктейль антигенов или комбинация нескольких DTH-индуцирующих эпитопов (Oettinger , et al. , 1995). , Лященко , и др. , 1998, Родос , и др. , 2000).
Для достижения этой цели идентификация молекулярного состава PPD облегчает разработку более совершенного реагента. Протеомные исследования выявили высококонсервативные шапероны GroES, GroEL2 и DnaK как три наиболее доминирующих белка, которые могут объяснить положительные свойства и сниженную специфичность PPD (Borsuk , et al., 2009, Чо и др. , 2012). Наша группа недавно идентифицировала два новых препарата, DnaK/GroEL2/Rv0685 и DnaK/GroEL2/Rv0009, которые были способны индуцировать ответы DTH, эквивалентные PPD, в модели Mtb морских свинок (Yang , et al.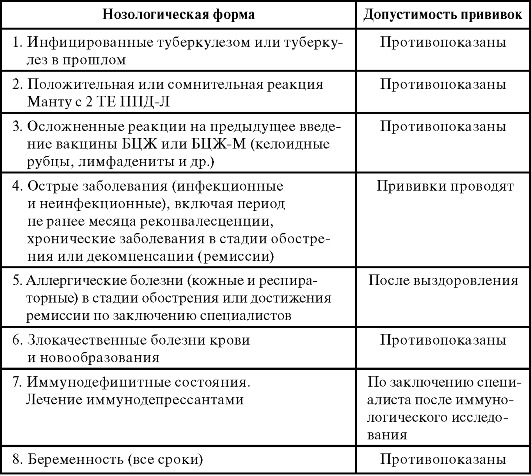 , 2011). . Лучшее понимание реакции DTH, вызванной этими определенными белками, может способствовать открытию быстрых и чувствительных реагентов для кожных тестов следующего поколения для обнаружения инфекции Mtb .
, 2011). . Лучшее понимание реакции DTH, вызванной этими определенными белками, может способствовать открытию быстрых и чувствительных реагентов для кожных тестов следующего поколения для обнаружения инфекции Mtb .
Благодарности
Эта работа финансировалась в рамках контракта на материалы для испытаний и исследований противотуберкулезной вакцины (HHSN266200400091C) с NIH.
Сноски
Конкурирующие интересы: Не заявлено.
Этическое одобрение: Не требуется.
Ссылки
- Aagaard C, Brock I, Olsen A, Ottenhoff TH, Weldingh K, Andersen P. Картирование иммунной реактивности по отношению к Rv2653 и Rv2654: два новых низкомолекулярных антигена, обнаруженных специфически в комплексе Mycobacterium tuberculosis. J заразить Dis. 2004; 189: 812–819. [PubMed] [Google Scholar]
- Addo KK, Hof SV, Mensah GI, et al.Опрос туберкулиновых кожных проб среди ганских школьников. Общественное здравоохранение BMC.
 2010;10:35. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2010;10:35. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Aggerbeck H, Madsen SM. Безопасность ЭСАТ-6. Туберкулез (Эдинб) 2006; 86: 363–373. [PubMed] [Google Scholar]
- Аль-Абси А., Бассили А., Абдул Бари Х. и др. Снижение заболеваемости туберкулезом в Йемене: оценка на основе двух общенациональных туберкулиновых обследований. Int J Tuberc Lung Dis. 2009;13:1100–1105. [PubMed] [Google Scholar]
- Аренд С.М., Франкен В.П., Аггербек Х. и др.Двойное слепое рандомизированное исследование фазы I, сравнивающее rdESAT-6 с туберкулином в качестве реагента для кожных тестов при диагностике туберкулезной инфекции. Туберкулез (Эдинб) 2008; 88: 249–261. [PubMed] [Google Scholar]
- Bachtiar A, Miko TY, Machmud R, et al. Годовой риск заражения туберкулезом в провинции Западная Суматра, Индонезия. Int J Tuberc Lung Dis. 2008; 12: 255–261. [PubMed] [Google Scholar]
- Борген К., Костер Б., Мейер Х., Куйвенховен В., ван дер Санде М., Кобеленс Ф. Оценка крупномасштабного расследования контакта с туберкулезом в Нидерландах.
 Eur Respir J. 2008; 32: 419–425. [PubMed] [Google Scholar]
Eur Respir J. 2008; 32: 419–425. [PubMed] [Google Scholar] - Борсук С., Ньюкомб Дж., Мендум Т.А., Деллагостин О.А., Макфадден Дж. Идентификация белков из очищенного туберкулинового белкового производного (PPD) с помощью ЖХ-МС/МС. Туберкулез (Эдинб) 2009;89:423–430. [PubMed] [Google Scholar]
- Ботамли Г.Х., Кэтти Д., Клифтон-Хэдли Р., Гриффин Ф., Хьюинсон Г., Поллок Дж. Иммунодиагностика микобактериальной инфекции. Глава 10. Blackwell Science Ltd; Oxford: 1999. [Google Scholar]
- Brusasca PN, Colangeli R, Lyashchenko KP, et al.Иммунологическая характеристика антигенов, кодируемых областью RD1 генома Mycobacterium tuberculosis. Сканд Дж. Иммунол. 2001; 54: 448–452. [PubMed] [Google Scholar]
- Campos-Neto A, Rodrigues-Junior V, Pedral-Sampaio DB и др. Оценка DPPD, одного рекомбинантного белка Mycobacterium tuberculosis, в качестве альтернативного антигена для реакции Манту. Туберкулез (Эдинб) 2001;81:353–358. [PubMed] [Google Scholar]
- Чадха В.
 К., Джаганнатха П.С., Вайдьянатан П.С., Джагота П.PPD RT23 для туберкулиновых обследований в Индии. Int J Tuberc Lung Dis. 2003; 7: 172–179. [PubMed] [Google Scholar]
К., Джаганнатха П.С., Вайдьянатан П.С., Джагота П.PPD RT23 для туберкулиновых обследований в Индии. Int J Tuberc Lung Dis. 2003; 7: 172–179. [PubMed] [Google Scholar] - Chambers MA, Jahans K, Whelan A, Hughes C, Sayers R, Perkins A, Glyn Hewinson R. Простое объективное измерение кожной реакции гиперчувствительности замедленного типа на туберкулин с помощью спектрофотометрии. Технология восстановления кожи. 2002; 8: 89–93. [PubMed] [Google Scholar]
- Чо Ю.С., Добос К.М., Пренни Дж. и др. Расшифровка протеома реагента для прижизненной диагностики «очищенное белковое производное» микобактерий туберкулеза.Протеомика. 2012; 12: 979–991. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ciftci E, Ilgazli A, Gulleroglu B, Ara I, Akansel G. Ультрасонографическое измерение туберкулинового кожного теста: сравнение с ручным чтением. Infect Dis Clin Pract (Baltim Md) 2005; 13:20–23. [Google Scholar]
- Colangeli R, Spencer JS, Bifani P, et al. MTSA-10, продукт гена Rv3874 Mycobacterium tuberculosis, вызывает туберкулёзную гиперчувствительность замедленного типа у морских свинок.
 Заразить иммун.2000;68:990–993. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Заразить иммун.2000;68:990–993. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Coler RN, Skeiky YA, Ovendale PJ, et al. Клонирование гена Mycobacterium tuberculosis, кодирующего очищенный белковый производный белок, который вызывает сильную туберкулёзную специфическую гиперчувствительность замедленного типа. J заразить Dis. 2000; 182: 224–233. [PubMed] [Google Scholar]
- Comstock GW, Edwards LB, Philip RN, Winn WA. Сравнение в Соединенных Штатах Америки двух туберкулинов, Ppd-S и Rt 23. Bull World Health Organ.1964; 31: 161–170. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dye C, Scheele S, Dolin P, Pathania V, Raviglione MC. Заявление о консенсусе. Глобальное бремя туберкулеза: оценка заболеваемости, распространенности и смертности по странам. Глобальный проект ВОЗ по эпиднадзору и мониторингу. ДЖАМА. 1999; 282: 677–686. [PubMed] [Google Scholar]
- Edwards PQ, Edwads LB. История туберкулиновой пробы с эпидемиологической точки зрения. Ам преподобный Респир Дис.
 1960; 81 (1 часть 2): 1–47. [PubMed] [Google Scholar]
1960; 81 (1 часть 2): 1–47. [PubMed] [Google Scholar] - Elhay MJ, Oettinger T, Andersen P.Реакция гиперчувствительности замедленного типа на ESAT-6 и MPT64 от Mycobacterium tuberculosis у морской свинки. Заразить иммун. 1998;66:3454–3456. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Farhat M, Greenaway C, Pai M, Menzies D. Ложноположительные туберкулиновые кожные пробы: каков абсолютный эффект БЦЖ и нетуберкулезных микобактерий? Int J Tuberc Lung Dis. 2006; 10:1192–1204. [PubMed] [Google Scholar]
- Фернандес-Вильяр А., Горис А., Отеро М., Чусино Н., Васкес Р., Муньос М.Дж., Пинейро Л.Консервация очищенного белкового производного туберкулина РТ-23. Арка Бронконемол. 2004;40:301–303. [PubMed] [Google Scholar]
- Gillenwater KA, Sapp SC, Pearce K, Siberry GK. Увеличение числа конвертеров туберкулиновых кожных проб среди медицинских работников после перехода с туберсола на аплисол. Am J Infect Control. 2006; 34: 651–654. [PubMed] [Google Scholar]
- Guld J, Bentzon MW, Bleiker MA, Griep WA, Magnusson M, Waaler H.
 Стандартизация новой партии очищенного туберкулина (PPD), предназначенного для международного использования.Всемирный орган здравоохранения Быка. 1958; 19: 845–951. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Стандартизация новой партии очищенного туберкулина (PPD), предназначенного для международного использования.Всемирный орган здравоохранения Быка. 1958; 19: 845–951. [Статья бесплатно PMC] [PubMed] [Google Scholar] - Hanifa Y, Grant AD, Lewis J, Corbett EL, Fielding K, Churchyard G. Распространенность латентной туберкулезной инфекции среди золотодобытчиков в Южной Африке. Int J Tuberc Lung Dis. 2009; 13:39–46. [PubMed] [Google Scholar]
- Хансен О.Г., Линдквист К., Валер Х. Оценка эффективности туберкулина у людей и морских свинок. Всемирный орган здравоохранения Быка. 1964; 31: 171–182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Harrison DK, Abbot NC, Beck JS, McCollum PT.Предварительная оценка лазерной допплеровской визуализации перфузии кожи человека с использованием туберкулиновой реакции в качестве модели. Физиол Изм. 1993; 14: 241–252. [PubMed] [Google Scholar]
- He XY, Luo YA, Zhang XG и др. Клиническая оценка рекомбинантного белка 38 кДа Mycobacterium tuberculosis.
 Scand J Infect Dis. 2007: 1–6. [PubMed] [Google Scholar]
Scand J Infect Dis. 2007: 1–6. [PubMed] [Google Scholar] - Ho MM, Kairo SK, Corbel MJ. Иммуноанализ очищенных белковых производных туберкулина (PPD) в качестве альтернативного анализа in vitro для идентификации и подтверждения активности.Гум Вакцина. 2006; 2:29–33. [PubMed] [Google Scholar]
- Дженсен П.А., Ламберт Л.А., Ядемарко М.Ф., Ридзон Р. Руководство по предотвращению передачи микобактерий туберкулеза в медицинских учреждениях, 2005 г. MMWR Recomm Rep. 2005; 54:1–141. [PubMed] [Google Scholar]
- Кимура М., Комсток Г.В., Мори Т. Сравнение эритемы и уплотнения по результатам туберкулиновых тестов. Int J Tuberc Lung Dis. 2005; 9: 853–857. [PubMed] [Google Scholar]
- Kitaura H, Kinomoto M, Yamada T. Рибосомальный белок L7, включенный в состав очищенного белкового производного туберкулина (PPD), является основным термоустойчивым белком, вызывающим сильную гиперчувствительность замедленного типа.Сканд Дж. Иммунол. 1999; 50: 580–587. [PubMed] [Google Scholar]
- Клаузен Дж.
 , Магнуссон М., Андерсен А.Б., Кох С. Характеристика очищенного белкового производного туберкулина с использованием моноклональных антител: выделение реактивного компонента гиперчувствительности замедленного типа из культурального фильтрата M.tuberculosis. Сканд Дж. Иммунол. 1994;40:345–349. [PubMed] [Google Scholar]
, Магнуссон М., Андерсен А.Б., Кох С. Характеристика очищенного белкового производного туберкулина с использованием моноклональных антител: выделение реактивного компонента гиперчувствительности замедленного типа из культурального фильтрата M.tuberculosis. Сканд Дж. Иммунол. 1994;40:345–349. [PubMed] [Google Scholar] - Kritzinger FE, den Boon S, Verver S, et al. Отсутствие снижения годового риска заражения туберкулезом в эндемичных районах Кейптауна, Южная Африка.Троп Мед Int Health. 2009; 14:136–142. [PubMed] [Google Scholar]
- Li J, Munsiff SS, Agerton TB. Распространенность положительных результатов туберкулиновых кожных проб среди клинического населения в Нью-Йорке. J Immigr Minor Health 2008 [PubMed] [Google Scholar]
- Liu C, Flamoe E, Chen HJ, Carter D, Reed SG, Campos-Neto A. Экспрессия и очистка иммунологически реактивного DPPD, рекомбинантного антигена кожного теста Mycobacterium tuberculosis, с использованием клеток-хозяев Mycobacterium smegmatis и Escherichia coli.Может J Microbiol. 2004; 50:97–105. [PubMed] [Google Scholar]
- Лопес Л.К., Телес С.А., Соуза А.С., Рабахи М.Ф., Типпл А.Ф. Риск туберкулеза среди медсестер из Центральной Бразилии. Am J Infect Control. 2008; 36: 148–151. [PubMed] [Google Scholar]
- Лященко К., Манка С., Коланджели Р., Хейбель А., Уильямс А., Дженнаро М.Л. Использование коктейлей специфических антигенов комплекса микобактерий туберкулеза для кожных тестов, специфичных для туберкулеза. Заразить иммун. 1998;66:3606–3610. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Mackin LA.Скрининг на туберкулез в учреждениях первичной медико-санитарной помощи. Lippincotts Prim Care Pract. 1998; 2: 599–610. викторина 611–593. [PubMed] [Google Scholar]
- Maes M, Gimenez JF, D’Alessandro A, De Waard JH. Стабильность человеческого, бычьего и птичьего очищенного белкового производного туберкулина (PPD) J Infect Dev Ctries. 2011;5:781–785. [PubMed] [Google Scholar]
- Mahairas GG, Sabo PJ, Hickey MJ, Singh DC, Stover CK. Молекулярный анализ генетических различий между Mycobacterium bovis BCG и вирулентными M.крупный рогатый скот J Бактериол. 1996; 178:1274–1282. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Masucci P, McAlpine KL. Биохимические исследования бактериальных производных. X. Получение белка туберкулезной палочки человека МА-100. Proc Soc Exp Biol Med. 1930; 27: 661–663. [Google Scholar]
- Мехта С.Р., МакГрудер С., Луни Д., Джонс С., Смит Д.М. Различия в туберкулиновой реактивности, установленной в программе обследования здоровья сотрудников администрации ветеранов. Клин Вакцина Иммунол. 2009; 16: 541–543.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мустафа А.С. Биотехнология в разработке новых вакцин и диагностических реагентов против туберкулеза. Карр Фарм Биотехнолог. 2001; 2: 157–173. [PubMed] [Google Scholar]
- Мустафа А.С. Разработка новых вакцин и диагностических реагентов против туберкулеза. Мол Иммунол. 2002; 39: 113–119. [PubMed] [Google Scholar]
- Эттингер Т., Холм А., Мтони И.М., Андерсен А.Б., Хаслоов К. Картирование эпитопа секретируемого белка MPT64 Mycobacterium tuberculosis, вызывающего гиперчувствительность замедленного типа.Заразить иммун. 1995;63:4613–4618. [Статья бесплатно PMC] [PubMed] [Google Scholar]
- Olsen AW, Hansen PR, Holm A, Andersen P. Эффективная защита от Mycobacterium tuberculosis путем вакцинации одним субдоминантным эпитопом антигена ESAT-6. Евр Дж Иммунол. 2000;30:1724–1732. [PubMed] [Google Scholar]
- Pollock JM, McNair J, Bassett H, et al. Специфические реакции гиперчувствительности замедленного типа на ESAT-6 идентифицируют крупный рогатый скот, инфицированный туберкулезом. Дж. Клин Микробиол. 2003; 41: 1856–1860.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rangel-Frausto MS, Ponce-De-Leon-Rosales S, Martinez-Abaroa C, Haslov K. Туберкулез и качество туберкулина: лучшие намерения, вводящие в заблуждение результаты. Infect Control Hosp Epidemiol. 2001; 22: 481–484. [PubMed] [Google Scholar]
- Рао В.Г., Гопи П.Г., Ядав Р. и др. Ежегодный риск заражения туберкулезом среди племенного населения центральной Индии. Троп Мед Int Health. 2008; 13:1372–1377. [PubMed] [Google Scholar]
- Renshaw PS, Panagiotidou P, Whelan A, Gordon SV, Hewinson RG, Williamson RA, Carr MD.Убедительные доказательства того, что основные Т-клеточные антигены комплекса Mycobacterium tuberculosis ESAT-6 и CFP-10 образуют плотный комплекс 1:1, и характеристика структурных свойств ESAT-6, CFP-10 и ESAT-6* Комплекс КФП-10. Значение для патогенеза и вирулентности. Дж. Биол. Хим. 2002; 277:21598–21603. [PubMed] [Google Scholar]
- Rhodes SG, Gavier-Widen D, Buddle BM, Whelan AO, Singh M, Hewinson RG, Vordermeier HM. Антигенная специфичность при экспериментальном туберкулезе крупного рогатого скота. Заразить иммун.2000;68:2573–2578. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rowland SS, Ruckert JL, Cummings PJ. Белковые структуры с низкой молекулярной массой в фильтратах культур микобактерий и очищенных белковых производных. FEMS Immunol Med Microbiol. 1999; 23:21–25. [PubMed] [Google Scholar]
- Sbarbaro JA. Антигены кожных тестов: оценка, время которой пришло. Ам преподобный Респир Дис. 1978; 118:1–5. [PubMed] [Google Scholar]
- Schiller I, Vordermeier HM, Waters WR, et al. Сравнение активности туберкулина с использованием гамма-интерферона для диагностики туберкулеза крупного рогатого скота.Ветеринар Рек. 2010; 167:322–326. [PubMed] [Google Scholar]
- Seibert FB. Выделение и свойства очищенного белкового производного туберкулина. Ам преподобный Туберк. 1934; 30: 713–720. [Google Scholar]
- Seibert FB, Glen JT. PPD-S состоял примерно из 92,1% белка, 5,9% полисахаридов и 1,2% нуклеиновой кислоты. Ам преподобный Туберк. 1941; 44: 9–24. [Google Scholar]
- Sgountzos V, Simopoulou S, Kretsou S, Sakayianni K, Pavlerou S, Gourgoulianis K, Grigorakos L. Сравнительное исследование RT23 и туберкулина Мерьё, протестированных на здоровых добровольцах.Int J Tuberc Lung Dis. 2009; 13:312–316. [PubMed] [Google Scholar]
- Shigeto E. [Очищенные белковые производные, полученные из Mycobacterium tuberculosis (PPD) и M. intracellulare (PPD-B) в дифференциальной диагностике микобактериозов] Kekkaku. 1990; 65: 701–709. [PubMed] [Google Scholar]
- Шингадия Д., Новелли В. Туберкулиновая кожная проба: сто, а не выход? Арч Дис Чайлд. 2008; 93: 189–190. [PubMed] [Google Scholar]
- Shrestha KB, Malla P, Jha KK, Shakya TM, Akhtar M, Gunneberg C, van der Werf MJ.Первое национальное туберкулиновое обследование в Непале. Int J Tuberc Lung Dis. 2008; 12: 909–915. [PubMed] [Google Scholar]
- Teixeira L, Maciel E, Dutra ME, Perkins MD, Johnson JL, do Valle Dettoni V. Одновременное сравнение реактивности очищенного белкового производного RT-23 и туберсола у медицинских работников в Витории, Бразилия . Int J Tuberc Lung Dis. 2000;4:1074–1077. [PubMed] [Google Scholar]
- Turk JL. Фон Пирке, аллергия и инфекционные заболевания: обзор. JR Soc Med. 1987; 80: 31–33.[PMC free article] [PubMed] [Google Scholar]
- Ulea I, Murgoci G, Popa ML, Popa L, Stavri H. Сравнительное исследование туберкулинов RT23 и IC-65, испытанных на детях с туберкулезом. Роум Арч Микробиол Иммунол. 2010;69:75–78. [PubMed] [Google Scholar]
- Ван Пинкстерен Л.А., Равн П., Аггер Э.М., Поллок Дж., Андерсен П. Диагностика туберкулеза на основе двух специфических антигенов ESAT-6 и CFP10. Клин Диагн Лаб Иммунол. 2000;7:155–160. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Vashishtha VM, John TJ.Распространенность инфекции Mycobacterium tuberculosis у детей в Западном Уттар-Прадеше. Индийский педиатр. 2010;47:97–100. [PubMed] [Google Scholar]
- Villarino ME, Burman W, Wang YC, et al. Сопоставимая специфичность двух коммерческих туберкулиновых реагентов у лиц с низким риском туберкулезной инфекции. ДЖАМА. 1999; 281:169–171. [PubMed] [Google Scholar]
- Villarino ME, Brennan MJ, Nolan CM, et al. Сравнительное тестирование действующих (PPD-S1) и предложенных (PPD-S2) эталонных стандартов туберкулина.Am J Respir Crit Care Med. 2000; 161:1167–1171. [PubMed] [Google Scholar]
- Wang Z, Potter BM, Gray AM, Sacksteder KA, Geisbrecht BV, Laity JH. Структура раствора антигена MPT64 Mycobacterium tuberculosis определяет новое семейство белков бета-захвата. Дж Мол Биол. 2007; 366: 375–381. [PubMed] [Google Scholar]
- ВОЗ. Доклад Всемирной организации здравоохранения за 2011 г. 2011 г. Глобальная борьба с туберкулезом. [Google Scholar]
- Wu X, Zhang L, Zhang J, Zhang C, Zhu L, Shi Y. Рекомбинантный белок-мишень 6 раннего секретируемого антигена в качестве антигена кожного теста для специфического выявления инфекции Mycobacterium tuberculosis.Клин Эксп Иммунол. 2008; 152:81–87. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Yang HL, Troudt J, Grover A, et al. Три белковых коктейля опосредуют ответы ГЗТ, неотличимые от PPD в модели Mycobacterium tuberculosis на морских свинках. Infect Immun 2011 [бесплатная статья PMC] [PubMed] [Google Scholar]
Очищенные белковые производные туберкулина — прошлое, настоящее и будущее | Патогены и болезни
Аннотация
Туберкулиновая кожная проба, которая включает мониторинг иммунной реакции на инъекцию очищенного белкового производного (PPD), была наиболее широко используемым методом для выявления инфекции Mycobacterium tuberculosis с момента ее разработки в 1930-х годах.До недавнего времени молекулярный состав PPD был неизвестен. Это помешало открытию улучшенных реагентов для кожных тестов и резко затруднило усилия по определению механизма действия. Протеомная оценка PPD в сочетании с подробным анализом на модели туберкулеза морской свинки привела к дальнейшему определению молекулярного состава PPD. В этом сообщении рассматривается история и текущее состояние PPD, в дополнение к описанию реагентов-кандидатов PPD следующего поколения, основанных на использовании отдельного белка или белковых коктейлей.
Введение
Туберкулез (ТБ) — разрушительное инфекционное заболевание, от которого в 2010 г., по оценкам, погибло 1,2–1,5 миллиона человек, а число случаев заболевания — 8,5–9,2 миллиона, причем большинство этих трагических событий произошло в развивающихся странах (ВОЗ, 2011). Его тяжесть усугубляется способностью Mycobacterium tuberculosis ( Mtb ), возбудителя туберкулеза, сохраняться в виде персистирующей бессимптомной инфекции, называемой латентной туберкулезной инфекцией (ЛТИ).В течение почти столетия лица, инфицированные Mtb , выявлялись с помощью туберкулиновой кожной пробы (ТКП). В 1890 году Роберт Кох предположил, что глицериновый экстракт бацилл туберкулеза может как вылечить, так и предотвратить туберкулез. Хотя «Старый туберкулин» (ОТ) Коха в конечном итоге потерпел неудачу в качестве терапии, его открытия послужили катализатором для разработки современной ТКП, наиболее важного инструмента для выявления потенциальных случаев ТБ на сегодняшний день (Shingadia & Novelli, 2008).
ТКП также известна как проба Манту в честь французского врача Шарля Манту (1877–1947), который установил диагностические критерии для чтения ТКП.Метод Манту, который одобрен Американским торакальным обществом и Центрами по контролю и профилактике заболеваний (CDC), в настоящее время является золотым стандартом для определения того, инфицирован ли человек Mtb . Этот иммунологический тест состоит из двух частей. Сначала реагент очищенного производного белка (PPD) вводят внутрикожно в предплечье. Во-вторых, реакцию гиперчувствительности замедленного типа (ГЗТ) отслеживают через 48–72 ч после инъекции путем измерения диаметра уплотнения (отека из-за воспаления) в миллиметрах в месте инъекции.Обычным явлением является визуализация эритемы (покраснения) в течение первых 24 часов после введения PPD; это не следует измерять, так как это не указывает на инфекцию. Проведение и чтение результатов этого теста должны выполняться обученными медицинскими работниками, которые могут интерпретировать факторы риска наряду с измерением при определении положительной реакции (Mackin, 1998).
В дополнение к своей роли в качестве индикатора инфекции Mtb , ТКП также используется в качестве эпидемиологического инструмента для оценки распространенности ЛТБИ.Прогноз о том, что одна треть населения мира инфицирована Mtb , частично основан на частоте положительной ТКП (Dye et al. , 1999).
В текущем обзоре мы представляем обзор истории, развития и текущего использования PPD. Кроме того, будут рассмотрены исследования, направленные на определение ключевых молекулярных компонентов PPD и его биологической активности.
Прошлое и настоящее использование PPD
Первая кожная туберкулиновая проба была введена в 1907 г. фон Пирке (1874–1929), австрийским ученым и педиатром (Turk, 1987).В его исследовании использовалась ОТ Коха, нагретый бульон, состоящий из неочищенной неопределенной смеси белков и других макромолекул, полученных из туберкулезной палочки. OT Коха готовили из концентрированного фильтрата глицерино-пептонного бульона, в котором Mtb росли в течение 6–8 недель. OT Коха и аналогичные продукты не используются в качестве реагентов для ТКП в Соединенных Штатах из-за недостаточной чистоты, различий в эффективности и специфичности, а также из-за неадекватной стандартизации.
В 1930 году альтернативный состав, известный как MA-100, был получен из культурального фильтрата Mtb в виде состава, не содержащего полисахаридов (Masucci & McAlpine, 1930).Было обнаружено, что МА-100 значительно более эффективен, чем ОТ Коха; однако его использование в качестве стандартного диагностического реагента было ограничено — в основном из-за сенсибилизирующего действия, наблюдаемого при повторном введении в кожу.
В 1934 году Флоренс Б. Зайберт (1897–1991), биохимик из Института Генри Фиппса Пенсильванского университета, разработала более стабильный и последовательный препарат (Seibert, 1934). Первоначально предназначенный для способа, он был произведен, SOTT, аббревиатура от «синтетическая среда ОТ осадка трихлоруксусной кислоты», этот продукт позже был назван PPD.Его получали пропариванием культур Mtb в стерилизаторе Arnold и очисткой белков повторным осаждением сульфатом аммония (Seibert & Glen, 1941). По сравнению с предыдущими туберкулиновыми реагентами, в этом методе приготовления PPD было значительно снижено содержание полисахаридов, нуклеиновых кислот и липидов, и, таким образом, это был реагент, богатый белком. В 1944 году большая партия этого улучшенного PPD (партия 49608) и переименованного PPD-S (PPD-Standard) была предоставлена в качестве эталонного продукта в Соединенных Штатах.PPD-S состоял примерно из 92,9% белка, 5,9% полисахаридов и 1,2% нуклеиновой кислоты (Seibert & Glen, 1941). Из-за повышенной чистоты и активности PPD-S был принят Всемирной организацией здравоохранения (ВОЗ) в качестве международного стандарта туберкулина в 1952 г. (Guld et al. , 1958). С 1978 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) потребовало, чтобы все партии PPD были квалифицированы биологическим анализом и должны демонстрировать активность, эквивалентную активности PPD-S (Sbarbaro, 1978). Международная единица (МЕ) для PPD была определена как часть этого эффекта; одна МЕ равна биологической активности, содержащейся в 0.028 мкг PPD-S (0,02 мкг PPD с 0,008 мкг солей). Однако в Соединенных Штатах и Канаде эффективность PPD выражается в туберкулиновых единицах (TU), а не в IU. Одна TU определяется как 0,02 мкг PPD-S (Edwards & Edwads, 1960). Пять ТЕ являются стандартной дозой для внутрикожного диагностического применения, как определено в эпидемиологических исследованиях (Bothamley et al. , 1999).
PPD-S2, текущий стандарт США на туберкулин PPD, был разработан в ожидании возможного истощения запасов PPD-S (Villarino et al., 2000). В настоящее время Aplisol® (JHP Pharmaceuticals, Inc, Rochester, MI) и Tubersol® (Sanofi Pasteur Limited, Swiftwater, PA) являются двумя широко используемыми коммерчески доступными продуктами PPD-S2 (Jensen et al. , 2005). Результаты кожных испытаний с Aplisol® и Tubersol® вполне сопоставимы с результатами оригинального стандарта PPD, PPD-S (Villarino et al. , 1999). Однако переход от Tubersol® к Aplisol® или наоборот привел к отклонениям в кожных тестах, хотя точная причина до сих пор неясна (Gillenwater et al., 2006; Мехта и др. , 2009).
Помимо PPD-S, существует несколько других составов PPD, используемых за пределами США и Канады (Li et al. , 2010). Некоторые из этих туберкулиновых продуктов, в том числе PPD RT23, производятся Statens Serum Institute (SSI, Копенгаген, Дания) (Comstock et al. , 1964). В настоящее время ВОЗ и Международный союз по борьбе с туберкулезом и заболеваниями легких (IUATLD) рекомендуют 2 ТЕ PPD-RT23 с твином 80.RT23 является наиболее широко используемым продуктом PPD во всем мире (Rangel-Frausto et al. , 2001). Несколько исследований по всему миру использовали PPD RT23 для оценки распространенности инфекции туберкулезной палочкой, включая Индию (Rao et al. , 2008; Vashishtha & John, 2010), Гану (Addo et al. , 2010) , Йемен (Al-Absi et al. , 2009), Южная Африка (Hanifa et al. , 2009; Kritzinger et al. , 2009), Непал (Shrestha et al., 2008), Бразилии (Lopes и др. , 2008) и Индонезии (Bachtiar и др. , 2008). Кроме того, он также использовался для оценки крупномасштабных контактов с ТБ в Нидерландах (Borgen et al. , 2008).
В дополнение к вышеупомянутым продуктам PPD также используются другие варианты PPD, такие как PPD RT23 Mexico (Laboratorio Nacional de Salud, Secretaria de Salud, Мехико, Мексика), продукт PPD, используемый в Латинской Америке (Rangel-Frausto и др., 2001), и японский продукт PPD-s (Kimura и др. , 2005). Многочисленные продукты PPD, используемые в настоящее время, приведены в таблице 1.
Таблица 1Продукты PPD, используемые в настоящее время у людей
Таблица 1Продукты PPD, используемые в настоящее время у людей
Поскольку существует несколько производителей PPD, важно оценить различия в эффективности этих продуктов PPD. Из-за ограниченных знаний о точном составе каждого продукта PPD невозможно использовать традиционные методы контроля качества для сравнения препаратов PPD.Поэтому сравнения с использованием животных, инфицированных микобактериями, проводятся для оценки биологической активности продуктов PPD. При этом продукты PPD должны вводиться в тех же условиях, в которых они будут использоваться в клинических условиях (Hansen и др. , 1964).
Первое опубликованное сравнение эффективности PPD было проведено между PPD-S и PPD-RT23. Исследование, проведенное среди шести групп населения в Соединенных Штатах, включая детей-эскимосов, больных туберкулезом и новобранцев в учебных центрах ВМС США, показало, что 2.5 TU PPD-RT23, содержащего Tween 80, имели эффективность, аналогичную 5 TU PPD-S (Comstock et al. , 1964). Совсем недавно исследование 69 пациентов с туберкулезом и 1189 субъектов с низким риском в Соединенных Штатах сравнило PPD-S2 с PPD-S1. Было обнаружено, что эти два продукта статистически неразличимы у больных туберкулезом. Кроме того, такая же высокая специфичность наблюдалась среди субъектов с низким риском. Это исследование показало, что PPD-S2 функционально эквивалентен PPD-S1 и может легко заменить его (Villarino et al., 2000). Многочисленные исследования сравнивали активность RT23, полученного в SSI, с другими источниками PPD, включая IC-65, и среди них была обнаружена эквивалентная эффективность (Chadha et al. , 2003; Schiller et al. , 2010; Ulea и др. , 2010). Однако аналогичное исследование в Мексике сравнило эффективность местного производства PPD RT23 (Мексика), Tubersol® и PPD RT23 (SSI) и выявило, что из трех, RT23 (Мексика) имел гораздо более низкую чувствительность (Rangel-Frausto et al. др., 2001). RT23 и туберкулин Merieux (разработанный в Pasteur-Merieux) также недавно сравнивали по их относительной активности. Оба препарата были получены из нескольких штаммов микобактерий (RT23 был получен из семи штаммов Mtb , Merieux был получен из трех штаммов Mtb плюс Mycobacterium bovis ) и, по-видимому, обладал биологической эффективностью, эквивалентной PPD-S. который является продуктом одного штамма. Однако RT23 часто вызывает более сильную антигенную реакцию, чем препарат Мерье (Sgountzos et al., 2009). Недавно Schiller et al. (2010) сравнивали диагностическую надежность PPD из разных источников с помощью инновационного подхода к мониторингу ответов интерферона-γ в культурах цельной крови. В этом исследовании образцы цельной крови стимулировали несколькими различными туберкулинами, и через 24 часа после стимуляции отслеживали реакцию IFN-γ. Их результаты подтверждают, что существуют значительные различия между депрессорами из разных источников, и указывают на необходимость дальнейшей стандартизации продуктов депрессоров.Была введена количественная шкала, обозначенная как RP30 (относительная активность 30), определяемая как концентрация белка, при которой конкретный препарат PPD имеет 30% максимальной активности. RP30 можно использовать в качестве инструмента для быстрого сравнения биологической активности партий и источников PPD. Хотя в этих отчетах подчеркивается важность оценки биологической активности продуктов PPD из разных источников, расхождения в эффективности трудно объяснить из-за сложности и неоднозначности молекулярного состава PPD.Протеомная характеристика PPD была описана нашей лабораторией (Cho et al. , 2012) и другими (Borsuk et al. , 2009), демонстрируя, что PPD состоит из сотен различных белков. Дополнительный сравнительный протеомный, биологический и гистологический анализы использовались для измерения относительных различий в молекулярном составе и биологической эффективности между PPD-S2, RT23 и PPD-KIT (PPD Корейского технологического института) (Cho et al. , 2012).Это исследование продемонстрировало, что, хотя все три препарата PPD были неразличимы по своей способности индуцировать ответ ГЗТ, были очевидны гистологические различия и различия в относительном количестве нескольких белков, включая членов семейства белков Esx, что позволяет предположить корреляцию между повышенной гистопатологией и повышенная концентрация белков Esx в PPD (Cho et al. , 2012). В совокупности все эти сравнительные отчеты иллюстрируют сложность PPD и проблемы, связанные с созданием стандартизированного реагента.
Подводные камни PPD
Несмотря на то, что в прошлом столетии ТКП была стандартом для выявления лиц, подверженных риску активного ТБ, она имеет несколько фундаментальных недостатков, которые послужили стимулом для разработки более стандартизированной методологии и более эффективных инструментов для выявления ЛТБИ. Основной проблемой текущего теста является высокий уровень ложноположительных результатов, вызванный неспособностью TST отличить инфекцию Mtb от воздействия нетуберкулезных микобактерий или вакцинации M.bovis Bacille Calmett-Guérin (BCG) (Huebner et al. , 1993). Оба случая ложноположительных ответов обычно приписывают иммунному ответу, запускаемому гомологичными антигенами либо при вакцинации БЦЖ, либо от микобактерий окружающей среды (Harboe, 1981; Huebner et al. , 1993). Эти предположения были недавно подтверждены молекулярным анализом PPD, показывающим, что четыре белка теплового шока (GroEl, GroEs, DnaK и HspX) составляют примерно 60% протеомного содержания PPD (Borsuk et al., 2009; Чо и др. , 2012). Эти белки-шапероны обладают высокой гомологией (более 70%) и консервативны среди большинства видов микобактерий (Borsuk et al. , 2009; Cho et al. , 2012). Это усложняет использование ТКП в качестве инструмента как для эпидемиологических исследований, так и для выявления лиц, инфицированных Mtb , из-за потенциальной перекрестной реактивности при вакцинации БЦЖ или заражении нетуберкулезными микобактериями. Ложноотрицательные результаты также проблематичны, особенно у детей и лиц с ослабленным иммунитетом (Farhat et al., 2006; Шингадия и Новелли, 2008 г.). Это связано с тем, что положительный PPD требует эффективного ответа DTH. Поэтому вполне вероятно, что PPD не может служить индикатором инфекции Mtb в тех популяциях, где отсутствует надежный Т-клеточный иммунитет. Наконец, несмотря на то, что ТКП может быть использована для выявления ЛТБИ, она не позволяет провести различие между активным заболеванием и выздоравливающим пациентом. Несмотря на эти подводные камни, TST остается наиболее часто используемым инструментом для обнаружения инфекции Mtb .
Будущее PPD — открытие и разработка PPD следующего поколения
Разработка новых и более эффективных реагентов для выявления ЛТБИ является ключом к успеху в борьбе с туберкулезом. Улучшенное обнаружение латентных бацилл приведет к стратегиям раннего вмешательства и, вероятно, снизит заболеваемость и разорвет цикл передачи болезни.
Не следует упускать из виду усовершенствование существующих реагентов ТКП, поскольку мы движемся к цели создания новых реагентов для обнаружения ЛТБИ; однако стоит отметить, что метод количественной оценки иммунного ответа весьма субъективен.Вместо измерения диаметра уплотнений в миллиметрах тестируется несколько новых методов. К ним относятся лазерная допплеровская визуализация у людей (Harrison et al. , 1993), использование ручного спектрофотометра для измерения реакции DTH (Chambers et al. , 2002) и ультразвуковое исследование у пациентов (Ciftci et al. и др. , 2005). Эти альтернативные методы могут применяться для объективного количественного определения TST и могут преодолевать ограничения обычного способа измерения; однако следует учитывать возможность использования дорогостоящих технологий в регионах с ограниченными ресурсами.
В дополнение к улучшению метода измерения для улучшения стандартизации теста, можно улучшить фактический состав депрессора. Определение молекулярного состава PPD в течение многих лет было серьезным препятствием. Длительное нагревание сырого туберкулина для приготовления PPD способствовало денатурации, частичной деградации и агрегации многих белковых компонентов. Многочисленные исследования идентифицировали PPD как смесь очень гетерогенных белков размером от очень больших агрегатов до очень маленьких расщепленных молекул (Klausen et al., 1994; Роуленд и др. , 1999; Хо и др. , 2006). Точно так же мало было известно о том, какой из этих компонентов в PPD отвечает за реакцию DTH. С недавней идентификацией более 100 белков из четырех различных PPD с помощью масс-спектрометрии (Borsuk et al. , 2009; Cho et al. , 2012) можно применять новые подходы для определения того, какой из этих компонентов нарушает DTH. отклик.
Почти за два десятилетия до публикации молекулярного состава PPD были проведены многочисленные исследования отдельных белков для проверки их способности индуцировать реакцию ГЗТ (Klausen et al., 1994). Такие исследования по-прежнему имеют решающее значение для оптимизации PPD и понимания того, как он модулирует иммунную систему. Антигены, тестируемые в качестве будущих реагентов PPD, приведены в таблице 2.
Таблица 2Антигены, в настоящее время оцениваемые в качестве кандидатов PPD следующего поколения
Таблица 2Антигены, в настоящее время оцениваемые в качестве кандидатов PPD следующего поколения
Помимо протеомики, геномика играет ключевую роль в идентификации Mtb -специфических антигенов.Геномное сравнение штамма Mtb h47Rv и нескольких вакцинных штаммов M. bovis выявило 129 ORF, уникальных для Mtb , сгруппированных в 16 областях различий (RD) на хромосоме. Оценка и включение белков, кодируемых из этих областей, может играть жизненно важную роль в создании реагентов PPD следующего поколения, более специфичных к Mtb (Mustafa, 2001). Среди этих 16 RD наиболее изученным является RD1; гены, предсказанные в этом сегменте ДНК, удалены из всех вакцинных штаммов БЦЖ, в то время как они консервативны во всех лабораторных и клинических изолятах М.bovis и Mtb тестировались до сих пор (Mahairas et al. , 1996). Двумя кандидатами, специфичными для комплекса Mtb и кодируемыми областью RD1, являются низкомолекулярные секретируемые белки CFP10 и ESAT-6 (Olsen et al. , 2000; van Pinxteren et al. , 2000; Brusasca ). и др. , 2001; Mustafa, 2002; Aagaard и др. , 2004).
ESAT-6 (Rv3875) и CFP10 (Rv3874), хорошо изученные Т-клеточные антигены, отсутствующие в БЦЖ, в настоящее время используются в качестве реагентов для диагностики туберкулеза с помощью анализа высвобождения гамма-интерферона (Mazurek, 2005; Chang & Люнг, 2010).Рекомбинантный ESAT-6 вызывает положительный кожный ответ у морских свинок и людей, инфицированных Mtb (Wu et al. , 2008). По сравнению с максимальным ответом ГЗТ через 72 часа, индуцированным PPD, ответ ГЗТ на ESAT-6 достиг пика через 24 часа (Pollock et al. , 2003). Интересно, что комбинация ESAT-6 и CFP10 оказалась высокочувствительной и специфичной по ответу DTH (van Pinxteren et al. , 2000). CFP10 действует как шаперон и связывается с ESAT-6 в плотном комплексе 1:1, стабилизируя его складчатую структуру (Renshaw et al., 2002). Исследование рекомбинантного димера ESAT-6 (rdESAT-6), сверхэкспрессированного в Lactococcus lactis , показало, что он может быть успешным диагностическим средством, поскольку он отличает инфекцию Mtb от вакцинации БЦЖ и профили токсичности rdESAT-6 на нескольких животных моделях. утвердили rdESAT-6 как безопасный реагент для ТКП (Aggerbeck & Madsen, 2006). Недавно было завершено двойное слепое рандомизированное исследование фазы I, сравнивающее rdESAT-6 и RT23 у людей. Хотя это исследование показало очень многообещающие результаты в отношении дозировки и безопасности, необходимы дальнейшие исследования, чтобы в достаточной мере продемонстрировать побочные эффекты и эффективность, а также устранить сенсибилизацию (Arend et al., 2008). Эффективность ESAT-6 и CFP10 в индукции ответов ГЗТ также является предметом споров, поскольку было показано, что они вызывают некротические ответы (Elhay et al. , 1998).
В аналогичных исследованиях ESAT-6 сочетали со вторым белком культурального фильтрата, MPT64 (Rv1980c). Как и ESAT-6, рекомбинантный MPT64, как было показано, вызывает ответ DTH у Mtb -инфицированных морских свинок. Дальнейшие эксперименты показали, что 15 остатков между аминокислотами Gly-173 и Ala-187 являются ключевыми для вызова реакции ГЗТ (Oettinger et al., 1995). Животные, подвергнутые коктейлю ESAT-6-MPT64, показали, что эта комбинация имеет потенциал в качестве высокоспецифичного реагента (Elhay et al. , 1998). В 2007 году сообщалось, что MPT64 находится на стадии III клинических испытаний для оценки его потенциала в качестве замены PPD (Wang et al. , 2007).
Ген Rv0061 уникален для комплекса Mtb и кодирует белок DPPD, который способен индуцировать сильную реакцию DTH у морских свинок, инфицированных Mtb (Coler et al., 2000). Последующие исследования пациентов с ТБ и клинически здоровых лиц убедительно свидетельствуют о том, что DPPD является многообещающей альтернативой PPD (Campos-Neto et al. , 2001; Liu et al. , 2004).
Перспективы и выводы
Несмотря на идентификацию более дюжины белков-кандидатов для включения в реагенты PPD следующего поколения и многообещающие предварительные данные исследований на животных и людях, получение нового реагента — одного или нескольких антигенов — для замены PPD остается сложной задачей.ТКП, специально предназначенная для выявления исключительно активной или латентной формы ТБ, может принести большую пользу диагностическим и эпидемиологическим программам. Таким образом, необходимо использовать новые стратегии для обнаружения более чувствительных и специфичных антигенов кожных тестов. С другой стороны, один антиген не может эффективно заменить PPD, поскольку для оптимального реагента PPD следующего поколения может потребоваться коктейль антигенов или комбинация нескольких DTH-индуцирующих эпитопов (Oettinger et al. , 1995; Лященко и др., 1998; Родос и др. , 2000).
Для достижения этой цели идентификация молекулярного состава PPD облегчает разработку более совершенного реагента. Протеомные исследования определили высококонсервативные шапероны GroES, GroEL2 и DnaK как три наиболее доминирующих белка, которые могут объяснить положительные свойства и сниженную специфичность PPD (Borsuk et al. , 2009; Cho et al. , 2012). . Наша группа недавно идентифицировала два новых препарата, DnaK/GroEL2/Rv0685 и DnaK/GroEL2/Rv0009, которые были способны индуцировать ответы DTH, эквивалентные PPD, в модели морских свинок Mtb (Yang et al., 2011). Лучшее понимание того, что реакция DTH, вызванная этими определенными белками, может способствовать открытию быстрых и чувствительных реагентов для кожных тестов следующего поколения для обнаружения инфекции Mtb .
Конфликт интересов
Не объявлено.
Этическое одобрение
Нет.
Благодарности
Эта работа финансировалась в рамках контракта на материалы для испытаний и исследований противотуберкулезной вакцины (HHSN266200400091C) с NIH.
Каталожные номера
(
2004
)Картирование иммунной реактивности по отношению к Rv2653 и Rv2654: два новых низкомолекулярных антигена, обнаруженных специфически в комплексе Mycobacterium tuberculosis
.J Infect Dis
189
:812
–819
.(
2010
)Обследование туберкулиновой кожной пробы среди школьников Ганы
.BMC Public Health
10
:35
.(
2006
)Безопасность ЭСАТ-6
.Туберкулез (Эдинб)
86
:363
–373
.(
2009
)Снижение заболеваемости туберкулезом в Йемене: оценка на основе двух общенациональных туберкулиновых обследований
.Int J Tuberc Lung Dis
13
:1100
–1105
.(
2008
)Двойное слепое рандомизированное исследование фазы I, сравнивающее rdESAT-6 с туберкулином в качестве реагента для кожных тестов при диагностике туберкулезной инфекции
.Туберкулез (Эдинб)
88
:249
–261
.и другие. (
2008
)Ежегодный риск заражения туберкулезом в провинции Западная Суматра, Индонезия
.Int J Tuberc Lung Dis
12
:255
–261
.(
2008
)Оценка крупномасштабного расследования контактов с туберкулезом в Нидерландах
.Eur Respir J
32
:419
–425
.(
2009
)Идентификация белков из очищенного белкового производного туберкулина (PPD) методом ЖХ-МС/МС
.Туберкулез (Эдинб)
89
:423
–430
.(
1999
)Иммунодиагностика микобактериальной инфекции (Глава 10)
.Blackwell Science Ltd
,Оксфорд
.(
2001
)Иммунологическая характеристика антигенов , кодируемых областью RD1 генома Mycobacterium tuberculosis
.Scand J Immunol
54
:448
–452
.(
2001
)Оценка DPPD, отдельного рекомбинантного белка Mycobacterium tuberculosis в качестве альтернативного антигена для реакции Манту
.Туберкулез (Эдинб)
81
:353
–358
.(
2003
)PPD RT23 для туберкулиновых обследований в Индии
.Int J Tuberc Lung Dis
7
:172
–179
.(
2002
)Простое объективное измерение кожной реакции гиперчувствительности замедленного типа на туберкулин с помощью спектрофотометрии
.Skin Res Technol
8
:89
–93
.(
2010
)Систематический обзор анализов высвобождения гамма-интерферона при туберкулезе: внимание к отношениям правдоподобия
.Грудная клетка
65
:271
–276
.и другие. (
2012
)Расшифровка протеома диагностического реагента in vivo «очищенное белковое производное» из Mycobacterium tuberculosis
.Протеомика
12
:979
–991
.(
2005
)Ультрасонографическое измерение туберкулиновой кожной пробы: сравнение с ручным считыванием
.Infect Dis Clin Pract (Baltim Md)
13
:20
–23
.(
2000
)MTSA-10, продукт гена Rv3874 Mycobacterium tuberculosis , вызывает туберкулёзную специфическую гиперчувствительность замедленного типа у морских свинок
.Infect Immun
68
:990
–993
.(
2000
)Клонирование гена Mycobacterium tuberculosis , кодирующего очищенный белковый производный белок, вызывающий сильную туберкулёзную специфическую гиперчувствительность замедленного типа
.J Infect Dis
182
:224
–233
.(
1964
)Сравнение в Соединенных Штатах Америки двух туберкулинов, Ppd-S и Rt 23
.Bull World Health Organ
31
:161
–170
.(
1999
)Согласованное заявление. Глобальное бремя туберкулеза: оценка заболеваемости, распространенности и смертности по странам.Глобальный проект ВОЗ по эпиднадзору и мониторингу
.JAMA
282
:677
–686
.(
1960
)История туберкулиновой пробы с эпидемиологической точки зрения
.Am Rev Respir Dis
81
(Pt 2
):1
–47
.(
1998
)Реакция гиперчувствительности замедленного типа на ESAT-6 и MPT64 от Mycobacterium tuberculosis у морской свинки
.Infect Immun
66
:3454
–3456
.(
2006
)Ложноположительные туберкулиновые кожные пробы: каков абсолютный эффект БЦЖ и нетуберкулезных микобактерий?
Int J Tuberc Lung Dis
10
:1192
–1204
.(
2004
)Консервация очищенного белкового производного туберкулина RT-23
.Arch Bronconeumol
40
:301
–303
.(
2006
)Увеличение количества конверсий туберкулиновых кожных проб среди медицинских работников после перехода с туберсола на аплисол
.Am J Инфекционный контроль
34
:651
–654
.(
1958
)Стандартизация новой партии очищенного туберкулина (PPD), предназначенного для международного использования
.Bull World Health Organ
19
:845
–951
.(
2009
)Распространенность латентной туберкулезной инфекции среди золотодобытчиков в Южной Африке
.Int J Tuberc Lung Dis
13
:39
–46
.(
1964
)Оценка активности туберкулина у людей и морских свинок
.Bull World Health Organ
31
:171
–182
.(
1981
)Антигены PPD, старого туберкулина и автоклавированного Mycobacterium bovis БЦЖ изучены методом перекрестного иммуноэлектрофореза
.Am Rev Respir Dis
124
:80
–87
.(
1993
)Предварительная оценка лазерной допплеровской визуализации перфузии кожи человека с использованием туберкулиновой реакции в качестве модели
.Physiol Meas
14
:241
–252
.и другие. (
2008
)Клиническая оценка рекомбинантного белка 38 кДа Mycobacterium tuberculosis
.Scand J Infect Dis
40
:121
–126
.(
2006
)Иммуноанализ очищенного туберкулинового белкового производного (PPD) в качестве альтернативного анализа in vitro для идентификации и подтверждения эффективности
.Hum Вакцина
2
:29
–33
.(
1993
)Туберкулиновая кожная проба
.Clin Infect Dis
17
:968
–975
.(
2005
)Руководство по профилактике передачи Mycobacterium tuberculosis в медицинских учреждениях, 2005 г.
.MMWR Recomm Rep
54
:1
–141
.(
2005
)Сравнение эритемы и уплотнения по результатам туберкулиновых проб
.Int J Tuberc Lung Dis
9
:853
–857
.(
1999
)Рибосомный белок L7, включенный в состав очищенного белкового производного туберкулина (PPD), является основным термоустойчивым белком, вызывающим сильную гиперчувствительность замедленного типа
.Scand J Immunol
50
:580
–587
.(
1994
)Характеристика очищенного белкового производного туберкулина с использованием моноклональных антител: выделение реактивного компонента гиперчувствительности замедленного типа из культурального фильтрата M.tuberculosis
.Scand J Immunol
40
:345
–349
.(
2009
)Отсутствие снижения годового риска заражения туберкулезом в эндемичных районах Кейптауна, Южная Африка
.Trop Med Int Health
14
:136
–142
.(
2010
)Распространенность положительных результатов туберкулиновых кожных проб среди клинической популяции в Нью — Йорке
.J Несовершеннолетнее иммиграционное здоровье
12
:816
–822
.(
2004
)Экспрессия и очистка иммунологически реактивного DPPD, рекомбинантного антигена кожного теста Mycobacterium tuberculosis , с использованием клеток-хозяев Mycobacterium smegmatis и Escherichia coli
.Can J Microbiol
50
:97
–105
.(
2008
)Риск туберкулеза среди медицинских сестер из Центральной Бразилии
.Am J Инфекционный контроль
36
:148
–151
.(
1998
)Использование коктейлей Mycobacterium tuberculosis комплексных специфических антигенов для кожных тестов, специфических для туберкулеза
.Infect Immun
66
:3606
–3610
.(
1998
)Скрининг на туберкулез в учреждениях первичной медицинской помощи
.Lippincotts Prim Care Pract
2
:599
–610
; викторина 611–593.(
2011
)Стабильность очищенного белкового производного туберкулина человека, крупного рогатого скота и птиц (PPD)
.J Infect Dev Ctries
5
:781
–785
.(
1996
)Молекулярный анализ генетических различий между Mycobacterium bovis БЦЖ и вирулентным M. bovis
.J Бактериол
178
:1274
–1282
.(
1930
)Биохимические исследования бактериальных производных. X. Препарат белка туберкулезной палочки человека MA-100
.Proc Soc Exp Biol Med
27
:661
–663
.Отдел ликвидации туберкулеза, Национальный центр профилактики ВИЧ, ЗППП и туберкулеза, Центры по контролю и профилактике заболеваний (CDC)
(2005
) США .MMWR Recomm Rep
54
(RR-15
):49
–55
.(
2009
)Различия в туберкулиновой реактивности , установленные в программе медицинского освидетельствования сотрудников администрации ветеранов
.Клин Вакцина Иммунол
16
:541
–543
.(
2001
)Биотехнология в разработке новых вакцин и диагностических реагентов против туберкулеза
.Curr Pharm Biotechnol
2
:157
–173
.(
2002
)Разработка новых вакцин и диагностических реагентов против туберкулеза
.Мол Иммунол
39
:113
–119
.(
1995
)Картирование индуцирующего гиперчувствительность замедленного типа эпитопа секретируемого белка MPT64 из Mycobacterium tuberculosis
.Infect Immun
63
:4613
–4618
.(
2000
)Эффективная защита от Mycobacterium tuberculosis путем вакцинации одним субдоминантным эпитопом антигена ESAT-6
.Eur J Immunol
30
:1724
–1732
.(
2003
)Специфические реакции гиперчувствительности замедленного типа на ESAT-6 идентифицируют крупный рогатый скот, инфицированный туберкулезом
.J Clin Microbiol
41
:1856
–1860
.(
2001
)Туберкулез и качество туберкулина: лучшие намерения, вводящие в заблуждение результаты
.Infect Control Hosp Epidemiol
22
:481
–484
.и другие. (
2008
)Ежегодный риск заражения туберкулезом среди племенного населения центральной Индии
.Trop Med Int Health
13
:1372
–1377
.(
2002
)Убедительные доказательства того, что основные Т-клеточные антигены комплекса Mycobacterium tuberculosis ESAT-6 и CFP-10 образуют плотный комплекс 1:1, и характеристика структурных свойств ESAT-6, CFP -10 и комплекс ЭСАТ-6*ЦФП-10.Значение для патогенеза и вирулентности
.J Biol Chem
277
:21598
–21603
.(
2000
)Антигенная специфичность при экспериментальном туберкулезе крупного рогатого скота
.Infect Immun
68
:2573
–2578
.(
1999
)Белковые структуры с низкой молекулярной массой в фильтратах культур микобактерий и очищенных белковых производных
.FEMS Immunol Med Microbiol
23
:21
–25
.(
1978
)Антигены кожных тестов: оценка, время которой пришло
.Am Rev Respir Dis
118
:1
–5
.и другие. (
2010
)Сравнение активности туберкулина с использованием гамма-интерферона для диагностики туберкулеза крупного рогатого скота
.Vet Rec
167
:322
–326
.(
1934
)Выделение и свойства очищенного белкового производного туберкулина
.Am Rev Tuberc
30
:713
–720
.(
1941
)PPD-S состоял примерно из 92,1% белка, 5,9% полисахаридов и 1,2% нуклеиновой кислоты
.Am Rev Tuberc
44
:9
–24
.(
2009
)Сравнительное исследование RT23 и туберкулина Мерье , испытанных на здоровых добровольцах
.Int J Tuberc Lung Dis
13
:312
–316
.(
1990
)[Очищенные белковые производные, полученные из Mycobacterium tuberculosis (PPD) и M. intracellulare (PPD-B) в дифференциальной диагностике микобактериозов]
.Кеккаку
65
:701
–709
.(
2008
)Туберкулиновая кожная проба: сто, а не выход?
Arch Dis Child
93
:189
–190
.(
2008
)Первое национальное туберкулиновое обследование в Непале
.Int J Tuberc Lung Dis
12
:909
–915
.(
2000
)Одновременное сравнение реактивности к очищенному белковому производному RT-23 и туберсолу у медицинских работников в Витории, Бразилия
.Int J Tuberc Lung Dis
4
:1074
–1077
.(
1987
)Фон Пирке, аллергия и инфекционные заболевания: обзор
.JR Soc Med
80
:31
–33
.(
2010
)Сравнительное исследование туберкулинов РТ23 и ИК-65 , испытанных на детях , больных туберкулезом
.Roum Arch Microbiol Immunol
69
:75
–78
.(
2000
)Диагностика туберкулеза на основе двух специфических антигенов ESAT-6 и CFP10
.Clin Diagn Lab Immunol
7
:155
–160
.(
2010
)Распространенность инфекции Mycobacterium tuberculosis среди детей в западном штате Уттар-Прадеш
.Indian Pediatr
47
:97
–100
.(
1999
)Сравнимая специфичность 2 коммерческих туберкулиновых реагентов у лиц с низким риском туберкулезной инфекции
.JAMA
281
:169
–171
.(
2000
)Сравнительные испытания действующих (PPD-S1) и предлагаемых (PPD-S2) эталонных стандартов туберкулина
.Am J Respir Crit Care Med
161
:1167
–1171
.(
2007
)Структура раствора антигена MPT64 из Mycobacterium tuberculosis определяет новое семейство бета-захватывающих белков
.Дж Мол Биол
366
:375
–381
.ВОЗ
(2011
)Глобальная борьба с туберкулезом: Доклад Всемирной организации здравоохранения за 2011 г.
.ВОЗ
,Женева
.(
2008
)Рекомбинантный белок — мишень 6 раннего секретируемого антигена в качестве антигена кожного теста для специфического обнаружения инфекции Mycobacterium tuberculosis
.Clin Exp Immunol
152
:81
–87
.(
2011
)Три белковых коктейля опосредуют реакции ГЗТ, неотличимые от PPD, в модели Mycobacterium tuberculosis
на морских свинках.Infect Immun
79
:716
–723
.Примечания автора
© 2012 Федерация европейских микробиологических обществ.
Фаза 2b контролируемых испытаний вакцины M72/AS01E для профилактики туберкулеза
1. Houben RM, Dodd PJ. Глобальное бремя латентной туберкулезной инфекции: переоценка с использованием математического моделирования. PLoS Med 2016;13(10):e1002152-e1002152.
2. Глобальный отчет по туберкулезу, 2017 г. Женева: Всемирная организация здравоохранения, 2017 г.
3. Dheda K, Gumbo T, Maartens G, et al. Эпидемиология, патогенез, передача, диагностика и лечение полирезистентного, широкорезистентного и неизлечимого туберкулеза.Lancet Respir Med 2017 15 марта (Epub перед печатью).
4. Harris RC, Sumner T, Knight GM, White RG. Систематический обзор математических моделей, изучающих эпидемиологическое воздействие будущих противотуберкулезных вакцин. Hum Vaccin Immunother 2016;12:2813-2832.
5. Мангтани П., Абубакар И., Арити С. и др. Защита вакциной БЦЖ от туберкулеза: систематический обзор рандомизированных контролируемых испытаний. Clin Infect Dis 2014; 58:470-480.
6. Аль-Аттия Р., Мустафа А.С., Абал А.Т., Эль-Шами А.С., Далеманс В., Скейки Я.А. Клеточные иммунные ответы in vitro на сложные и недавно определенные рекомбинантные антигены Mycobacterium tuberculosis. Clin Exp Immunol 2004; 138:139-144.
7. Скейкий Ю.А., Лодес М.Ю., Гудериан Ю.А., и др. Клонирование, экспрессия и иммунологическая оценка двух предполагаемых секретируемых антигенов сериновой протеазы Mycobacterium tuberculosis. Infect Immun 1999;67:3998-4007.
8. Dillon DC, Alderson MR, Day CH, et al. Молекулярная характеристика и ответы Т-клеток человека на представителя нового семейства генов Mycobacterium tuberculosis mtb39. Infect Immun 1999;67:2941-2950.
9. Day CL, Tameris M, Mansoor N, et al. Индукция и регуляция Т-клеточного иммунитета новой противотуберкулезной вакциной M72/AS01 у взрослых в Южной Африке. Am J Respir Crit Care Med 2013; 188:492-502.
10. Gillard P, Yang PC, Danilovits M, et al. Безопасность и иммуногенность противотуберкулезной вакцины-кандидата M72/AS01E у взрослых с туберкулезом: рандомизированное исследование фазы II. Туберкулез (Эдинб) 2016; 100:118-127.
11. Идоко О.Т., Оволаби О.А., Овиафе П.К. и др. Безопасность и иммуногенность противотуберкулезной вакцины-кандидата M72/AS01 при введении в качестве бустерной дозы БЦЖ новорожденным в Гамбии: открытое рандомизированное контролируемое исследование.Туберкулез (Эдинб) 2014;94:564-578.
12. Кумарасами Н., Пунгулали С., Боллаертс А. и др. Рандомизированное контролируемое исследование безопасности и иммуногенности противотуберкулезной вакцины-кандидата M72/AS01 у ВИЧ-позитивных взрослых индийцев. Медицина (Балтимор) 2016; 95 (3): e2459-e2459.
13. Leroux-Roels I, Forgus S, De Boever F, et al. Улучшенный ответ CD4⁺ Т-клеток на Mycobacterium tuberculosis у взрослых с PPD-отрицательным результатом с помощью вакцины M72/AS01 по сравнению с вакцинами-кандидатами M72/AS02 и Mtb72F/AS02: рандомизированное исследование.Вакцина 2013;31:2196-2206.
14. Montoya J, Solon JA, Cunanan SR, et al. Рандомизированное контролируемое исследование фазы II по подбору дозы противотуберкулезной вакцины-кандидата M72/AS01 у здоровых взрослых с PPD-положительным результатом. J Clin Immunol 2013;33:1360-1375.
15. Penn-Nicholson A, Geldenhuys H, Burny W, et al. Безопасность и иммуногенность вакцины-кандидата M72/AS01E у подростков в эндемичных по туберкулезу условиях. Вакцина 2015;33:4025-4034.
16. Thacher EG, Cavassini M, Audran R, et al. Безопасность и иммуногенность противотуберкулезной вакцины-кандидата M72/AS01 у ВИЧ-инфицированных взрослых, получающих комбинированную антиретровирусную терапию: фаза I/II, рандомизированное исследование. СПИД 2014;28:1769-1781.
17. Уильямс А., Орм И.М. Животные модели туберкулеза: обзор. Микробиологический спектр 2016;4(4).
18. Skeiky YA, Alderson MR, Ovendale PJ, et al. Дифференциальные иммунные ответы и защитная эффективность, индуцированные компонентами противотуберкулезной полипротеиновой вакцины Mtb72F, доставляемой в виде «голой» ДНК или рекомбинантного белка.J Immunol 2004; 172:7618-7628.
19. Brandt L, Skeiky YA, Alderson MR, et al. Защитный эффект вакцины Mycobacterium bovis BCG усиливается при совместном введении с Mycobacterium tuberculosis 72-килодальтонным слитым полипротеином Mtb72F у морских свинок, инфицированных M.tuberculosis . Infect Immun 2004;72:6622-6632.
20. Ценова Л., Горбачевский Р., Морейра А.Л., и др. Оценка полипротеиновой вакцины Mtb72F на модели туберкулезного менингита у кроликов.Infect Immun 2006;74:2392-2401.
21. Ирвин С.М., Иззо А.А., Доу С.В. и др. Отслеживание антиген-специфических CD8 Т-лимфоцитов в легких мышей, вакцинированных полипротеином Mtb72F. Infect Immun 2005;73:5809-5816.
22. Левинсон Д.А., Лайнс Р.А., Левинсон Д.М. Дендритные клетки человека, представляющие экспрессированный аденовирусом антиген, вызывают Mycobacterium tuberculosis -специфические CD8+ Т-клетки. Am J Respir Crit Care Med 2002;166:843-848.
23. Магомед Х., Хокридж Т., Вервер С. и др. Туберкулиновая кожная проба в сравнении с QuantiFERON TB Gold в прогнозировании заболевания туберкулезом в когортном исследовании подростков в Южной Африке. PLoS One 2011;6(3):e17984-e17984.
24. Tameris MD, Hatherill M, Landry BS, et al. Безопасность и эффективность MVA85A, новой противотуберкулезной вакцины, у детей раннего возраста, ранее вакцинированных БЦЖ: рандомизированное плацебо-контролируемое исследование фазы 2b. Ланцет 2013;381:1021-1028.
25. von Reyn CF, Mtei L, Arbeit RD, et al. Профилактика туберкулеза у ВИЧ-инфицированных взрослых, примированных бациллой Кальметта-Герена, усиленных инактивированной цельноклеточной микобактериальной вакциной. СПИД 2010;24:675-685.
26. Nemes E, Geldenhuys H, Rozot V, et al. Профилактика инфекции M.tuberculosis с помощью вакцины h5:IC31 или ревакцинации БЦЖ. N Engl J Med 2018; 379: 138-149.
27. Кадена А.М., Форчун С.М., Флинн Д.Л.Гетерогенность при туберкулезе. Nat Rev Immunol 2017;17:691-702.
28. Behr MA, Warren SA, Salamon H, et al. Передача Mycobacterium tuberculosis от пациентов с отрицательным мазком на кислотоустойчивые бациллы. Ланцет 1999;353:444-449.
29. Barreto ML, Pereira SM, Pilger D, et al. Доказательства влияния ревакцинации БЦЖ на заболеваемость туберкулезом у детей школьного возраста в Бразилии: второй отчет кластерного рандомизированного исследования БЦЖ-REVAC.Вакцина 2011; 29:4875-4877.
30. Andrews JR, Nemes E, Tameris M, et al. Серийное тестирование QuantiFERON и риск заболевания туберкулезом среди детей раннего возраста: обсервационное когортное исследование. Ланцет Респир Мед 2017; 5:282-290.
31. Lau E, Tucker Rutkowski K, van Brakel E, et al. Распространенность латентной туберкулезной инфекции среди взрослых в эндемичных регионах, прошедших скрининг для фазы IIb, двойного слепого, рандомизированного, плацебо-контролируемого исследования для оценки вакцины-кандидата GSK M72/AS01E.Представлено на 21-й Международной конференции по СПИДу, Дурбан, ЮАР, 16 июля 2016 г. (постер).
32. Магомед Х., Хокридж Т., Вервер С. и др. Прогностические факторы латентной туберкулезной инфекции среди подростков в районах с высоким бременем болезни в Южной Африке. Int J Tuberc Lung Dis 2011;15:331-336.
33. Магомед Х., Хьюз Э.Дж., Хокридж Т. и др. Сравнение кожной пробы Манту с тремя поколениями анализа IFN-гамма цельной крови на туберкулезную инфекцию.Int J Tuberc Lung Dis 2006; 10:310-316.
34. Wood R, Liang H, Wu H, et al. Изменение распространенности туберкулезной инфекции с возрастом в городах с высоким бременем болезни в Южной Африке. Int J Tuberc Lung Dis 2010;14:406-412.
35. Benator D, Bhattacharya M, Bozeman L, et al. Рифапентин и изониазид один раз в неделю по сравнению с рифампицином и изониазидом два раза в неделю для лечения лекарственно-чувствительного туберкулеза легких у ВИЧ-отрицательных пациентов: рандомизированное клиническое исследование.Ланцет 2002;360:528-534.
Универсальная вакцинация БЦЖ и защита от COVID-19: критика экологического исследования
Хотя специфического лечения или вакцины против COVID-19 не существует, недавнее исследование показало потенциальную эффективность существующей вакцины, вакцины Bacille Calmette-Guérin (BCG), против COVID-19.
Вакцина БЦЖ используется в некоторых странах для профилактики туберкулеза (ТБ), бактериального инфекционного заболевания, вызываемого Mycobacterium tuberculosis (Mtb), на долю которого приходилось 1.5 миллионов смертей во всем мире в 2018 г. Национальная политика вакцинации БЦЖ различается в разных странах: всеобщая вакцинация БЦЖ при рождении все еще проводится в странах с высоким бременем туберкулеза, таких как Индия и Эфиопия, в то время как страны с более низкой общей заболеваемостью туберкулезом в основном прекратили всеобщую вакцинацию БЦЖ в пользу адресной вакцинации конкретных групп риска по ТБ (например, детей из семей, иммигрировавших из стран с высоким бременем ТБ). Всемирный атлас BCG, созданный Международным противотуберкулезным центром McGill, содержит данные о политике и практике BCG во всем мире.
Кабинет
Для исследования, проведенного Miller et al., политика вакцинации БЦЖ в разных странах была собрана из Атласа мира БЦЖ. Данные о случаях COVID-19 и смертности по странам были получены 21 марта 2020 г. с https://google.org/crisisresponse/covid19-map. Экологический анализ выявил связь между уровнем смертности от COVID-19 и политикой всеобщей вакцинации БЦЖ в странах со средним и высоким уровнем дохода. Авторы также наблюдали связь между случаями COVID-19 на душу населения и политикой вакцинации БЦЖ, при этом страны с политикой всеобщей вакцинации БЦЖ имели более низкие показатели заболеваемости на душу населения и смертности.Основываясь на анализе, авторы заявляют: «Корреляция между началом всеобщей вакцинации БЦЖ и защитой от COVID-19 предполагает, что БЦЖ может обеспечить длительную защиту от текущего штамма коронавируса».
Критика
Дизайн исследования
Основная проблема этого исследования заключается в его дизайне. Экологические исследования часто объединяют воздействия на уровне населения, такие как общенациональные политики, с воздействиями на индивидуальном уровне, такими как влияние вакцины БЦЖ на организм человека.То, что может иметь место на агрегированном уровне, не обязательно будет верным, если принять во внимание разнородность индивидуумов. В этом исследовании доказательства низкого качества, наблюдаемые на уровне популяции, используются для того, чтобы сделать широкие выводы об эффективности БЦЖ на индивидуальном уровне. Методы экологического анализа просто не могут напрямую информировать об этиологии взаимосвязей между воздействием и заболеванием; скорее, они хорошо служат нам как строго генерирующие гипотезы запросы, и их не следует расширять за пределы этой цели.
Время имеет значение
С момента проведения анализа (данные о COVID-19 были загружены 21 марта 2020 г.) пандемия обострилась во многих странах, в том числе в странах с низким и средним уровнем дохода (СНСД), где БЦЖ вводится при рождении.Например, число случаев COVID-19 в Индии увеличилось со 195 на 21 марта до 1071 на 31 марта. В Южной Африке число случаев увеличилось с 205 на 21 марта до 1326 на 31 марта. страны улучшают свои эпидемические сроки (и расширяют диагностический потенциал). Например, как только мы увидим все последствия передачи вируса от сообщества в крупных густонаселенных странах, таких как Индия, где большое количество поденщиков теперь покидают города после того, как их уволили из-за общенационального карантина.Это подчеркивает, что делать преждевременные выводы на основе быстро меняющихся данных во время пандемии проблематично.
Отсутствие испытаний
Точный анализ зависит от точных данных, и мы знаем, что текущее число случаев коронавируса во всем мире сильно занижено из-за нехватки диагностических тестов. Количество тестов, проводимых на душу населения, сильно различается в зависимости от страны. Недооценка числа случаев в странах с низким уровнем дохода может полностью объяснить наблюдаемые авторами результаты.Например, в Индии один из самых низких показателей тестирования на COVID-19 в мире. Кроме того, каждая страна применяет собственный алгоритм для определения того, кто будет проходить тестирование. Таким образом, количество и состав известных случаев сильно зависят от стратегии тестирования. Авторы этого документа признают опасения, связанные с текущими оценками случаев COVID-19, а также используют смертность от COVID-19 в качестве меры серьезности вспышки в каждой стране. К сожалению, даже текущие данные о смертности от COVID-19 в некоторых частях мира ненадежны.В богатых странах верно то, что большинство смертей из-за COVID-19 происходит в больнице после того, как им поставили диагноз COVID-19. Однако мы знаем, что в СНСД даже до нынешней пандемии большинство смертей происходило дома без медицинской помощи. Люди, умирающие дома в странах с низким и средним доходом, вряд ли получат подтвержденный диагноз COVID-19, и их смерть может не быть учтена в государственных отчетах. Смертность от коронавируса также может быть пропущена в странах с высоким уровнем дохода, которые были поражены вирусом, например, в Италии.Очень сложно делать выводы о каком-либо потенциальном воздействии вакцинации БЦЖ, когда данные столь ошибочны.
Корреляция не является причинно-следственной связью
Критический недостаток методологии этого исследования очевиден в том факте, что предполагаемая связь между воздействием и результатом не означает, что одно вызывает другое — концепция, часто выражаемая в хорошо известной пословице «корреляция не подразумевает причинно-следственную связь. ” Это может произойти в ситуациях, когда другие основные факторы влияют как на экспозицию, так и на результат и тем самым создают ложную связь между ними (в эпидемиологии такая ситуация называется смешанной).В частности, в случае взаимосвязи между всеобщей вакцинацией БЦЖ и очевидным более низким числом случаев заболевания COVID-19 и смертей, связанных с COVID-19, играет роль множество основных факторов. Важный вывод здесь заключается в том, что если бы эти факторы можно было должным образом учесть, мы, скорее всего, , а не , увидели бы связь между вакцинацией БЦЖ и защитой от COVID-19, предложенную в этой статье. Обеспокоенность по поводу качества данных теперь становится потенциальным источником путаницы в отношениях между вакцинацией БЦЖ и меньшим числом случаев COVID-19.Вполне вероятно, что недостаточно финансируемые системы здравоохранения в (СНСУД) имеют низкий потенциал тестирования на COVID-19 и в то же время с большей вероятностью сохранят политику универсальной вакцинации БЦЖ, учитывая, что бремя ТБ является самым высоким в СНСД. Таким образом, исследование на самом деле не демонстрирует, что население в странах с универсальной политикой вакцинации БЦЖ каким-то образом более защищено от COVID-19, потому что более низкие показатели заболеваемости и смертности могут быть в большей степени связаны с низкими возможностями тестирования, чем с какой-либо предполагаемой защитной способностью БЦЖ.Таким образом, заявления в документе, которые подразумевают причинно-следственную связь, такие как заявление о том, что «вакцинация БЦЖ также снизила количество зарегистрированных случаев COVID-19 в стране», вводят в опасное заблуждение, особенно в контексте, когда количество зарегистрированных случаев в значительной степени является функцией возможностей тестирования и стратегии тестирования, а не фактической относительной нагрузки.
Еще одним важным соображением является то, что трудно сделать выводы о причинно-следственных связях в широком диапазоне стран с различными базовыми демографическими характеристиками, такими как различия в возрастном распределении изучаемого населения.Особенно это касается заболеваний, тяжесть которых зависит от возраста. Как показано в недавнем исследовании, проведенном в Ухане, Китай, пожилые люди подвергаются более высокому риску тяжелого течения COVID-19, поэтому различия в возрастном распределении населения могут существенно влиять на показатели смертности, наблюдаемые в разных странах (например, регионы ВОЗ Юго-Восточной Азии). В Азии и Африке средний возраст составляет 27,0 и 18,7 лет соответственно, в то время как население европейского региона намного старше (медиана 38,6 лет), что может отчасти способствовать более высокому уровню смертности, наблюдаемому в Европе).В свете этих соображений, учитывая, что в исследовании Miller et al. не использовался метод стандартизации возраста. необходимо подчеркнуть сильные ограничения сделанных выводов.
Биологическое правдоподобие
Наконец, некоторая «здравомыслящая» привлекательность утверждения этой статьи основана на некоторой ложной эквивалентности. Авторы дважды упоминают, что БЦЖ в целом защищает от респираторных заболеваний. Идея о том, что вакцина против инфекционного заболевания легких может также защитить от других инфекционных заболеваний легких, кажется несколько последовательной и, следовательно, приемлемой.Однако это становится загвоздкой, когда мы смотрим на тип туберкулеза, от которого БЦЖ защищает наиболее эффективно. Из-за неудачного естественного эксперимента, в ходе которого с 2013 по 2015 год наблюдалась глобальная нехватка вакцины БЦЖ, ретроспективные данные показывают, что произошел всплеск случаев туберкулезного менингита, то есть туберкулеза центральной нервной системы. Аккуратная идея вакцины от болезни легких, защищающей от другой болезни легких, то есть от COVID-19, не совсем проста, поскольку БЦЖ, по-видимому, обеспечивает наиболее значительную защиту от туберкулезного менингита.Кроме того, в области борьбы с туберкулезом хорошо известно, что вакцина БЦЖ обеспечивает защиту от туберкулеза только у детей младшего возраста, и эта защита почти полностью ослабевает к 12 годам. помочь расширить эту противотуберкулезную защиту. Важным выводом является то, что защитный эффект БЦЖ со временем ослабевает. Поэтому неясно, как вакцина, которая обеспечивает защиту на ранних этапах жизни человека, защитит людей от COVID-19, когда они достигнут преклонного возраста.
Выводы
От последней статьи в Forbes до Bloomberg результаты исследования набирают все большую популярность. Опасно ссылаться на то, что существуют доказательства того, что вакцина вековой давности может повышать иммунитет у людей, обеспечивая неспецифическую защиту от других заболеваний и, следовательно, защищая от COVID-19 или снижая тяжесть его проявления на основе только этого анализа. Принятие этих выводов за чистую монету может привести к самоуспокоенности в ответ на пандемию, особенно в СНСД.Достаточно только взглянуть на то, как это уже было представлено в новостных агентствах нескольких СНСД; опасность такого изображения, дезинформирующего общественность, не следует недооценивать, например, в таких странах, как Индия, широкий охват БЦЖ, предлагаемый их политикой всеобщей вакцинации, может создать ложное чувство безопасности и привести к бездействию. Если подобные утверждения, основанные на недостаточных доказательствах, будут мешать ответным мерам на пандемию, наиболее уязвимые группы населения больше всего пострадают от последствий.
Дальнейшие исследования могут показать, что вакцина БЦЖ обеспечивает защиту от COVID-19; однако при нынешнем состоянии знаний мы не можем утверждать это с какой-либо степенью уверенности, а экологическое исследование не дает достаточных доказательств. Чтобы проанализировать эту взаимосвязь, необходимы дополнительные фундаментальные научные исследования и надлежащим образом спланированные испытания. Австралийские испытания должны начаться в ближайшее время, чтобы выяснить, защищает ли вакцинация БЦЖ от COVID-19 или снижает тяжесть течения COVID-19 у австралийских медицинских работников.Если в хорошо проведенном испытании мы действительно увидим пользу от перепрофилирования этой вакцины, доказательства будут гораздо более убедительными.
ТУБЕРКУЛИН ППД РТ 23 ССИ (2 ТУ)
Описание Туберкулин PPD RT 23 (2TU) представляет собой очищенное белковое производное, приготовленное из культуры семи отобранных штаммов Mycobacterium tuberculosis. Это прозрачная жидкость от бесцветного до светло-желтоватого цвета. Одна доза (0,1 мл) содержит 2 туберкулиновых единицы, что соответствует 0,04 мкг Tuberculin PPD RT 23. Композиция Каждый DOS (1 мл) содержит: туберкулин PPD RT 23 из: Mycobacterium Tuberculosis 0,4 MCG Дигидрат фосфата диадром MCG 7,6 MCG Дигидрод-дигидроциат 1,45 мкг хлорид натрия 4,8 мкг гидроксихиминолин сульфат 100 мкг Polysorbate 80 50 мкг Вода для инъекций 1 мл Показания Для Проба Манту для диагностики туберкулеза. Введение Тест проводится внутрикожной инъекцией точно 0,1 мл раствора туберкулина. Важно, чтобы инъекция делалась в верхний слой кожи, так как возможную положительную реакцию будет трудно интерпретировать, если туберкулин введен слишком глубоко. Место инъекции предпочтительнее в средней трети предплечья или в области сгибателей. Чтение и оценка Диаметр уплотнений измеряют через 48–72 часа после инъекции. Хранение PPD RT 23 следует хранить при температуре от +2°C до +8°C.Защищен от света. Не мерзни. Срок годности 3 года. После вскрытия флакона туберкулина PPD RT 23 его содержимое следует использовать в течение 24 часов. Оставшееся нужно выбросить. Презентация
- Флакон 1,5 мл
- Флакон 1,5 мл
Примечание На месте инъекции избегать:
- поцарапать или потереть
- взять антисептик, мыло или другие вещества
- покрытие бинтом
Показания теста Манту | ||
отрицательный | Положительный | Сильно положительный |
0-5 мм | 6-14 мм | 15 + мм |
Местные иммунные реакции на туберкулиновую кожную пробу у павианов, вакцинированных Mycobacterium bovis БЦЖ: пилотное исследование молодых и старых животных | Иммунитет и старение
Процедуры на животных
Исследования проводились на четырех (двух взрослых и двух пожилых) бабуинах из обычной колонии в Центре медицинских наук Университета Оклахомы (OUHSC) [Рис.1]. Все животные содержались в помещениях с уровнем биобезопасности животных 1 (ABSL1) в OUHSC на время исследования. Все процедуры были одобрены университетским комитетом по уходу и использованию животных при OUHSC и комитетом по биобезопасности OUHSC. Животных вакцинировали Mycobacterium bovis BCG (штамм Pasteur, ATCC, Manassas, VA) внутрикожно в плечо в дозе 5 × 10 5 КОЕ. Кожные тесты проводили на животных в моменты времени, указанные на рис.1 путем инъекции 100 мкл туберкулина (Colorado Serum Company, Денвер, Колорадо), содержащего 5 туберкулиновых единиц очищенного производного белка (PPD). Инъекции физиологического раствора (100 мкл 0,9% NaCl, Baxter International Inc., Дирфилд, Иллинойс) выполняли животным в качестве отрицательного контроля. Все кожные пробы проводили на коже грудной клетки животных в соответствии со схемой на рис. 1. Все животные имели положительные ответы ТКП в исследовании, определяемые визуальным наблюдением (рис. 1в). Через 72 ч и 7 дней после кожной пробы из мест инъекций туберкулина и физиологического раствора были получены 8-мм биопсии кожи (ThermoFisher Scientific, Уолтем, Массачусетс) (схема на рис.1). Все биопсии были отправлены в течение ночи в Техасский институт биомедицинских исследований (Texas Biomed) для последующей обработки. Кровь собирали в натрий-гепарин-вакутайнеры в соответствии с графиком на рис. 1 и отправляли в течение ночи в Texas Biomed для обработки. Все процедуры проводились под анестезией (10 мг/кг кетамина и 0,05–0,5 мг/кг ацепромазина, Covetrus, Portland, ME) и включали мониторинг массы тела, температуры тела, частоты сердечных сокращений, частоты дыхания и времени наполнения капилляров.
Подготовка и хранение биоптатов кожи
Сразу после сбора в OUHSC каждую 8-мм биопсию кожи разрезали пополам с помощью патологического лезвия, и половинки биопсии хранили в 10% нейтральном забуференном формалине (ThermoFisher Scientific), быстро замораживали в жидким азотом или подготовленным для электронного парамагнитного резонанса (ЭПР).Оставшаяся ткань кожи была сохранена для дальнейшего анализа. Для ЭПР-анализа биоптаты кожи разделяли на две части, взвешивали и инкубировали со следующим: 1) 400 мкМ CMH-гидрохлорида (Enzo Life Sciences, Farmingdale, NY) или 2) 400 мкМ CMH + 500 нМ ротенона (MP Biomedicals). , Санта-Ана, Калифорния) + 100 мкМ антимицина А из Streptomyces sp. (MilliporeSigma, Берлингтон, Массачусетс) (CMH + RA) в течение 30 мин при 37 °C. После 30-минутной инкубации раствор CMH или CMH + RA удаляли из ткани и хранили в криопробирке.Как ткани, так и растворы CMH быстро замораживали в жидком азоте. Биопсии отправлялись на сухом льду (быстрозамороженные ткани) или при комнатной температуре (ткани в формалине) в Texas Biomed для последующей обработки.
Приготовление гомогенатов тканей из биопсий кожи
Биопсии кожи (быстрозамороженные в жидком азоте) гомогенизировали в пробирках Lysing Matrix D (MP Biomedicals) в реагенте для экстракции тканей I (ThermoFisher Scientific) с полным мини-коктейлем ингибиторов протеаз (MilliporeSigma). ).Содержание белка определяли с помощью набора для анализа белка Pierce BCA (ThermoFisher Scientific) в соответствии с инструкциями набора.
Анализ Luminex для измерения иммунных медиаторов
Иммунные медиаторы измеряли в супернатантах клеток, плазме и гомогенатах тканей с использованием следующих анализов Luminex, перекрестно реагирующих с павианами: Цитокин NHP XL для обнаружения CCL5, CCL20, CXCL10, IL1β, IL2, IL6, TNFα и IL8 и цитокин человека XL для обнаружения CCL2, CXCL10, IL8, IL1β и IL6 (R&D Systems, Миннеаполис, Миннесота), в соответствии с инструкциями набора.Для обнаружения IFN-γ и IL2 выполняли набор ELISA для интерферона-гамма (IFN-γ) обезьяны и набор ELISA для IL-2 обезьяны (Mabtech, Inc., Цинциннати, Огайо) в соответствии с инструкциями к набору. Для гомогенатов тканей уровни аналита нормализовали к содержанию белка в гомогенатах (пг аналита на мкг белка), как определено анализом BCA.
Измерение уровней окисления тканей
Для определения супероксида с помощью ЭПР, КМГ и КМГ + RA супернатанты тканей оттаивали и загружали в кварцевую кювету.Уровни супероксида в образцах определяли методом ЭПР. Спектры ЭПР получали на системе Bruker EMXnano ESR (Bruker Corporation, Массачусетс, США) при следующих параметрах: частота 9,636541 ГГц; Центральное поле, 3435,30 G; Амплитуда модуляции, 2.000G; Мощность 0,3162 мВт; Время преобразования 40,00 мс; постоянная времени 1,28 мс; Ширина развертки 100,0 G; Усиление приемника на уровне 40 дБ; и 1 общее количество сканирований. Образцы были скорректированы по базовой линии только относительно CMH (контроль). Затем определяли площадь под кривой для каждого образца.
Карбонилы белков в гомогенатах тканей кожи определяли с использованием набора Oxiselect Protein Carbonyl ELISA (Cell Biolabs, Inc., Сан-Диего, Калифорния) в соответствии с инструкциями набора. Уровни карбонила нормализовали по содержанию белка в гомогенатах, как определено анализом BCA.
Восстановленный глутатион (GSH) определяли в гомогенатах тканей кожи с использованием набора для определения соотношения GSH/GSSG (Abcam, Cambridge, MA) в соответствии с инструкциями к набору. Уровни глутатиона нормализовали по содержанию белка в гомогенатах, как определено анализом BCA.
Выделение РВМС из цельной крови
Кровь разбавляли 1X PBS и разделительной средой для лимфоцитов (Corning Life Sciences, Тьюксбери, Массачусетс) медленно распределяли под кровь с последующим центрифугированием при 950 xg в течение 20 мин при комнатной температуре с отсоединенным тормоз. После центрифугирования интерфейс, содержащий РВМС, переносили в новую пробирку, один раз промывали 1X PBS и лизировали эритроциты (свежеприготовленный лизирующий раствор, содержащий 0,15 М NH 4 Cl, 10 мМ KHCO 3 , 0.1 мМ Na 2 -ЭДТА). Клетки дважды промывали для удаления лизирующего раствора и повторно суспендировали в полной среде: 1X RPMI 1640 с добавлением 25 мМ HEPES (MilliporeSigma), 10% термоинактивированной эмбриональной бычьей сыворотки (Atlas Biologicals, Fort Collins, CO), 1% HyClone, 1% L-глутамина и 1% незаменимых аминокислот MEM (все от ThermoFisher Scientific).
Стимуляция РВМС
Для стимуляции клеток РВМС высевали при конечной концентрации 250 000 клеток на лунку. Клетки стимулировали в течение 5 дней в присутствии среды или белка культурального фильтрата Mycobacterium tuberculosis (CFP), который содержит перекрестно-реактивные антигены БЦЖ (BEI Resources, Manassas, VA).Для инкубации в течение 24–28 часов использовали CFP в концентрации 20 мкг/мл. Для 5-дневных инкубаций использовали CFP в концентрации 10 мкг/мл. Супернатанты собирали в конце инкубации и хранили при - 80 °C.
Замораживание и оттаивание РВМС
Для подготовки РВМС к замораживанию клетки ресуспендировали в концентрации 10 × 10 6 кл/мл в среде для замораживания: 85% термоинактивированного FBS + 10% ДМСО + 5% 45% раствор глюкозы (MilliporeSigma). Криопробирки, содержащие 1 мл клеточной суспензии, переносили в предварительно охлажденную пробирку Mr.Замораживать и хранить при температуре - 80 °C не более 48 часов. Затем флаконы переносили в жидкий азот для длительного хранения. Для оттаивания PBMC в предварительно нагретую полную среду добавляли 0,2 мкл/мл бензоназы HC (MilliporeSigma). Криопробирки, содержащие замороженные РВМС, быстро оттаивали на водяной бане при 37 °C. После оттаивания в каждую криопробирку добавляли 1 мл клеточной среды + 0,2 мкл/мл бензоназы, и этот объем переносили в коническую пробирку на 15 мл. Клетки центрифугировали при 250 x g в течение 7 мин при комнатной температуре.Затем клетки повторно суспендировали в полной клеточной среде и подсчитывали для последующих анализов.
Миграция РВМС в гомогенаты кожной ткани
Миграцию РВМС определяли с помощью 96-луночного анализа миграции клеток CytoSelect (5 мкМ, флуорометрический формат [Cell Biolabs, Inc]) в соответствии с инструкциями производителя. Вкратце, гомогенаты кожной ткани с известным содержанием белка в соответствии с анализом BCA были приготовлены при 50 мкг белка в конечном объеме 150 мкл бессывороточной среды (1X RPMI 1640 с добавлением 25 мМ HEPES, 1% HyClone, 1% L-глютамина, и 1% заменимых аминокислот MEM).Гомогенаты добавляли в нижнюю камеру планшета для миграции клеток в соответствии с гомогенным (от взрослого к взрослому; от возраста к старому) или гетерогенному (от взрослого к старому; от возраста к взрослому) экспериментальному плану. Затем 500 000 РВМС в бессывороточной среде добавляли в верхнюю камеру планшета для миграции клеток и инкубировали в течение 6 ч при 37°С. В конце периода инкубации в планшет для сбора клеток добавляли раствор для открепления клеток. Затем среду в лунках верхней камеры планшета для миграции клеток, содержащую не мигрирующие клетки, удаляли, а планшет с верхней камерой для миграции клеток вставляли в лоток для сбора клеток на 30 мин при 37°С для отделения клеток.Нижние камеры планшета для миграции клеток откладывали в сторону. После инкубации для открепления клеток в прозрачный 96-луночный планшет добавляли 75 мкл среды для открепления (из планшета для сбора) и 75 мкл среды (из нижних камер планшета для миграции клеток). Буфер для лизиса и раствор красителя (из набора) добавляли в каждую лунку прозрачного 96-луночного планшета и инкубировали в течение 20 мин при комнатной температуре. После инкубации 150 мкл из прозрачного 96-луночного планшета переносили на прозрачное дно, черный планшет и флуоресценцию считывали в планшет-ридере с фильтром 485 нм/538 нм и отсечкой 530 нм.
Гистологический анализ кожной ткани
Биоптаты кожи, фиксированные в 10% нейтральном забуференном формалине, заливались парафином, делались срезы толщиной 4 мкм, окрашивались гематоксилином и эозином с использованием стандартных методов и оценивались сертифицированным ветеринарным патологоанатом из Texas Biomed. . Для оценки процента пораженного воспаления использовались следующие баллы: 1 = < 10%, 2 = < 25%, 3 = < 50%, 4 = < 75%, 5 = > 75%.




 Только в отличие от последнего варианта, новый способ многократно точнее отражает реальную картину. В частности, показатель точности пробы Манту составляет 50-70%, а проведение тестирования на основе диаскинтеста составляет не менее 90%.
Только в отличие от последнего варианта, новый способ многократно точнее отражает реальную картину. В частности, показатель точности пробы Манту составляет 50-70%, а проведение тестирования на основе диаскинтеста составляет не менее 90%.
 Eur Respir J. 2008; 32: 419–425. [PubMed] [Google Scholar]
Eur Respir J. 2008; 32: 419–425. [PubMed] [Google Scholar] К., Джаганнатха П.С., Вайдьянатан П.С., Джагота П.PPD RT23 для туберкулиновых обследований в Индии. Int J Tuberc Lung Dis. 2003; 7: 172–179. [PubMed] [Google Scholar]
К., Джаганнатха П.С., Вайдьянатан П.С., Джагота П.PPD RT23 для туберкулиновых обследований в Индии. Int J Tuberc Lung Dis. 2003; 7: 172–179. [PubMed] [Google Scholar] Заразить иммун.2000;68:990–993. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Заразить иммун.2000;68:990–993. [Бесплатная статья PMC] [PubMed] [Google Scholar] 1960; 81 (1 часть 2): 1–47. [PubMed] [Google Scholar]
1960; 81 (1 часть 2): 1–47. [PubMed] [Google Scholar] Стандартизация новой партии очищенного туберкулина (PPD), предназначенного для международного использования.Всемирный орган здравоохранения Быка. 1958; 19: 845–951. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Стандартизация новой партии очищенного туберкулина (PPD), предназначенного для международного использования.Всемирный орган здравоохранения Быка. 1958; 19: 845–951. [Статья бесплатно PMC] [PubMed] [Google Scholar] Scand J Infect Dis. 2007: 1–6. [PubMed] [Google Scholar]
Scand J Infect Dis. 2007: 1–6. [PubMed] [Google Scholar] , Магнуссон М., Андерсен А.Б., Кох С. Характеристика очищенного белкового производного туберкулина с использованием моноклональных антител: выделение реактивного компонента гиперчувствительности замедленного типа из культурального фильтрата M.tuberculosis. Сканд Дж. Иммунол. 1994;40:345–349. [PubMed] [Google Scholar]
, Магнуссон М., Андерсен А.Б., Кох С. Характеристика очищенного белкового производного туберкулина с использованием моноклональных антител: выделение реактивного компонента гиперчувствительности замедленного типа из культурального фильтрата M.tuberculosis. Сканд Дж. Иммунол. 1994;40:345–349. [PubMed] [Google Scholar] Может J Microbiol. 2004; 50:97–105. [PubMed] [Google Scholar]
Может J Microbiol. 2004; 50:97–105. [PubMed] [Google Scholar] Молекулярный анализ генетических различий между Mycobacterium bovis BCG и вирулентными M.крупный рогатый скот J Бактериол. 1996; 178:1274–1282. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Молекулярный анализ генетических различий между Mycobacterium bovis BCG и вирулентными M.крупный рогатый скот J Бактериол. 1996; 178:1274–1282. [Бесплатная статья PMC] [PubMed] [Google Scholar] , Холм А., Мтони И.М., Андерсен А.Б., Хаслоов К. Картирование эпитопа секретируемого белка MPT64 Mycobacterium tuberculosis, вызывающего гиперчувствительность замедленного типа.Заразить иммун. 1995;63:4613–4618. [Статья бесплатно PMC] [PubMed] [Google Scholar]
, Холм А., Мтони И.М., Андерсен А.Б., Хаслоов К. Картирование эпитопа секретируемого белка MPT64 Mycobacterium tuberculosis, вызывающего гиперчувствительность замедленного типа.Заразить иммун. 1995;63:4613–4618. [Статья бесплатно PMC] [PubMed] [Google Scholar] Г., Гопи П.Г., Ядав Р. и др. Ежегодный риск заражения туберкулезом среди племенного населения центральной Индии. Троп Мед Int Health. 2008; 13:1372–1377. [PubMed] [Google Scholar]
Г., Гопи П.Г., Ядав Р. и др. Ежегодный риск заражения туберкулезом среди племенного населения центральной Индии. Троп Мед Int Health. 2008; 13:1372–1377. [PubMed] [Google Scholar] FEMS Immunol Med Microbiol. 1999; 23:21–25. [PubMed] [Google Scholar]
FEMS Immunol Med Microbiol. 1999; 23:21–25. [PubMed] [Google Scholar] 2009; 13:312–316. [PubMed] [Google Scholar]
2009; 13:312–316. [PubMed] [Google Scholar] 1987; 80: 31–33.[PMC free article] [PubMed] [Google Scholar]
1987; 80: 31–33.[PMC free article] [PubMed] [Google Scholar] Am J Respir Crit Care Med. 2000; 161:1167–1171. [PubMed] [Google Scholar]
Am J Respir Crit Care Med. 2000; 161:1167–1171. [PubMed] [Google Scholar] 2010;10:35. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2010;10:35. [Бесплатная статья PMC] [PubMed] [Google Scholar] Eur Respir J. 2008; 32: 419–425. [PubMed] [Google Scholar]
Eur Respir J. 2008; 32: 419–425. [PubMed] [Google Scholar] К., Джаганнатха П.С., Вайдьянатан П.С., Джагота П.PPD RT23 для туберкулиновых обследований в Индии. Int J Tuberc Lung Dis. 2003; 7: 172–179. [PubMed] [Google Scholar]
К., Джаганнатха П.С., Вайдьянатан П.С., Джагота П.PPD RT23 для туберкулиновых обследований в Индии. Int J Tuberc Lung Dis. 2003; 7: 172–179. [PubMed] [Google Scholar] 1960; 81 (1 часть 2): 1–47. [PubMed] [Google Scholar]
1960; 81 (1 часть 2): 1–47. [PubMed] [Google Scholar] Стандартизация новой партии очищенного туберкулина (PPD), предназначенного для международного использования.Всемирный орган здравоохранения Быка. 1958; 19: 845–951. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Стандартизация новой партии очищенного туберкулина (PPD), предназначенного для международного использования.Всемирный орган здравоохранения Быка. 1958; 19: 845–951. [Статья бесплатно PMC] [PubMed] [Google Scholar] Scand J Infect Dis. 2007: 1–6. [PubMed] [Google Scholar]
Scand J Infect Dis. 2007: 1–6. [PubMed] [Google Scholar] , Магнуссон М., Андерсен А.Б., Кох С. Характеристика очищенного белкового производного туберкулина с использованием моноклональных антител: выделение реактивного компонента гиперчувствительности замедленного типа из культурального фильтрата M.tuberculosis. Сканд Дж. Иммунол. 1994;40:345–349. [PubMed] [Google Scholar]
, Магнуссон М., Андерсен А.Б., Кох С. Характеристика очищенного белкового производного туберкулина с использованием моноклональных антител: выделение реактивного компонента гиперчувствительности замедленного типа из культурального фильтрата M.tuberculosis. Сканд Дж. Иммунол. 1994;40:345–349. [PubMed] [Google Scholar]